三黄三仙汤对再生障碍性贫血小鼠骨髓间充质干细胞的作用研究*
江 砚 胡轶娟
1 浙江省杭州市第一人民医院 浙江 杭州 310006 2 浙江省中医药研究院 浙江 杭州 310007
骨髓间充质干细胞(MSCs)是一群存在于骨髓中的非造血干细胞,具有多向分化的潜能,在适宜的条件下能分化为成骨、软骨、脂肪、肌腱、肌肉、神经元和骨髓基质细胞等,同时具有支持造血[1]和免疫调节功能[2]。MSCs作为骨髓基质细胞的前体细胞,是骨髓内造血微环境的重要组成部分。
三黄三仙汤是由生黄芪、黄芩、黄精、仙鹤草、仙灵脾、仙茅为主方药物组成。其在临床用于再生障碍性贫血(AA)已取得一定疗效。前期研究证明,三黄三仙汤能加速恢复Se-137辐射小鼠的骨髓造血功能,故推测三黄三仙汤对MSCs有一定的干预作用。本文介绍三黄三仙汤对AA模型小鼠MSCs的干预作用研究,探讨其改善AA小鼠骨髓MSCs向成骨细胞分化的作用。
1 材料与方法
1.1 材料:分述如下。
1.1.1 实验药品:三黄三仙汤:生黄芪、黄精、仙鹤草各30g,黄芩20g,淫羊藿、鸡血藤各15g,仙茅18g,女贞子、当归、白芍、麦冬各12g,煎煮浓缩后,分别配制成浓度为5.15g生药/ml、2.58g生药/ml和1.29g生药/ml的溶液(相当于人用剂量的16倍、8倍、4倍)。PBS缓冲液(吉诺生物医药技术有限公司),胎牛血清(浙江天杭生物科技股份有限公司),青霉素、链霉素溶液,DMEM低糖、高糖培养液,胰蛋白酶-EDTA溶液,MCDB-201培养基均购于gibco公司;茜素红(天津市天新精细化工开发中心);MSC成骨诱导分化试剂盒(Biological Industries)。
1.1.2 仪器:五分类血细胞分析仪(sysmex XT-1800I),流式细胞仪(Flow Cytometer),离心机(Beckman Allegra X-15R),倒置显微镜(Nikon)。
1.1.3 实验动物:BALB/C小鼠,作为受体;DBA/2小鼠,作为供体。小鼠试验前在动物房环境中适应3d。
1.2 方法:分述如下。
1.2.1 动物分组及给药:实验共分6组,每组n=10只,其中包括正常对照组、模型对照组、阳性对照组(环孢菌素25mg/kg·d、1mg/ml)、三黄三仙汤低剂量组(简称低剂量组,浓度1.29g生药/ml)、三黄三仙汤中剂量组(简称中剂量组,浓度2.58g生药/ml)、三黄三仙汤高剂量组(简称高剂量组,浓度5.15g生药/ml)。参照文献[3],建立AA小鼠模型。灌胃给药,每日1次,共14d。模型组和正常组,灌胃给生理盐水25ml/kg·d。
1.2.2 外周血常规检测:处死观察满14d的小鼠,眼眶取血,检测外周血红细胞(RBC)、白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)。
1.2.3 骨髓有核细胞(BMNC)计数:取右侧股骨中段7mm,用培养液反复冲洗出骨髓细胞。按常规WBC计数法计数BMNC。
1.2.4 各组MSCs的培养、传代及鉴定:用处死后的各组小鼠的胫骨、股骨,用含肝素的DMEM培养液冲出骨髓,2000r/min离心5min,取单核细胞层,加入含60%DMEM,40%MCDB-201,2%FBS,10ng/ml FGF,10ng/ml PDGF-BB,10ng/ml EGF的培养基,计数后接种(细胞浓度为2×106/L),1d后换液,弃去未贴壁细胞,之后每3d换液一次。待细胞长至约80%~90%融合时,进行消化、传代。每日观察细胞形态。取第三代MSCs,用流式细胞仪测定其免疫表型。
1.2.5 MSCs向成骨细胞分化培养:收集第三代MSCs,用MSCs成骨诱导分化试剂盒进行培养2周后,加入0.1%茜素红染色,在显微镜下观察钙结节,并记录钙结节数。
1.2.6 统计学方法:试验数据采用统计软件SPSS 19.0处理,采用单因素方差分析。计量数据以均数±标准差(±s)表示,组间比较方差齐时采用LSD检验,若方差不齐则采用Dunnett’s T3检验,以P<0.05为差异有统计学意义。
2 结果
2.1 外周血常规检测:与正常对照组比较,造模后各组的RBC、Hb、WBC、PLT计数明显降低(P<0.05),表明造模后小鼠的造血功能受到损害,造模成功。给药后,各剂量组和阳性药组的RBC、Hb、WBC、PLT计数均有所回升,与模型组相比,中、高剂量组的RBC、WBC计数显著升高(P<0.05),低、中、高剂量组的PLT计数显著升高(P<0.05)。结果见表1。
表1 各组小鼠外周血常规比较(±s)

表1 各组小鼠外周血常规比较(±s)
注:与正常对照组比较,*P<0.05;与模型对照组比较,△P<0.05。
组别正常对照组模型对照组阳性对照组低剂量组中剂量组高剂量组PLT(×109/L)636.00±47.86△166.59±38.56*553.27±70.84*△346.50±35.81*△351.39±42.83*△409.44±50.05*△例数10 10 10 10 10 10 RBC(×1012/L)7.49±0.79△4.42±0.68*5.71±0.82*△4.62±0.72*5.39±0.76*△5.69±0.82*△Hb(g/L)156.84± 9.10△114.89±10.53*120.15±12.30*117.57±13.37*117.99±12.66*131.88±20.83 WBC(×109/L)4.90±1.49 1.97±0.84*2.64±0.59*2.68±0.67*3.01±0.67*△3.42±0.68*△
2.2 对小鼠BMNC计数的影响:造模后,各组小鼠BMNC计数均较正常组显著减少(P<0.05)。给药后,各组的BMNC计数均有所增加,与模型对照组相比,高剂量组的BMNC计数显著增加(P<0.05)。见表2。
表2 三黄三仙汤对小鼠BMNC计数的影响(±s)
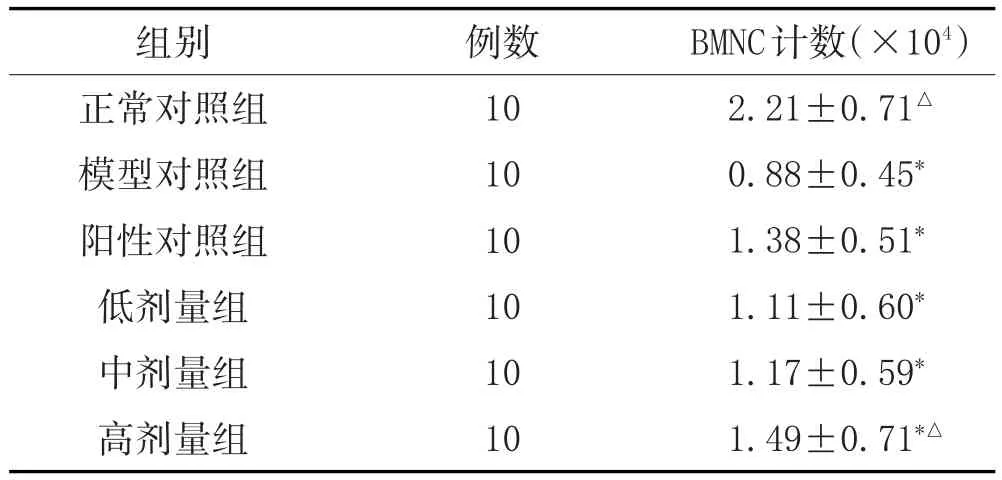
表2 三黄三仙汤对小鼠BMNC计数的影响(±s)
注:与正常对照组比较,*P<0.05;与模型对照组比较,△P<0.05。
BMNC计数(×104)2.21±0.71△0.88±0.45*1.38±0.51*1.11±0.60*1.17±0.59*1.49±0.71*△组别正常对照组模型对照组阳性对照组低剂量组中剂量组高剂量组例数10 10 10 10 10 10
2.3 各实验组MSCs的培养、传代及鉴定:各实验组小鼠的骨髓单个核细胞种入培养瓶培养7d后,倒置显微镜观察。正常空白组MSCs大小均匀,呈长梭形,排列规则生长;模型对照组有较多的类圆形细胞,MSCs大小不一,性状不规则,边缘不整齐,且较正常空白组少而稀。各给药组与模型对照组相比,细胞较规则,数量较多且密。传代细胞形态较均一,以梭形为主,见图1。各组小鼠的第三代MSCs细胞高表达CD29(78.7%~86.9%)和CD44(27.9%~36.9%),不表达造血细胞标志CD34(阴性表达),表明小鼠MSCs非小鼠骨髓中的造血细胞,见图2。

图1 倒置显微镜下各组第三代MSCs的形态(100×)
2.4 三黄三仙汤对骨髓MSC向成骨细胞的分化影响:与正常对照组相比,各组钙结节数目明显减少;给药后,各组的钙结节数有所增加,各剂量组相差不大。见图3。表明三黄三仙汤能促进骨髓MSCs向成骨细胞分化。
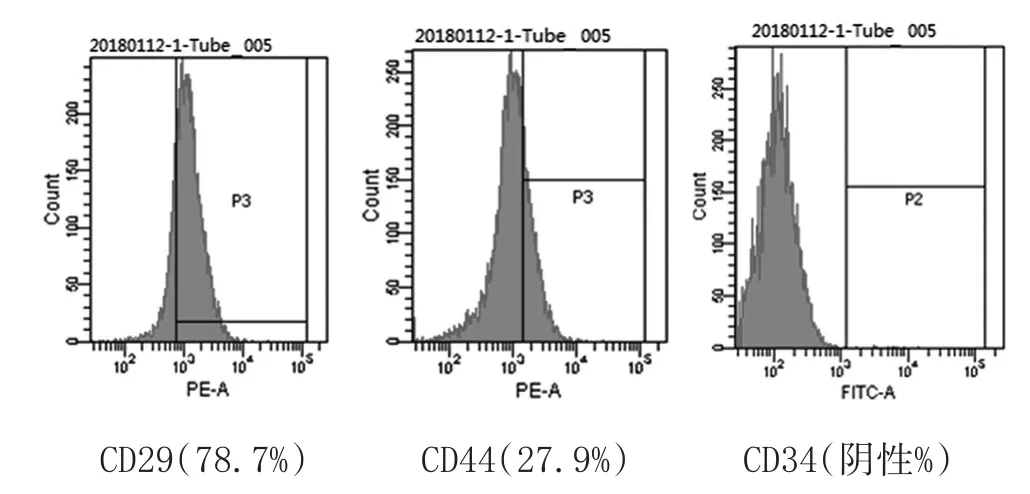
图2 第三代小鼠MSCs表面分子的表达流式细胞仪检测(正常对照组)
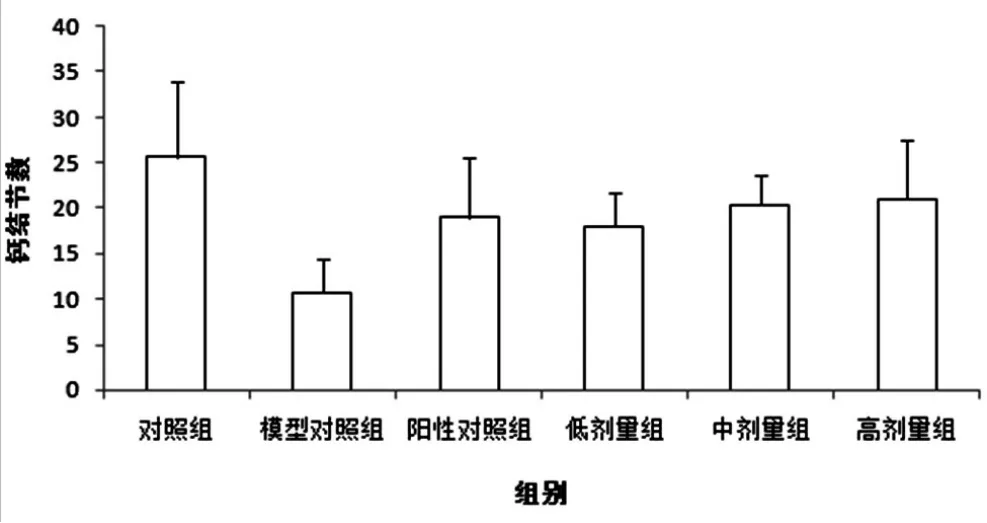
图3 各组小鼠MSCs成骨细胞培养钙结节数(n=3)
3 讨论
AA是骨髓造血组织减少及造血功能衰竭的一组综合征。原发性AA目前病因不明;继发性AA多由病毒感染、化学药物(如氨基比林等)及电离辐射等引起。目前AA的发病率呈逐年上升的趋势。AA仍然是医疗行业的一个“艰难的挑战”[4-5]。中医药在治疗AA方面起了很重要的作用。如周晔敏等[6]运用减障汤联合西药治疗AA取得较好疗效。本文采用的三黄三仙汤为我院中医专家的自拟经验方,方中黄芪益气补中,仙茅、淫羊藿补肾阳、强筋骨;黄精益气养阴、滋补脾肾;女贞子、麦冬补肾养阴;当归、鸡血藤、白芍养血活血;黄芩、仙鹤草清热凉血。全方具有益气养阴、补肾生血之功效。
本研究发现,在AA小鼠造模后应用三黄三仙汤进行干预,发现模型对照组及各治疗组自第2天起开始出现皮毛稀疏、散乱,饮食减少,大便干结,喜倦卧,活动少,体重明显下降,但是随着治疗时间的延长,各治疗组的上述症状均有不同程度的恢复。治疗后,三黄三仙汤组小鼠外周血的红细胞、白细胞、血红蛋白及血小板水平均明显高于模型组小鼠,BMNC计数也明显高于模型组。证实了三黄三仙汤能促进AA造血的恢复。
骨髓的正常造血依赖于造血干细胞与其微环境的相互作用,造血细胞的生长发育依赖造血微环境的结构和功能的完整性。造血微环境是机体的造血干细胞赖以生存的场所。来源于间充质干细胞的成骨细胞、血窦内皮细胞和窦间网状细胞,以及其细胞外基质共同构成造血微环境的主体。它们通过生成细胞因子、黏附因子和细胞表面受体,与造血干细胞相互作用,调节造血干细胞的增殖分化和迁移,以及成熟血细胞释放[7]。因此,促进MSCs向成骨细胞转化,有利于改善骨髓微环境,促进骨髓造血。研究表明,本方中的淫羊藿能促进MSCs向成骨细胞分化增殖,并能抑制MSCs向脂肪细胞转化[8-9]。本研究发现,造模后模型对照组的MSCs形态不规则,数量变少,向成骨细胞分化的能力减弱;治疗后,三黄三仙汤各组的MSCs与模型对照组相比,细胞较规则,数量较多且密,且向成骨细胞转化的能力增强,表明三黄三仙汤能改善AA小鼠骨髓微环境。
综上所述,三黄三仙汤对免疫介导再生障碍性贫血模型小鼠的疗效确切,能改善其骨髓造血微环境。此结果进一步完善了三黄三仙汤治疗AA的作用机理。

