8-氨基异紫堇碱对HO-8910PM增殖和迁移的抑制作用
纪 武,王圣坦,朱根海,贺国丽,洪 澜,王 雁
卵巢癌(ovarian carcinoma,OC)发病隐匿,大多数患者就诊时已处于中晚期[1]。近年来中草药的天然有效成分抗癌效果引起了广泛关注[2],其中8-氨基异紫堇碱(8-amino-isocorydine,8-NH2-ICD)是从罂粟科植物秃疮花中提取的以异紫堇碱为原料,经化合物化学结构衍生合成而来,通过对结构的进一步修饰。研究[3]显示,8-NH2-ICD可抑制人肺癌(A549)、胃癌(SGC7901)、肝癌(HepG2)细胞系体外生长,小鼠体内实验也表明异紫堇碱类衍生物为一种有效的抗癌剂且具有更低的毒副作用。该研究从肿瘤细胞增殖及迁移方面,探讨8-NH2-ICD对体外培养人高转移卵巢癌-8910PM(human high metastatic ovarian carcinoma-8910PM,HO-8910PM)细胞株的影响。
1 材料与方法
1.1 材料
1.1.1细胞株 人上皮OC细胞株HO-8910PM由中科院上海细胞库提供,纯度>99%,以高糖型DMEM(美国Gibco公司)培养液,加入10%标准胚牛血清(FBS,美国Gibco公司)、青-链霉素(美国Hyclone公司),放置在37 ℃、5% CO2及饱和湿度细胞培养箱中培养,在细胞生长至80%融合时,以0.25%胰蛋白酶(美国Hyclone公司)消化传代。
1.1.2主要仪器与试剂 酶标仪(Promega多功能化学发光仪)购自美国普洛麦格北京生物技术有限公司;倒置荧光显微镜(Axio Observer A1)购自德国Lecia公司;FACS Calibur Cell Sorting System型流式细胞仪购自美国BD公司。细胞增殖/毒性检测(cell counting kit-8,CCK-8)试剂盒购自美国Yeasen公司;细胞凋亡Hoechst染色试剂盒购自上海碧云天生物技术有限公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1分组 取对数生长期的OC细胞株HO-8910PM进行检测,试验分为阴性对照组、药物组,阴性对照组不经药物处理,仅加10% FBS培养液,药物组中药物浓度梯度依次为5、10、20、40 μg/ml。
1.2.2CCK-8法检测细胞增殖抑制率 在1.1.1 所述条件下对人上皮性OC细胞HO-8910PM进行培养,将对数生长期细胞移入96孔细胞培养板,细胞密度1×105个/ml,每孔加入200 μl细胞悬液,培养12 h见细胞贴壁后加入配置好的工作浓度药液,各药物浓度均设5个平行复孔,阴性对照组只加培养液,不加细胞。于酶标仪450 nm处测定各孔吸光度(optical density,OD)值,空白对照孔为调零孔。细胞增殖抑制率(%)=(1-药物组OD值)/阴性对照组OD值×100%,实验重复3次。
1.2.3Hoechst染色观察HO-8910PM细胞凋亡形态 将生长稳定的HO-8910PM细胞传代至6孔板中(底部放置一盖玻片),每孔细胞数量约105个,培养待细胞贴壁并覆盖培养孔50%时,分别按阴性对照组、8-NH2-ICD 5、10、20、40 μg/ml 5个分组方式加药处理至72 h,应用Hoechst染色试剂盒进行检测,染色5 min吸去染色液,盖上有细胞的盖玻片制备临时装片并观察细胞形态,细胞发生凋亡时,染色质固缩,Hoechst染色时细胞核呈致密浓染或碎块致密浓染。
1.2.4流式细胞术检测细胞周期 将培养细胞HO-8910PM以1×105个/ml密度接种在6孔板上,吸去培养基,加入2 ml 1640培养液及不同浓度8-NH2-ICD的1640培养液,每孔设立2个复孔。作用24 h后离心收集细胞,应用PBS洗涤1次,加入预冷70%乙醇固定过夜;第2天以2 500 r/min离心5 min,收集细胞,PBS洗涤1次,以0.5 ml PBS重悬,按照Cycle Test-Plus DNA Reagent Kit(美国BD公司)试剂盒说明书进行染色,以注射器吸取细胞悬液,经尼龙滤网过滤后上流式细胞仪,应用Mod Fit LT软件分析各样品中细胞周期分布情况。
1.2.5Transwell小室测定细胞迁移能力 将Matrigel以无血清培养基稀释至50 μg/ml,每小室加50 μl,4 ℃冰箱过夜风干,第2天在超净台照射2 h,加入100 μl含10 μg/L牛血清白蛋白的无血清培养液湿化,对照组加入细胞培养液,其他各组加入不同浓度8-NH2-ICD,置于培养箱中培养,参照郑爱文等[4]提出的方法评估细胞侵袭能力。本研究选择阴性对照组、药物组中40 μg/ml 8-NH2-ICD进行统计学分析。
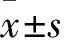
2 结果
2.1 细胞增殖抑制率检测结果随时间、药物浓度增加,HO-8910PM细胞增殖抑制率增加(P<0.05),在5~20 μg/ml范围内有明显量效、时效关系,至20 μg/ml时对细胞增殖抑制作用基本已达最大值。见表1。
2.2 细胞凋亡形态观察结果细胞经Hoechst 33258染色后,于荧光显微镜下观察,发现阴性对照组细胞呈弥散均匀的淡蓝色荧光,添加8-NH2-ICD的细胞株出现细胞核固缩、荧光致密发亮、大小不同颗粒状强蓝色荧光等凋亡形态变化(如箭头所示),尤其随8-NH2-ICD浓度增加,凋亡进程加快,染色质凝聚现象及凋亡小体明显增多,凋亡小体释放增多,细胞膜变形更明显。见图1。
2.3 细胞周期检测结果流式细胞技术检测结果显示,8-NH2-ICD作用72 h后,与阴性对照组比较,浓度在5~20 μg/ml时对细胞周期作用不明显,浓度为40 μg/ml时S期细胞减少,G0/G1期细胞比例增加,差异有统计学意义(P<0.05),8-NH2-ICD对HO-8910PM细胞周期阻滞在G0/G1期。见表2、图2。

表1 细胞增殖抑制率检测结果
同一浓度与24 h比较:*P<0.05;同一浓度与48 h比较:#P<0.05;同一时点与5 μg/ml比较:△P<0.05;同一时点与10 μg/ml比较:▲P<0.05;同一时点与20 μg/ml比较:☆P<0.05

表2 细胞周期检测结果
与阴性对照组比较:*P<0.05

图1 培养72 h后
Hoechst染色结果×200
A:阴性对照组;B:8-NH2-ICD 5 μg/ml药物组;C:8-NH2-ICD 10 μg/ml药物组;D:8-NH2-ICD 20 μg/ml药物组;E:8-NH2-ICD 40 μg/ml药物组

表3 细胞迁移能力检测结果个/视野,n=3)
与24 h比较:*P<0.05;与48 h比较:#P<0.05
2.4 细胞迁移能力检测结果Transwell小室检测结果显示,处理24、48、72 h时药物组侵袭至滤镜下表面的细胞数明显减少,且均低于阴性对照组,尤其是48、72 h时差异有统计学意义(P<0.05)。见表3、图3。
3 讨论
OC发病率仅次于宫颈癌、乳腺癌,寻找新的治疗方案迫在眉睫[5]。我国药材资源丰富,尤其是西北地区天然草药及其有效成分的抗病毒、抗癌效果已得到广泛关注,其中秃疮花具有清热解毒、消肿止痛、杀虫等功能,含有异紫堇碱、紫堇碱等活性成分[6],研究[7]表明异紫堇碱不仅通过将细胞周期阻滞于G2/M期及诱导细胞凋亡而抑制肝癌细胞增殖,也能通过靶向诱导耐药性侧群细胞相关因子凋亡,但其有效剂量200 μmol/L于临床治疗而言为相对高剂量,为减少异紫堇碱剂量及改进抗癌活性,将异紫堇碱通过化学修饰、结构改造得到8-NH2-ICD。
8-NH2-ICD属于前期筛选的异紫堇碱衍生物,易溶于水,且化学性质稳定,已有研究[8]表明8-NH2-ICD对人乳腺癌细胞、子宫颈癌细胞等癌细胞均有不同程度抑制作用。本研究选择了具有较强侵袭及转移生长潜能的人OC细胞株HO-8910PM进行研究,结果显示随时间、8-NH2-ICD药物浓度增加,HO-8910PM细胞增殖抑制率增加,在5~20 μg/ml范围内有明显量效、时效关系,至20 μg/ml时8-NH2-ICD对细胞增殖抑制作用基本已达最大值,表明8-NH2-ICD对人OC细胞株HO-8910PM有明显抑制作用,且在5~20 μg/ml范围内呈时间与剂量依赖性,20 μg/ml时抑制作用最大,可将其作为理想治疗剂量。
细胞凋亡是多种细胞调控机体发育、维护内环境稳定、由基因控制的细胞主动死亡过程,本研究中Hoechst 33258染色显示,添加8-NH2-ICD的细胞株细胞核呈现固缩、荧光致密发亮等凋亡形态变化,随8-NH2-ICD浓度增加,凋亡进程加快,染色质凝聚现象及凋亡小体明显增多,细胞膜变形更明显,因此8-NH2-ICD可较好促进HO-8910PM细胞凋亡,这与梁雪霏[9]的研究结论相近。流式细胞检测显示,8-NH2-ICD作用72 h后,与阴性对照组相比,浓度在5~20 μg/ml时对细胞周期作用不明显,浓度为40 μg/ml时S期细胞减少,G0/G1期细胞比例增加, 8-NH2-ICD将HO-8910PM细胞周期阻滞在G0/G1期,这可能是因为该期细胞多处于DNA合成前期,绝大多数细胞处于静止期,从而使细胞不能进入S期及G2/M期进行DNA合成,细胞分裂,导致细胞无法进入下一个合成周期,因此较好地抑制细胞增殖,促进其凋亡。癌细胞的侵袭与转移特性为肿瘤细胞重要的生物学特征[10],本研究表明,处理24、48、72 h时40 μg/ml药物组侵袭至滤镜下表面的细胞数明显减少,且均低于阴性对照组,与闫倩[11]报道的8-NH2-ICD经异紫堇碱结构修饰后抗癌活性提高,可抑制肿瘤细胞生长的结论相符。因此8-NH2-ICD能有效抑制人OC细胞株HO-8910PM的迁移,发挥其抗肿瘤效应[12],鉴于本研究HO-8910PM细胞株数量少,关于其作用机制仍有待深入研究。

图2 培养72 h后流式细胞技术检测结果
A:阴性对照组;B:8-NH2-ICD 5 μg/ml药物组;C:8-NH2-ICD 10 μg/ml药物组;D:8-NH2-ICD 20 μg/ml药物组;E:8-NH2-ICD 40 μg/ml药物组

图3 细胞迁移能力检测结果 ×200
A:阴性对照组;B:8-NH2-ICD 5 μg/ml药物组;C:8-NH2-ICD 10 μg/ml药物组;D:8-NH2-ICD 20 μg/ml药物组;E:8-NH2-ICD 40 μg/ml药物组
本实验研究表明,8-NH2-ICD能通过将人OC细胞株HO-8910PM阻滞于G0/G1期而可较好抑制细胞的增殖、迁移,促进癌细胞凋亡,这为OC的治疗提供了新途径。

