CP-25通过调控T细胞亚群治疗大鼠胶原性关节炎
汤小雨,王 琛,韩 乐,张贤政,疏金玲,蔡小雨,朱 悦,张玲玲,魏 伟
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性、系统性、自身免疫性疾病,其主要病理表现在于关节滑膜炎。RA在全球都有分布,骨和软骨破坏是导致患者工作能力丧失和残疾的主要原因之一[1]。RA的主要病理特征包括滑膜细胞增生、内衬层的增厚、多种炎性细胞浸润,软骨和骨组织的破坏,并最终导致关节畸形和功能丧失。虽然有关细胞因子和其他炎症介质在RA发病中的作用做了大量研究,但RA的发病机制尚不明确[2]。异常活化的T细胞在RA病理机制中起关键作用,同时分化的T细胞亚群在RA中也存在失衡。其中,Th17细胞分泌高水平的IL-17,加速RA的发生发展[3]。胶原诱导性关节炎(collagen induced arthritis, CIA)是一种免疫炎性动物模型,因为该模型有许多组织学和免疫学特征与RA相似,所以是筛选和研究治疗RA的药物的比较理想的动物模型[4]。
芍药苷-6-氧-苯磺酸(paeoniflorin-6'-O-benzenesulfonate, CP-25)是衍生的新型芍药苷活性单体。课题组前期研究[5-6]显示CP-25能够通过调节免疫应答而抑制大鼠佐剂性关节炎、小鼠CIA的继发炎症。艾拉莫德是具有免疫调节活性的环氧化酶-2(cyclooxygenase-2, COX-2)抑制药,临床用于治疗成人活动性RA[7]。艾拉莫德对大鼠CIA有明显的抗炎作用及关节滑膜保护作用,其机制可能与下调致炎因子白细胞介素-1(interleukin-1, IL-1)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平有关[8]。该研究拟在通过建立大鼠CIA模型的基础上,观察CP-25对大鼠CIA的治疗作用以及对活化T细胞亚群和分化T细胞亚群的调节作用。
1 材料与方法
1.1 材料
1.1.1实验动物 40只雄性Wistar大鼠购于上海斯莱克公司,(150±20)g,42 d龄,合格证号:2015000532883。大鼠均在标准实验室条件下饲养。本研究所采用的实验方案均遵循实验室动物伦理准则,且经过安徽医科大学临床药理研究所动物实验伦理审查委员会批准。
1.1.2药物和试剂 异硫氰酸荧光素(fluorescein isothiocyanate, FITC)通道小鼠抗-兔CD3、别藻青蛋白(allocyanin, APC)通道小鼠抗-兔CD4、藻红蛋白(phycoerythrin, PE)通道小鼠抗-兔 CD25、PE小鼠抗-兔 IFN-γ、PE 小鼠抗-兔 IL-4购自美国Becton, Dickinson(BD) 抗体公司;抗-小鼠/兔 IL-17A PE、FITC抗-小鼠/兔转录因子蛋白3(forkhead box protein 3, Foxp3)购自美国eBioscience公司;鸡II型胶原(CII)购自美国康德瑞公司;PBS:KCl 0.2 g,NaCl 8.0 g,Na2HPO4·12H2O 1.82 g和KH2PO40.2 g溶于双蒸水800 ml,将溶液的pH值调节至7.4,高压蒸汽灭菌,储存在4 ℃下以备使用;艾拉莫德(iguratimod):江苏先声药业有限公司国家药品标准H20110084(25 mg,14粒/盒);CP-25:由安徽医科大学临床药理研究所制药部门提供,白色粉末,纯度大于98%。
1.2 主要仪器AA-200DS电子天平购自美国Denver Instrument公司;Bio Tek Elx×808 酶标仪购自美国Bio Tek公司,BX-50型正置显微镜购自日本OLYMPUS公司;FC500流式细胞仪、FACScan仪器购自美国贝克曼库尔特公司;GL20A全自动高速冷冻离心机购自中国湖南仪器仪表总厂离心机厂;JA2003A型电子分析天平购自中国上海精天电子仪器厂;KDC-40超速离心机购自中国安徽科大创新中佳公司;Sim-F140制冰机购自日本SANYO公司;SW-CJ-1F型超净工作台购自江苏苏州苏净集团安泰公司,YLS-7B足趾容积测量仪购自中国山东医学科学院;高压蒸汽灭菌锅购自中国台湾STURDY公司。
1.3 实验方法
1.3.1大 鼠CIA模型的制备 在操作台中,将鸡Ⅱ型胶原溶于 0.05 mol/L的冰醋酸中,并在4 ℃下搅拌至完全溶解,终浓度为 4 mg/ml,置 4 ℃ 冰箱过夜,再将卡介苗(浓度为8 mg/ml)与其等体积混合使之充分乳化以制备鸡II型胶原乳液(所有操作都需要避光并且无菌)。第0天(第1次免疫日)于每只大鼠尾根部、足趾部多点(3~4点)皮内注射 0.2 ml CⅡ乳剂。第7天在尾根部、背部多点皮内注射0.1 ml的该乳剂作为加强[9]。
1.3.2实验分组和给药情况 Wistar系雄性大鼠按体质量随机分为4组:正常组、模型组、CP-25组和艾拉莫德组,每组10只。除正常组外,另外三组大鼠均制备CIA模型。大鼠建立CIA模型,第2次激发诱导后,当大鼠足爪出现红肿即开始给药。CP-25组大鼠每天1次灌胃给予CP-25,剂量为每只大鼠50 mg/kg,艾拉莫德组大鼠每天1次灌胃给予艾拉莫德,剂量为每只大鼠10 mg/kg,两种药均持续给药7周。正常组和模型组大鼠用相同体积生理盐水灌胃。
1.3.3足趾容积测量和关节炎足爪肿胀数评分 大鼠建立CIA模型后,每隔3 d对CIA大鼠进行1次足趾容积测量。炎症出现后,每隔3 d对CIA大鼠进行1次关节炎足爪肿胀数评分。按 0~4五级评分:每只足爪计1个踝关节和5个趾关节,每个关节肿胀为1分,每只鼠累计最多关节肿胀数24分。
1.3.4CIA大鼠脾脏的病理学观察 处死大鼠后,将脾脏无菌剥离并用HE染色。显微镜下观察不同组大鼠的组织病理学变化。根据动脉周围淋巴鞘的细胞密度,淋巴结节(淋巴滤泡)增生,红髓充血和生发中心的数量确定脾脏病理学,具体评分标准如表1所示[10]。
1.3.5CIA大鼠踝关节的病理学观察 先用10%甲醛溶液将大鼠踝关节固定后脱钙脱水,用石蜡包埋,切片,HE染色,光学显微镜下观察不同组大鼠踝关节的组织病理形态,根据滑膜细胞增殖、细胞侵蚀、血管翳形成、炎症和骨侵蚀的状况来确定脾脏病理学,具体评分标准如表2所示[11]。
1.3.6胸腺指数和脾指数的测定 第56天处死大鼠,在无菌环境中取脾脏和胸腺并分别称重。分别用每只大鼠“胸腺或脾脏的质量”比上相应“大鼠的质量”,即得到胸腺指数或脾脏指数。
1.3.7T、B淋巴细胞的分离 处死大鼠后,无菌剥离胸腺和脾脏。先常规制备胸腺细胞悬液和脾脏细胞悬液,再经大鼠淋巴细胞分离液纯化,从胸腺中分离出T淋巴细胞,从脾脏中分离出B淋巴细胞,调节细胞浓度至1×106个/ml。
1.3.8ConA诱导的胸腺T淋巴细胞增殖反应 将1.3.7得到的胸腺T细胞以每孔约1×105个细胞接种于96孔板中。加入含有10%胎牛血清的RPMI-1640,最终体积为200 μl,每个具有3个重复孔。加入ConA后置5%CO2培养箱中于37 ℃孵育48 h,每孔加入10 μl CCK-8溶液,孵育1~4 h,然后取出96孔板,将其置于酶-连接免疫吸附检测器,摇动15 s,然后在450 nm测量吸光度并对结果进行统计学分析。

表1 CIA大鼠脾脏病理的评分标准(n=10)

表2 CIA大鼠踝关节病理的评分标准
1.3.9LPS诱导的脾脏B淋巴细胞增殖反应 将1.3.7得到的脾脏B细胞以每孔约1×105个细胞接种于96孔板中。加入含有10%胎牛血清的RPMI-1640,最终体积为200 μl,每个具有3个重复孔。加入LPS后置在5%CO2培养箱中于37 ℃孵育48 h,每孔加入10 μl CCK-8溶液,孵育1~4 h,然后取出96孔板,将其置于酶-连接免疫吸附检测器,摇动15 s,然后在450 nm测量吸光度并对结果进行统计学分析。
1.3.10流式细胞术检测大鼠外周血T细胞比例及脾脏T细胞亚群的表达 通过尾部血液取样获得大鼠外周血,并用红细胞裂解物分离淋巴细胞。根据说明书中推荐的浓度比,将CD3(FITC通道)、CD4(APC通道)和CD25(PE通道)的抗体组合分别添加到圆底管中。在室温下避光孵育后,洗涤细胞并通过流式细胞术分析。用FACScan仪器和相关的CellQuest软件分析细胞相关的荧光。第56天处死大鼠取脾脏,用红细胞裂解液分离脾脏淋巴细胞,然后将淋巴细胞悬浮液转移到圆底管中。将CD4(APC通道)、IL-17A(PE通道)、IFN-γ(PE通道)、IL-4(PE通道)的抗体组合按照说明书建议的浓度比例分别添加到圆底管中。① 细胞需要提前加4 μl细胞刺激剂,于5%CO2、37 ℃培养箱孵育6~8 h;② 6~8 h后取出细胞转移至微量离心管(EP管)中离心(2 500 r/min,10 min)后,弃上清液,用PBS洗涤1次,再离心;③ 在避光室温下添加表面抗体CD4(APC通道)孵育20 min;④ 每孔添加80 μl固定剂,振荡,在室温下避光孵育10 min,摇晃;⑤ 洗涤通过离心,每孔添加80 μl打孔剂,在室温下避光孵育8 min;加胞内抗体IL-17A(PE通道)避光孵育20 min(不可振荡)。在室温黑暗中孵育后,洗涤细胞并通过流式细胞术分析。Th1细胞、Th2细胞的检测同上。
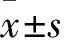
2 结果
2.1 CIA大鼠的肿胀情况及药物的影响第1次造模作为第0天,7 d后加强给药,第12天大鼠足爪出现红肿,首先是原发侧红肿,以后延伸到继发侧、尾部、耳部。从第12天给予CP-25、艾拉莫德治疗。同时开始每周进行两次足趾容积测量、足爪肿胀数计数。肉眼观察显示,第21~31天为肿胀高峰期,第38天后肿胀逐渐减轻。CP-25、艾拉莫德明显降低CIA大鼠足爪肿胀(图1A)。与正常组比较,CIA模型组足趾容积、足爪肿胀数评分明显升高 (P<0.05)。与模型组比较,CP-25、艾拉莫德能够减轻大鼠CIA的足趾容积、足爪肿胀数(P<0.05)。模型组、CP-25组、艾拉莫德组足趾容积、足爪肿胀数评分在第21~31天达到高峰值随后逐渐下降(P<0.05)。其中CP-25组大鼠CIA的足爪肿胀数从第32天逐渐下降。艾拉莫德组大鼠足爪肿胀数从第30天逐渐下降(图 1B、1C)。
2.2 CIA大鼠脾脏病理变化情况及CP-25的影响将脾脏病理从以下四个方面进行分析:生发中心,淋巴鞘,淋巴滤泡,红髓。数据统计结果见表3。结果发现,与正常组比较,光镜下CIA模型组大鼠脾脏白髓淋巴组织明显增生,淋巴鞘细胞密度增加,生发中心出现(P<0.05);与模型组比较,CP-25组白髓淋巴组织增生明显减轻,生发中心和淋巴滤泡增生明显减轻,淋巴鞘细胞密度增加也显著减弱(P<0.05)(图2)。
2.3 CIA大鼠踝关节病理学的检查通过以下四个方面对足关节病理进行分析:滑膜细胞增生,细胞侵蚀,血管翳,炎症,骨侵蚀。数据统计分析结果见表4。结果发现,与正常组比较,光镜下可见CIA模型组大鼠的滑膜组织中滑膜细胞增生明显,层次增多,排列紊乱,滑膜下层纤维组织增生,炎性细胞浸润及血管翳形成,软骨中炎性细胞浸润,软骨组织破坏(P<0.05);与模型组比较,CP-25组和艾拉莫德组不同程度改善以上病理变化,滑膜细胞层未见明显增多,炎性细胞浸润减少;明显改善滑膜下层炎性细胞浸润和滑膜血管充血(P<0.05)(图3)。
2.4 CP-25降低CIA大鼠胸腺指数、脾脏指数及抑制T、B淋巴细胞增殖反应4组大鼠胸腺指数的测量结果见表5。与正常组比较,CIA模型组大鼠的胸腺指数明显升高(P<0.05)。与CIA模型组比较,CP-25组、艾拉莫德组明显降低胸腺指数和脾脏指数(P<0.05)(图 4A)。统计四组大鼠胸腺增殖指数和脾脏增殖指数的结果,见表6。与正常组比较,CIA模型组大鼠的T、B淋巴细胞增殖能力明显增加(P<0.05)。与CIA模型组比较,CP-25组、艾拉莫德组CIA大鼠的T、B淋巴细胞的增殖明显被抑制(P<0.05)(图 4B)。

图1 CP-25对CIA大鼠足爪肿胀的影响及对足趾容积、足爪肿胀数的影响
A:CP-25对CIA大鼠足爪肿胀的影响;a:正常组;b:模型组;c:CP-25组;d:艾拉莫德组;B:CP-25对CIA大鼠足趾容积的影响;C:CP-25对大鼠足爪肿胀数的影响;与正常组比较:#P<0.05,##P<0.01;CP-25组与模型组比较:*P<0.05,**P<0.01;艾拉莫德组与模型组比较:▽P<0.05,▽▽P<0.01

图2 CP-25对大鼠脾脏病理变化的影响
A:各组大鼠脾脏的病理图×10;a:正常组:↑显示红髓,↓显示白髓;b:模型组:→出现生发中心,←显示淋巴滤泡增生;c:CP-25组;d:艾拉莫德组;B:CP-25对CIA大鼠脾脏病理的影响的统计分析;与正常组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01

图3 CP-25对大鼠踝关节病理变化的影响
A:各组大鼠踝关节的病理图×10;a:正常组:↓呈单层滑膜;b:模型组:↓显示炎性细胞浸润,←显示血管翳,→显示软骨破坏;c:CP-25组;d:艾拉莫德组;B:CP-25对CIA大鼠踝关节病理的影响的统计分析;与正常组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01

表3 CP-25对CIA大鼠脾脏病理的影响

表4 CP-25对CIA大鼠踝关节病理的影响

表5 CP-25对CIA大鼠胸腺、脾脏指数的影响

表6 CP-25对CIA大鼠胸腺、脾脏增殖指数的影响

表7 CP-25对CIA大鼠外周血各细胞亚群变化的影响

图4 CP-25对大鼠胸腺、脾脏指数及T、B细胞增殖指数的影响
A: CP-25对大鼠胸腺、脾脏指数的影响;B:CP-25对大鼠胸腺T细胞、脾脏B细胞增殖指数的影响;与模型组比较:*P<0.05,**P<0.01;与正常组相比:#P<0.05,##P<0.01

图5 CP-25对CIA大鼠外周血各T细胞所占比例的影响及统计分析
A:CP-25对CIA大鼠外周血各细胞所占比例的影响的流式图;B:CP-25对CIA大鼠外周血各细胞所占比例的统计分析;与正常组比较:##P<0.01;与模型组比较:**P<0.01
2.5 CIA大鼠外周血活化T细胞亚群变化及CP-25对其影响将细胞流式术分析测得的CIA大鼠外周血中各细胞百分比的结果进行统计,见表7。与正常组比较, CIA模型组中大鼠外周血CD3+T细胞、CD3+CD4+T细胞、CD3+CD4+CD25+T细胞所占比例显著升高(P<0.05);与模型组比较,CP-25组中CD3+T细胞、CD3+CD4+T细胞、CD3+CD4+CD25+T细胞的比例明显降低(P<0.05)(图 5)。
2.6 CIA大鼠脾脏分化T细胞亚群变化及CP-25对其影响通过统计流式细胞术检测各组大鼠脾脏分化T细胞亚群脾脏CD4+IFN-γ+Th1细胞,CD4+IL-4+Th2细胞,CD4+IL-17A+Th17细胞的百分比,见表8。结果发现,与正常组比较,CIA模型组中大鼠脾脏中CD4+IFN-γ+Th1、CD4+IL-4+Th2的比例显著升高,CD4+IL-17A+Th17细胞的比例显著升高,P<0.05;与模型组比较,CP-25显著降低大鼠脾脏中CD4+IFN-γ+Th1细胞,CD4+IL-4+Th2细胞的表达比例,明显减少大鼠脾脏中CD4+IL-17A+Th17细胞的百分含量(P<0.05)(图6)。

表8 CP-25对CIA大鼠脾脏各细胞亚群变化的影响

图6 CP-25对CIA大鼠脾脏Th1、Th2、Th7细胞亚群变化的影响及统计分析
A:CP-25对CIA大鼠脾脏中各细胞在脾脏中百分含量的影响的流式图;B:CP-25对CIA大鼠脾脏中CD4+IFN-γ+Th1、CD4+IL-4+Th2、CD4+IL-17A+Th17细胞在脾脏中百分含量的影响的统计分析;与正常组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01
3 讨论
芍药是一种中药,具有抗炎、解痉和止痛作用。白芍(total glucosides of paeony, TGP)是从芍药的根部中提取,并批准了1998年芍药苷(Paeoniflorin, Pae)治疗RA。Pae是TGP的有效天然活性成分。TGP和Pae具有抗炎和免疫调节作用[12]。为了提高Pae的生物利用度,本实验室通过对Pae的化学结构进行修饰获得了CP-25[3]。
CIA模型的临床表现为多发性外周关节炎,病理变化主要是增殖性滑膜炎、关节软骨的破坏、骨侵蚀、在关节腔内有明显炎性细胞浸润等;有高浓度 IgG抗体自体II型胶原存在于动物体内[13]。由于其病理过程及实验室指标与RA相似,是筛选和研究治疗RA药物的较理想模型[14]。本研究中,肉眼观察到CP-25能够减轻CIA大鼠的肿胀情况,降低CIA大鼠的足趾容积、减少CIA大鼠的足爪肿胀数。光镜下观察到CP-25可以明显改善CIA大鼠脾脏病理情况,减轻白髓淋巴组织增生,减少生发中心个数和缓解滤泡增生,淋巴鞘细胞密度的增加也被显著减弱;CP-25可以不同程度改善CIA大鼠踝关节病理情况,CP-25组大鼠滑膜细胞层正常,细胞浸润减少,滑膜下层炎性细胞浸润和滑膜血管充血被明显改善。该研究结果提示CP-25对大鼠CIA继发炎症具有明显抗炎作用。
RA是一种自身免疫性疾病,T和B淋巴细胞的参与该病的发生和发展。效应T细胞可以分为Th1细胞(CD4+IFN-γ+)、Th2细胞(CD4+IL-4+)和Th17细胞(CD4+,IL-17A+)。其中,Th1细胞主要产生IFN-γ和IL-2,并在细胞免疫介导的炎症反应中起促进作用;Th2细胞主要生产IL-4、IL-5和IL-13,它可以促进B淋巴细胞的增殖和分化,并促进抗体产生和体液免疫;Th17细胞分泌的IL-17能够促进破骨细胞活化及基质金属蛋白酶的合成,诱导关节软骨降解[15]。因此T、B淋巴细胞间相互作用在RA的发病机制中有着非常重要的意义。本研究结果显示CP-25可以抑制CIA大鼠体内T、B淋巴细胞增殖反应,提示CP-25对CIA大鼠的治疗作用与T、B淋巴细胞有一定关系。CP-25可以降低CD4+IL-17A+Th17细胞的表达;CP-25可以降低CD4+IFN-γ+Th1细胞、CD4+IL-4+Th2细胞的表达。因此,CP-25可能通过影响效应T细胞(CD4+T细胞)之间的平衡来调控大鼠CIA的异常免疫应答和炎症反应。
综上所述,CP-25对大鼠CIA有明显治疗作用,可以有效缓解CIA大鼠的足趾容积增加、肿胀数增加,改善脾脏、踝关节病理变化,在CIA的发病过程中,CP-25具有良好的抗炎免疫软调节活性,可能通过多种途径调节CIA大鼠体内异常的免疫反应,这一研究提示CP-25在临床治疗RA有潜在前景。

