新造地马铃薯根际固氮解磷微生物的分离与鉴定
王惟帅,杨世琦,杨正礼
(1中国农业科学院 农业环境与可持续发展研究所,北京 100081;2 农业部 农业环境与气候变化重点开放实验室,北京 100081)
延安属黄河中游丘陵沟壑区,土壤母质疏松,植被覆盖率低,由于长期的不合理开发利用,导致土质退化、水土流失等问题[1]。自退耕还林、还草措施实施以来,该区域植被覆盖面积明显提高,然而,退耕过度又导致退耕规模超过了人均耕地需求下限,出现了人口与耕地不平衡的局面[2]。为缓解这一矛盾,延安政府大力开展治沟造地,但在使用机械化里切外垫等方法使新造地面积增长的同时,又致使熟土被压、土壤结构遭到破坏;并且研究发现,新造地农田土壤氮和磷含量、土壤酶活性、微生物丰度等均较低[3-4]。
氮、磷作为植物生长必需的营养元素,对作物生长具有重要作用,但一般农田土壤中氮、磷的有效供应量很少,通常通过施肥来满足作物生长的需要。然而研究表明,化肥施用量的增加会导致化肥利用率降低;同时,化肥会污染空气、土壤及水体,破坏土壤结构和微生物多样性,还会降低农产品品质等[5]。因此,利用土著微生物进行固氮解磷,不仅在为作物提供营养物质的同时减少了化肥施用量,而且还可以提高作物产量,改善作物品质,调节作物生长,改良土壤环境等[6-10]。
马铃薯是延安地区主要的粮食作物之一,能够适应新造地土壤类型,随着种植面积的不断扩大,其已成为该地区农业经济发展的重要推动力,在提升粮食产量和增加农民收入方面起到积极作用[11]。因此,本研究从新造地马铃薯根际土壤中分离固氮解磷微生物,并从中筛选固氮解磷特性较好的有益功能菌株,以期为延安新造地马铃薯微生物菌肥的研制提供依据。
1 材料与方法
1.1 供试材料
1.1.1 土壤样品来源与处理 土壤样品采自延安市安塞区南沟村(109°12′12″-109°22′12″ E,36°41′24″-36°46′12″ N),海拔1 219 m,年降水量500~550 mm;土壤以黄绵土为主,质地为粉沙,抗侵蚀能力差。采用蛇型采样法,选15个采样点,每个采样点取马铃薯根际土壤样品500 g,混匀后,采用四分法留取约1 000 g土样,将土样保留于自封袋中并运回实验室以分离固氮解磷菌。
1.1.2 培养基 (1)Ashby无氮培养基。甘露醇10 g,KH2PO40.2 g,MgSO40.2 g,NaCl 0.2 g,K2SO40.3 g,CaCO35 g,琼脂18 g,蒸馏水1 000 mL,pH 7.0~7.5,121 ℃ 灭菌30 min。
(2)无机磷培养基。NaCl 0.3 g,MgSO4·7H2O 0.3 g,KCl 0.3 g,(NH4)2SO40.5 g,FeSO4·7H2O 0.003 g,MnSO4·4H2O 0.003 g,Ca3(PO4)25.0 g,葡萄糖10 g,琼脂18 g,蒸馏水1 000 mL,pH 7.0~7.5,121 ℃ 灭菌30 min;
(3)LB培养基。蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.0~7.2,121 ℃灭菌30 min。
1.2 固氮解磷菌的分离与纯化
称取10 g新鲜土壤样品,置于250 mL三角瓶中,加入90 mL蒸馏水,30 ℃、150 r/min振荡40 min,静置后得到悬浮液。采用稀释法[12]将该悬浮液稀释至不同浓度,取0.1 mL稀释液均匀涂布在Ashby无氮培养基上,于30 ℃恒温培养箱中倒置培养24 h,选择不同类型的单个菌落,经平板多次纯化,纯化后的菌落接种于无机磷培养基中,通过溶菌圈法[13]筛选固氮解磷菌,纯化得到的菌株保存于4 ℃冰箱中备用。
1.3 固氮解磷菌的形态观察与鉴定
1.3.1 形态学特征 将筛选出来的菌株划线接种至LB平板上,30 ℃培养24 h,观察其在平板上的菌落生长状况、颜色、透明度、湿润度、光滑度等[12]。
1.3.2 16S rDNA序列分析 利用SDS-CTAB法[14]提取各菌株基因组总DNA,采用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGAC-
TT-3′)进行16S rDNA的PCR扩增,扩增片段长度为1.5 kb。PCR反应体系为25 μL:10×PCR Buffer 2.5 μL,dNTPs (10 mmol/L) 0.5 μL,上、下游引物(50 μmol/L)各0.5 μL,模板DNA(40 ng/μL) 0.5 μL,TaqDNA聚合酶(3 U/μL) 0.5 μL,无菌ddH2O 20 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸10 min,共30个循环。PCR产物经0.7%琼脂糖凝胶电泳后回收纯化,送北京君诺德生物技术有限公司测序。将获得的16S rDNA序列在NCBI数据库中进行比对,BLAST搜索同源序列,采用MEGA 5.0软件,以Neighbor-joining法[14]建立固氮解磷菌16S rDNA系统发育树。
1.4 固氮解磷菌固氮解磷能力的测定
1.4.1 固氮能力测定 采用乙炔还原法[12]测定固氮解磷菌的固氮能力。挑取LB斜面培养基上的单菌落接种到Ashby无氮培养基上,28 ℃活化;选择长势良好的菌株,挑取菌落大小相近的单菌落接种于装有6 mL Ashby液体培养基的西林瓶中,西林瓶体积为10 mL,压盖密封,30 ℃、150 r/min培养24 h。在无菌条件下将体积分数10%的空气抽出,注入体积分数10%的高纯乙炔。30 ℃、150 r/min培养48 h,用气相色谱仪测定乙烯的生成量。按以下公式计算其固氮酶活性:
ARA=(Vst×Cst×Asa×Vtu)/(Vsa×Ast×H×22.4)。
式中:ARA为固氮酶活性,nmol/h;Vst为标准乙烯进样体积,mL;Cst为标准乙烯浓度,nmol/mL;Asa为乙烯峰面积,cm2;Vtu为西林瓶体积,mL;Vsa表示样品进样体积,mL;Ast表示标准乙烯峰面积,cm2;H表示培养时间,h。
1.4.2 解磷能力测定 (1)将分离纯化得到的固氮解磷菌接转到无机磷固体培养基上,28 ℃恒温培养箱中培养4 d,用游标卡尺测量菌落直径(d)和透明圈直径(D),用D/d值表征其溶磷能力,值越大表示溶磷能力越强[13]。(2)将供试菌株接种于已灭过菌的装有30 mL无机磷液体培养基的三角瓶中,30 ℃、150 r/min振荡培养,分别于培养1,3,5,7 d时取样,将样液4 ℃、10 000 r/min离心10 min,取上清液采用钼蓝比色法[9]测定有效磷含量。设不接种菌株为空白对照(CK)。
1.5 数据处理与分析
利用Excel 2010 软件进行数据整理和制图,采用SPSS 16.0统计软件对数据进行方差分析和差异显著性检验,采用MEGA 5.0软件建立固氮解磷菌16S rDNA的系统发育树。
2 结果与分析
2.1 固氮解磷菌的分离及其形态学特征
通过土壤悬浮液富集培养并进行梯度稀释培养纯化后,观察菌落形态的差异,从土样中共分离出具有固氮活性的菌株37株,将这37株菌株分别接种到无机磷培养基中培养,通过溶菌圈确定具有解磷功能的菌株,进一步利用固氮解磷交叉试验最终筛选得到9株菌株,其皆具有固氮解磷功能,且菌株生长良好,各菌株的菌落形态及生长状况如表1和图1所示。

表1 从马铃薯根际分离的9株固氮解磷菌的生长状况和菌落形态Table 1 Growth and colonial morphology of 9 nitrogen fixing and phosphate solubilizing bacteria isolated from potato rhizosphere
注:“++++”代表长势旺盛(菌落浓、厚、密),“+++”代表长势良好(满足菌落浓、厚、密中的两条)。
Notes:“++++” means growing vigorously(Dense,thick and numerous colony),“+++” means growing well(Meeting the above two).

图1 从马铃薯根际分离的9株固氮解磷菌的菌落形态Fig.1 Colonial morphology of 9 nitrogen fixing and phosphate solubilizing bacteria isolated from potato rhizosphere
2.2 固氮解磷菌的16S rDNA序列同源性分析
将9株固氮解磷菌的16S rDNA 基因测序后输入NCBI数据库进行BLAST比对,结果(表2)显示,9株菌分属于不同的菌属,其中与N31基因相似性最高的菌株为假单胞菌PseudomonasaeruginosaGBAP5(100%),菌株N33与克雷伯氏菌KlebsiellapneumoniaeCRKP-1215的基因相似性最高(100%),N34与红球菌RhodococcuserythropolisHX-2(100%)相似性最高,N46与节杆菌PaenarthrobacternitroguajacolicusBF-R19相似性最高(100%),P33与芽孢杆菌BacillussafensisXQ56的基因相似度最高(100%); P34与贪噬菌Variovoraxsp.553相似度最高(99%),P52与肠杆菌KosakoniacowaniiP4菌株的基因相似度最高(99%),OP1与副球菌Paracoccussp. ENF1相似度最高(99%),OP8与芽孢杆菌BacillusaryabhattaiFORT25相似度最高(99%)。
采用邻接法构建9株固氮解磷菌及其最高相似性菌株16S rDNA基因序列的系统进化发育树,结果(图2)显示,9株固氮解磷菌与其16S rDNA基因序列最高相似性菌株位于同一分支,说明它们具有高度的同源性。
综上所述,本试验从延安新造地马铃薯根际土壤分离得到9株具有固氮解磷功效的菌株,分别归属于假单胞杆菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)、红球菌属(Rhodococcus)、节杆菌属(Paenarthrobacter)、芽孢杆菌属(Bacillus)、贪噬菌属(Variovorax)、肠杆菌属(Kosakonia)和副球菌属(Paracoccus),其中菌株P33和OP8均属于芽孢杆菌属。

表2 从马铃薯根际分离的9株固氮解磷菌的鉴定结果Table 2 Identification of 9 nitrogen fixing and phosphate solubilizing bacteria isolated from potato rhizosphere
2.3 固氮解磷菌的固氮酶活性
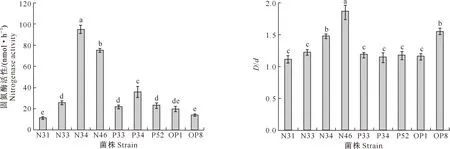
图3显示,通过筛选得到的9株菌均具有固氮功能,固氮酶活性为11.88~95.08 nmol/h,且各菌株的固氮酶活性存在差异,其中菌株N34的固氮酶活性最高,达到95.08 nmol/h,是菌株N31的8倍;N46的固氮酶活性次之,为75.58 nmol/h,且菌株N34和N46的固氮酶活性与其他菌株差异显著;菌株N31与OP8的固氮酶活性相当,N33、P33、P52和OP1 之间的固氮能力均没有显著差异。
2.4 固氮解磷菌的溶磷特性
图4表明,9株菌在无机磷培养基中培养4 d后,其D/d(透明圈直径/菌落直径)值为1.12~1.87,其中菌株N46的D/d值最大,且与其他菌株的溶磷能力差异显著;N34与OP8的溶磷能力相当,其余各菌株间的溶磷能力均无显著差异。这说明9株固氮解磷菌均具有溶解不溶性磷的能力,且菌株之间存在差异。
图柱上标不同小写字母表示差异显著(P<0.05)。下同Different lowercase letters indicate significant difference (P<0.05).The same below
图3 从马铃薯根际分离的9株固氮解磷菌的固氮酶活性
Fig.3 Nitrogenase activity of 9 nitrogen fixing and phosphate solubilizing bacteria isolated from potato rhizosphere
“D/d”表示“透明圈直径/菌落直径”“D/d” means “transparent circle diameter/colony diameter”
图4 从马铃薯根际分离的9株固氮解磷菌的溶磷能力
Fig.4 Phosphate solubilizing ability of 9 nitrogen fixing and phosphate solubilizing bacteria isolated from potato rhizosphere
采用钼蓝比色法[9]对9株菌的溶磷能力进行定量测定,结果(图5)表明,9株菌7 d内的溶磷量呈持续上升趋势,其中菌株N46的溶磷能力最好,7 d的累积有效磷含量达到54.9 mg/L,与其他菌种差异显著;菌株N34与OP8的溶磷能力相当,累积有效磷含量达到48 mg/L;N33、P33和OP1的溶磷能力基本一致,累积有效磷含量超过37 mg/L;与其他菌种相比,菌株N31和P34的溶磷能力较差。
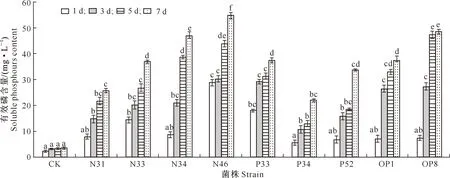
图5 从马铃薯根际分离的9株固氮解磷菌的有效磷含量Fig.5 Phosphorus solubilization capacity of 9 nitrogen fixing and phosphate solubilizing bacteria isolated from potato rhizosphere
3 讨 论
已有研究发现,从小麦、玉米、马铃薯等作物根际分离的固氮菌中,芽孢杆菌属、节杆菌属和假单胞杆菌属为农作物和经济作物根际常见的功能菌[15-18]。牛艳芳等[19]在白桦根际土壤中分离得到固氮菌的不同类群,并通过解磷试验发现假单胞杆菌属和节杆菌属的微生物具备解磷特性。李琼洁等[20]从玉米根际分离得到一株具有较高固氮活性的菌株,该菌株还具有较好的泌铵能力,经鉴定,该菌株属于肠杆菌属。张磊[21]从马铃薯根际分离得到固氮菌,经鉴定为节杆菌属、假单胞菌属等优势种群,且具有良好的解磷功能。姜瑛等[12]从灰潮土中分离得到一株固氮菌,经固氮解磷试验发现,该菌株具有较强的固氮解磷功能,且可以促进花生对营养元素的吸收,经鉴定该菌株属于贪噬菌属。门惠芹等[22]从枸杞根际分离纯化得到固氮菌,且通过试验验证接种该菌株可以促进植株的生长,鉴定发现该菌株为红球菌属。本研究从延安新造地马铃薯根际土壤中分离得到9株固氮解磷菌,经16S rDNA系统发育分析,初步鉴定其属于假单胞杆菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)、红球菌属(Rhodococcus)、节杆菌属(Paenarthrobacter)、芽孢杆菌属(Bacillus)、贪噬菌属(Variovorax)、肠杆菌属(Kosakonia)和副球菌属(Paracoccus)。
固氮解磷菌在土壤中会直接或间接影响土壤肥力和地上作物的生长,在丰富土壤微生物多样性的同时,对土壤修复和作物生长起到积极的促进作用。此外,固氮解磷菌固定的氮素除供自身生长发育外,部分以无机状态或简单的有机氮化物分泌到体外;同时,固氮解磷微生物通过分泌有机酸、质子和多糖等溶解不溶性磷,以供植物吸收利用,从而减少化肥的使用量,功能菌的这种特性使其在生产应用中具有重要意义[23]。
在自然状态下,马铃薯根际也会存在固氮解磷菌,但与庞大的根际微生物系统相比,固氮解磷菌的种群数量相对较少,固氮量也很小;同时,新造地土壤微生物数量少,生物活性低,土壤肥力和土壤结构稳定性较差,对这类土壤进行修复的最佳方式就是施用菌剂,输入活性微生物。研究表明,将高效功能菌剂应用于生荒地后,土壤生物活性得以显著改善,对于修复生荒地土壤生态具有重要意义[24-26]。本研究中分离筛选的固氮解磷微生物,种类丰富,打破了传统菌肥菌种单一的现状,9株菌种除具有固氮活性外,还具有溶磷功能,对于开发专用固氮解磷菌肥具有重大意义。通过此种方式筛选出的菌种,与特定作物根系互作性好,对当地土壤环境的适应性也更强,将分离出的固氮解磷微生物以回接的方式施于土壤中,可以达到增产和改善土壤环境的效果。
4 结 论
本研究从延安新造地马铃薯根际土壤中分离纯化得到9株固氮解磷菌,均具有固氮和解磷功能,其中固氮能力最好的菌株为N34,固氮酶活性为95.08 nmol/h;解磷能力最好的菌株为N46,7 d累计溶磷量达到54.9 mg/L。
——固氮微生物

