舒伯特气单胞菌实时荧光定量PCR检测方法的建立及应用
刘礼辉,胡 蕾,2,杨圆圆,方 伟,林 强,付小哲,梁红茹,赵永亮,4,李宁求
(1 中国水产科学研究院 珠江水产研究所,农业部渔用药物创制重点实验室,广东省水产动物免疫技术重点实验室,广东 广州 510380;2 上海海洋大学 水产与生命学院,上海 201306;3 广东省水生动物疫病预防控制中心,广东 广州 510222;4 华中农业大学 水产学院, 湖北 武汉 430070)
舒伯特气单胞菌(Aeromanasschubertii)属气单胞菌科 (Aeromonadaceae)、气单胞菌属(Aeromanas),为革兰氏阴性杆菌。该菌广泛存在于淡水、海水、土壤、鱼类和脊椎动物肠道中,可导致伤口感染、神经性肌膜炎,是急性腹泻的重要致病菌,严重的还会引起败血症,危及生命。1988年, Hickman-Brenner等[1]在美国德克萨斯州首次发现人感染舒伯特气单胞菌。随后在欧洲[2-3]、中国[4-5]也发现了由舒伯特气单胞菌引起的食源性疾病的病例。而舒伯特气单胞菌作为条件致病菌,在水产养殖中较常见。2012 年,国内学者先后报道了舒伯特气单胞菌引起的鳢科鱼类内脏类结节病,其发病时间较短,对鳢科鱼类具有较高的致病力和致死率[6-8],但目前对其病原分布、影响因素、流行规律等各方面的研究仍不深入和系统,因此建立灵敏高效的病原定量检测技术,对该病的早期诊断和防控具有重要意义。
目前,针对舒伯特气单胞菌的快速检测方法较少见,仅刘春等[9]根据该菌的促旋酶B 亚单位基因(gyrB)、溶血素基因(hlyA)的保守序列设计引物,建立了双重PCR检测方法,但该方法仅适用于鳢源舒伯特气单胞菌,且只能进行定性检测,而无法定量。Nagar等[10]研究表明,应用rpoD基因(RNA polymerase sigma-70 factor)分析能有效区分和鉴别气单胞菌属的种类。因此,本研究以舒伯特气单胞菌rpoD基因为靶基因,建立基于TaqMan探针的舒伯特气单胞菌荧光定量PCR检测方法,并采用该方法对50份临床样品进行对比检测,旨在为舒伯特气单胞菌的早期预警、诊断及防控提供技术支撑。
1 材料与方法
1.1 菌株及临床样品
鳢源致病性舒伯特气单胞菌(Aeromonasschubertii)分离株 WL1483、舒伯特气单胞菌标准株(A.schubertiiATCC43700)、 嗜水气单胞菌标准株(A.hydrophilaATCC49140和ATCC7970)、温和气单胞菌标准株(A.sobriaATCC43979)、维氏气单胞菌标准株(A.veroniiATCC35624)、简氏气单胞菌(A.jandaeiATCC49568)、鮰爱德华菌标准株(EdwardsiellaictaluriATCC33202)、杀鲑气单胞菌杀鲑亚种标准株(A.salmonicidasubsp.salmonicidaATCC33658)、诺卡氏菌(NocardiaseriolaeJZ-1)、迟缓爱德华菌标准株(E.tardaATCC15947)、副溶血弧菌标准株(VibrioparahaemolyticusATCC33846)、海豚链球菌标准株(StreptococcusiniaeATCC 29177)、恶臭假单胞菌(PseudomonasputidaATCC 25571)、荧光假单胞菌(PseudomonasfluorescensBD-1)、柱状黄杆菌(FlavobacteriumcolumnareGHS061212)和类志贺邻单胞菌(PlesiomonasshigelloidesHP-1)共16株菌,均由珠江水产研究所鱼病室保存。
临床样品来源于广东各地鳢、加州鲈养殖场,包括体表有出血点、内脏类结节等临床症状的发病鱼和正常鱼样品共30份,养殖水样品20份。
1.2 引物与TaqMan探针的设计
从GenBank 数据库中获取气单胞菌属主要种代表性菌株的rpoD基因序列, 采用Vector NTI Suite 9.0软件对其进行同源性分析。针对舒伯特气单胞菌rpoD基因特异性序列, 采用Premier 5.0生物学软件设计特异引物和探针,上、下游引物序列分别为:rpoD-F.5′-AACATGCGCGAGATGATGGA-3′;rpoD-R.5′-CGCACTCGTTGTTGGTGAAG-3′;探针序列为:rpoD-P:5′-(FAM,荧光基团)-GCTCGACACACATCTTCAGG-(Eclipse,淬灭基团)-3′。将此引物和探针进行BLAST同源性比较, 确保其对舒伯特气单胞菌具有高度特异性。探针和引物委托上海生工生物工程技术服务有限公司合成。
1.3 各菌株基因组DNA的实时荧光定量PCR及特异性检测
以1.1节中各菌株基因组DNA为模板,进行实时荧光定量PCR扩增,通过观察扩增曲线判断其特异性,以双蒸水为空白对照。参照Premix Ex TaqTM说明书,将上、下游引物及探针、Premix Ex TaqTM、ROX Reference Dye Ⅱ、模板加入到反应体系中,于 ABI QuantStudio 6 Flex 荧光定量PCR仪上进行荧光定量PCR扩增。荧光定量PCR反应体系为20 μL:2×Mix 10 μL,上游引物(10 μmol/L) 0.4 μL,下游引物(10 μmol/L)0.4 μL,荧光探针(5 μmol/L) 0.4 μL,Dye Ⅱ 0.4 μL,DNA 模板2 μL,去离子水6.4 μL。反应程序为:95 ℃预变性10 s;95 ℃ 5 s,60 ℃ 34 s(收集FAM荧光信号),扩增40个循环,反应耗时54 min。
1.4 阳性重组质粒的制备与检测标准曲线的建立
以舒伯特气单胞菌标准菌株ATCC43700 的DNA为模板,用rpoD基因特异性引物扩增rpoD基因保守序列,获得片段长度为392 bp的PCR产物。将含有目的扩增片段的PCR产物切胶回收、纯化,连接到PMD18-T(Takara)质粒载体中制备重组质粒标准品,经测序分析验证。用核酸测定仪(D-Drop-1000)测定标准品的浓度,根据阿伏伽德罗常数换算出1 μL标准品中的拷贝数。用双蒸水对标准品进行10×倍比稀释,采用优化好的体系进行荧光定量PCR反应(每个稀释度3个重复),建立质粒拷贝数与循环阈值(Ct)对应关系的标准曲线。
1.5 舒伯特气单胞菌荧光定量PCR的灵敏度检测
1.5.1 含rpoD基因质粒的最低检出限 提取含有目的片段的质粒DNA(4.76×108拷贝/μL),10倍等比稀释为4.76×106,4.76×105,4.76×104,4.76×103,4.76×102,4.76×101,4.76×100,4.76×10-1拷贝/μL,以无菌水为空白对照,并用相应引物与探针进行荧光定量PCR扩增,确定该方法对靶基因的最低检出限。
1.5.2 纯培养物的最低检出限 利用平板计数法,对舒伯特气单胞菌ATCC43700进行计数,调节菌液密度达到1.5×108CFU/mL,再按10倍梯度稀释。取1 mL各密度菌液,用细菌基因组提取试剂盒提取DNA作为检测模板(终体积50 μL),以无菌水为模板作空白对照,用1.3节中荧光定量PCR检测方法,确定对舒伯特气单胞菌纯培养物的最低检出限。
1.6 舒伯特气单胞菌荧光定量PCR的重复性检测
取舒伯特气单胞菌rpoD基因质粒DNA进行荧光定量PCR,在同一次试验中重复30次,观察其Ct值变异系数。同时观察在30个不同试验中此样品的Ct值变异系数,确定该方法的重复性。
1.7 临床样品的检测
对50份临床样品(鱼样品各取0.1 g肝脏组织,养殖水样品各取1 mL混匀的养殖水)提取总DNA,进行荧光定量PCR检测;同时无菌操作取0.1 g鱼肝脏组织匀浆液或100 μL水样(10倍浓缩),在脑心浸液琼脂培养基(brian heart infusion,BHI)中进行传统细菌分离培养,分别挑选单菌落纯化培养后提取DNA,进行常规PCR检测。对荧光定量PCR检测结果呈阳性、而传统细菌分离培养检测结果呈阴性的临床样品进行复检,方法如下:取0.1 g组织匀浆或1 mL水样(10倍浓缩)置于碱性蛋白胨水中增菌6 h后,再进行分离纯化培养,对经常规PCR检测、生化鉴定(biologⅢ细菌鉴定仪)以及荧光定量PCR检测同时认定为舒伯特气单胞菌者,判定为阳性。
2 结果与分析
2.1 舒伯特气单胞菌荧光定量PCR的特异性
荧光定量PCR特异性检测结果显示,舒伯特气单胞菌菌株ATCC43700、WL1483均可检测到“S”型荧光扩增曲线,结果为阳性;而嗜水气单胞菌、维氏气单胞菌、温和气单胞菌、诺卡氏菌等其他14株非舒伯特气单胞菌样品和空白对照品均无荧光扩增曲线,Ct值无法读取,结果均为阴性。表明以rpoD为靶基因设计的荧光定量 PCR 检测方法可特异性检测舒伯特气单胞菌(图1)。
2.2 舒伯特气单胞菌荧光定量PCR标准曲线的建立
用舒伯特气单胞菌rpoD基因的阳性重组质粒进行荧光定量PCR扩增,以不同浓度的质粒拷贝数为横坐标,相对应的循环阈值Ct为纵坐标,获得标准曲线,该曲线的斜率为-3.456,截距为38.089(图2)。得出质粒拷贝数(X)与Ct值之间的线性方程为:Ct=-3.456 lgX+38.089。标准曲线在4.76×102~4.76×108拷贝/μL时有良好的线性关系,相关系数为1.000,扩增效率为94.705%。
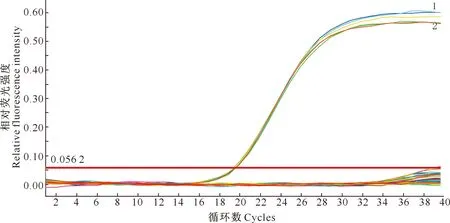
1.舒伯特气单胞菌ATCC43700;2.舒伯特气单胞菌病原分离株WL14831.Aeromonas schubertii ATCC43700;2.Aeromonas schubertii WL1483图1 舒伯特气单胞菌荧光定量PCR检测方法的特异性Fig.1 Specificity of the real-time PCR for Aeromonas schubertii detection
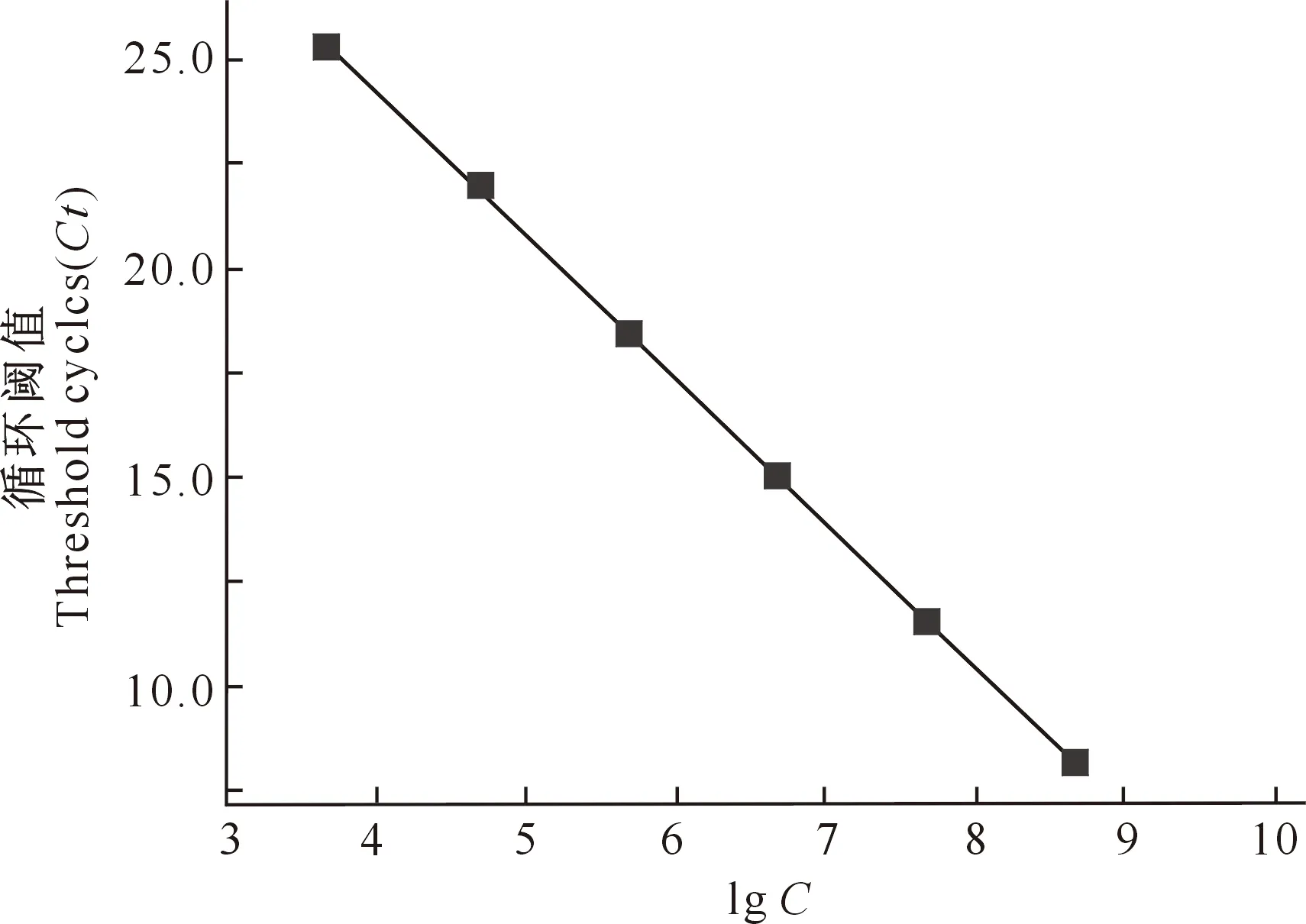
图2 舒伯特气单胞菌rpoD质粒拷贝数(C)与循环阈值(Ct)的标准曲线Fig.2 Standard curve of Aeromonas schubertii plasmid copies (C) and threshold cycle (Ct)
2.3 舒伯特气单胞菌荧光定量PCR的灵敏度试验
2.3.1 含rpoD基因质粒的最低检出限 用建立的荧光定量PCR方法对4.76×106,4.76×105,4.76×104,4.76×103,4.76×102,4.76×101,4.76×100,4.76×10-1拷贝/μL的舒伯特气单胞菌重组质粒标准品进行检测,结果(图3)显示,当样品中重组质粒为4.76×100拷贝/μL以上时,荧光定量PCR扩增可生成“S”型荧光曲线(曲线1~7);当样品中的重组质粒低于4.76×10-1拷贝/μL时,无“S”型荧光曲线生成(曲线8)。
2.3.2 纯培养物的最低检出限 用建立的荧光定量PCR方法对1.5×107,1.5×106,1.5×105,1.5×104,1.5×103,1.5×102,1.5×101,1.5×100CFU/mL的细菌基因组DNA进行检测,结果见图4。
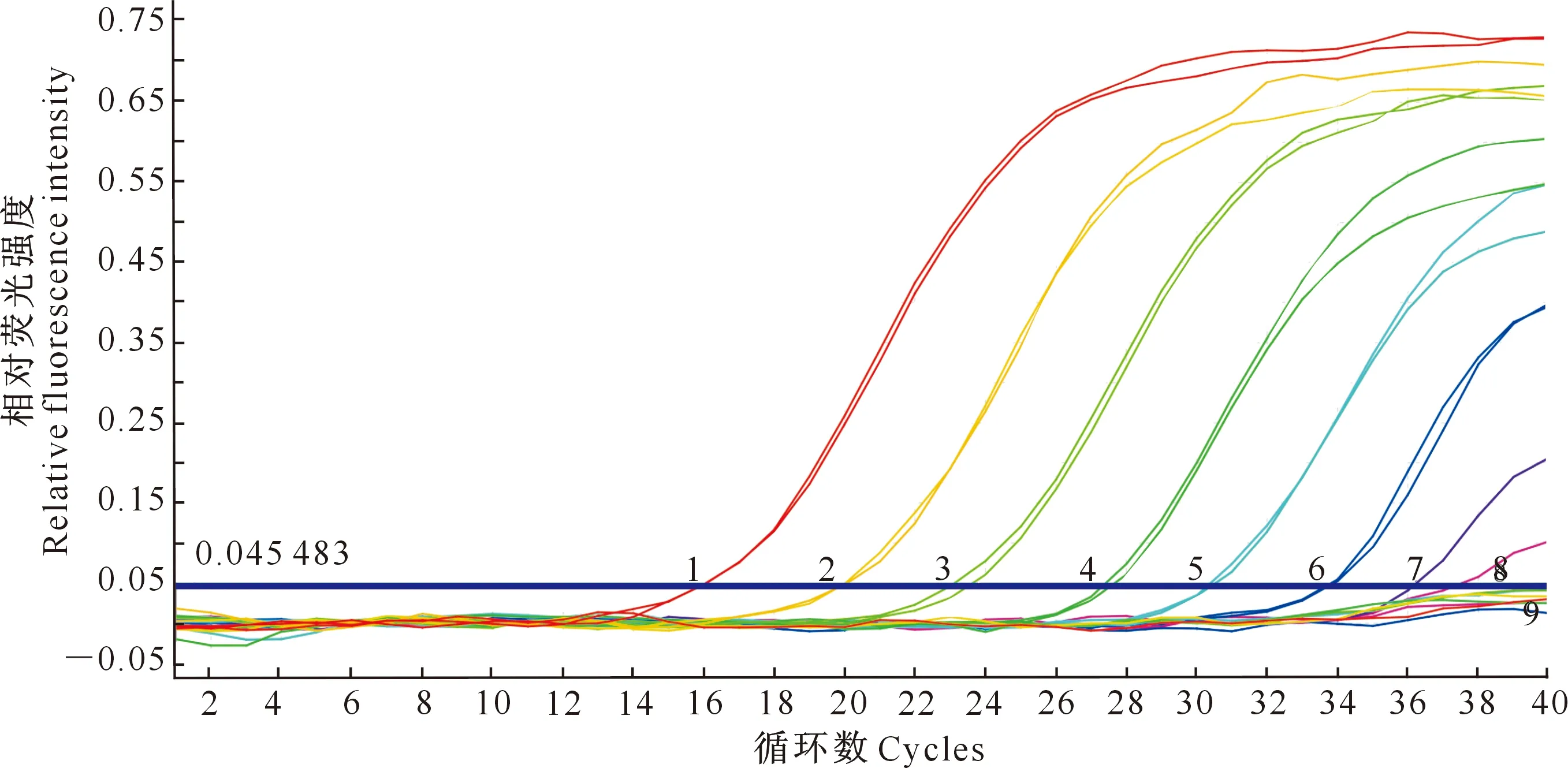
1~8.分别为4.76×106,4.76×105,4.76×104,4.76×103,4.76×102,4.76×101,4.76×100,4.76×10-1拷贝/μL的重组质粒标准品;9.空白对照1-8.Recombinant plasmid concentrations were 4.76×106,4.76×105,4.76×104,4.76×103,4.76×102,4.76×101,4.76×100,and 4.76×10-1 copies/μL;9.Blank control图3 舒伯特气单胞菌重组质粒荧光定量 PCR的灵敏度Fig.3 Sensitivity of the real-time PCR for Aeromonas schubertii plasmid detection
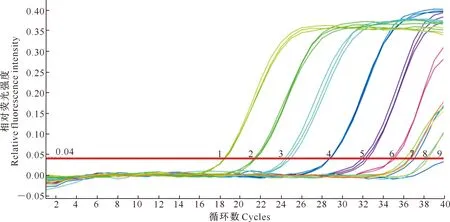
1~8.分别为1.5×107,1.5×106,1.5×105,1.5×104,1.5×103,1.5×102,1.5×101,1.5×100 CFU/mL的舒伯特气单胞菌纯培养物基因组;9.空白对照1-8. Genome DNA of pure cultured A.schubertii 1.5×107,1.5×106,1.5×105,1.5×104,1.5×103,1.5×102,1.5×101,and 1.5×100 CFU/mL;9.Blank control
图4显示,当样品中至少有1.5×101CFU/mL细菌基因组DNA时,荧光定量PCR扩增可生成“S”型荧光曲线(曲线1~7 );当样品中的细菌菌落数低于1.5×100CFU /mL时,无“S”型荧光曲线生成(曲线8)。
2.4 舒伯特气单胞菌荧光定量PCR的重复性
对同一样品在同一次试验获得的Ct值进行统计发现,同一次试验内30个平行样的扩增曲线在阈值线附近基本重合(图5),Ct值平均读数为18.5,标准差为0.094,变异系数为0.95%。同一样品在30次不同试验中所获得的Ct值也基本相同,Ct平均值为19.3, 标准差为0.143,变异系数为1.05%。以上统计结果表明,本试验所建立的舒伯特气单胞菌荧光定量PCR快速检测方法重复性较好。
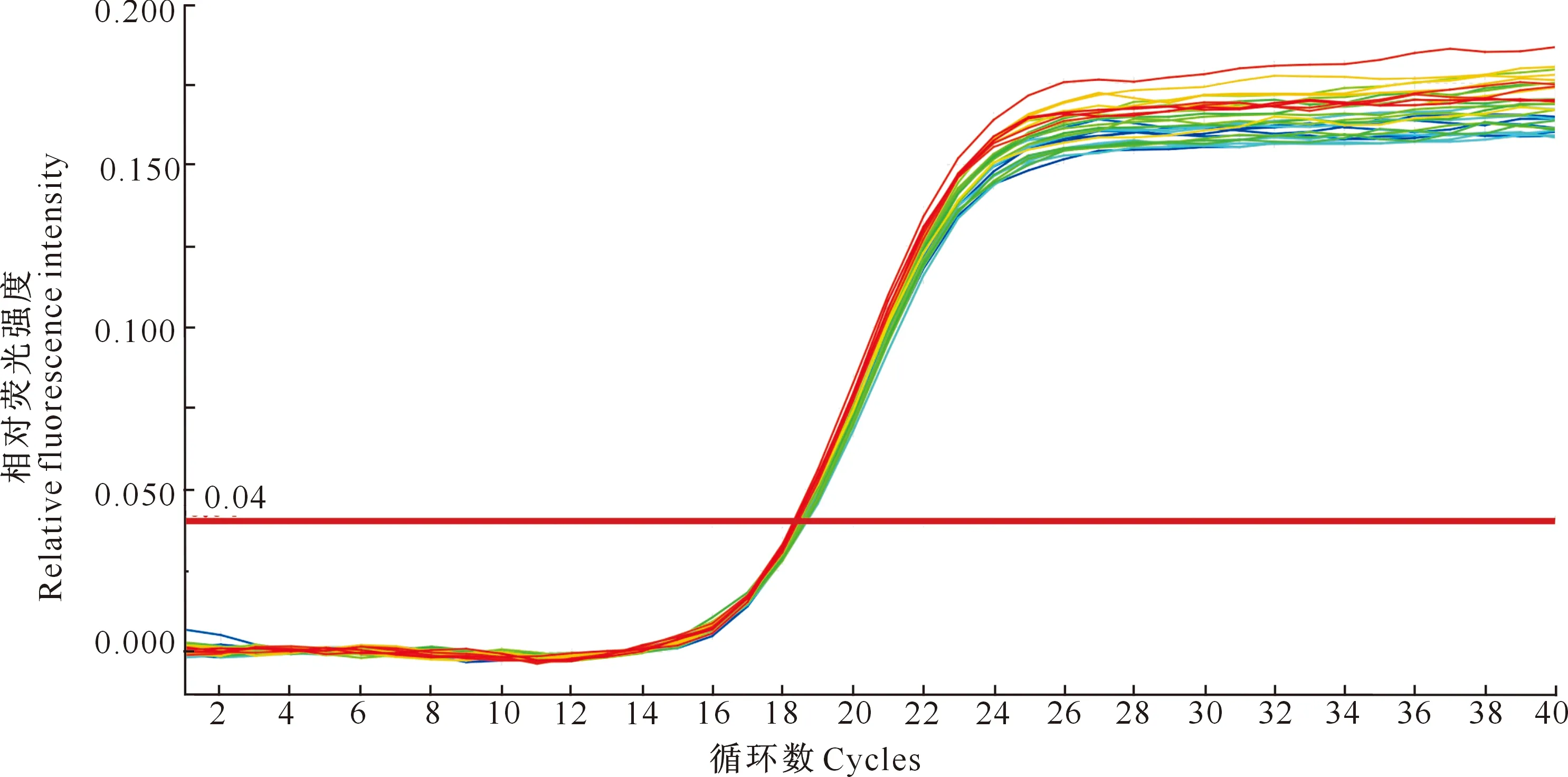
图5 舒伯特气单胞菌荧光定量PCR重复30次的试验结果Fig.5 Results of 30 Aeromonas schubertii detections by real-time PCR
2.5 荧光定量PCR检测方法的临床应用
应用荧光定量PCR方法对临床送检的50份样品进行检测,结果(表1)显示,从中检出阳性样品11份,检出率22%,与传统细菌分离和常规PCR鉴定结果(阳性5份,检出率10%)相比,检出率明显提高。对定量PCR检测阳性、传统检测结果阴性的样品进行增菌再分离,通过常规PCR检测和生理生化鉴定,确定检测结果呈阳性。

表1 舒伯特气单胞菌临床样品的荧光定量PCR检测结果Table 1 Detection of samples of Aeromonas schubertii
3 讨 论
由舒伯特气单胞菌引起的鳢科鱼类内脏白点病,在临床上与其他病原菌引起的鳢科鱼类内脏类结节病,如诺卡氏菌[11]、分枝杆菌[12]和类立克次体[13]等引起的鳢科鱼类内脏类结节病等相似,因此难以区分。由于内脏类结节病的病理组织损伤潜伏期较长,当出现严重的结节症状时体表才会出现相关症状,加之不同病原所致的类似症状诊断困难,因此建立特异、快速、灵敏的检测方法对鳢舒伯特气单胞菌早期预警和病原监测具有重要意义。
用于细菌病诊断的方法通常有2类:一是细菌分离培养,为细菌病诊断金标准,但病原菌的分离纯化耗时长,检出率低,对操作技术要求较高;二是分子生物学诊断,如PCR方法等,其以快速、敏感和特异等优点而被广泛应用于细菌鉴定。管家基因在细菌分类鉴定中被广泛使用,其中16S rRNA的应用尤为广泛[14]。但气单胞菌属细菌种类繁多,种间16S rRNA基因差异较小,仅通过16S rRNA基因难以对其进行分类鉴定;而一些保守性相对较低的管家基因gyrB、rpoB[15-16]和gyrA、rpoD[17-19]等已被广泛用于气单胞菌属/假单胞菌属的分类鉴定。本研究利用rpoD基因保守序列建立的舒伯特气单胞菌荧光定量检测体系,在16株常见病原菌检测中具有良好的特异性,证实rpoD基因能将嗜水气单胞菌、杀鲑气单胞菌、维氏气单胞菌、温和气单胞菌、简氏气单胞菌等气单胞菌在种的水平上进行准确区分,表明该方法适用于舒伯特气单胞菌的特异性检测。
荧光定量PCR快速检测方法灵敏性高,在样本中菌体含量很低的情况下,仍能检测出菌体核酸,并且可对大量样本进行定性和定量分析,因此被广泛应用于动物医学和分子生物学研究领域[20-21]。本研究建立的荧光定量PCR方法检测舒伯特气单胞菌的最低检测限为15 CFU/mL,其灵敏度明显高于刘春等[9]建立的舒伯特气单胞菌多重PCR方法(3×102CFU/mL)。在临床样品检测试验中,荧光定量PCR阳性检出率明显高于传统检测方法,其中传统检测结果阳性的样品,荧光定量PCR检测结果均为阳性,荧光定量PCR检测结果为阴性的样品,传统检测结果无一阳性。荧光定量检测阳性的11份样品中,传统检测只有5份阳性,增菌复检结果表明11份样品均为阳性。荧光定量PCR检测结果与传统检测结果不完全一致,可能是由于其检测灵敏度不同所致,但复检结果表明,荧光定量PCR检测结果与临床结果相符。早期潜伏感染的组织样品或水体中舒伯特气单胞菌载菌量较低时,采用传统细菌分离检测方法可能存在假阴性问题,虽然增菌后检测能提高阳性检出率,但样品中的杂菌同样可能干扰检测结果,因此本研究建立的舒伯特气单胞菌荧光定量PCR检测方法在特异性和灵敏度方面有明显优势,能较好地应用于舒伯特气单胞菌的检测和诊断,可为舒伯特气单胞菌病的早期预警和流行病学调查提供技术支撑。

