动物繁殖中的线粒体DNA 遗传“瓶颈效应”
关盛宇,刘国世,张 鲁
(中国农业大学动物科学技术学院,北京 100193)
线粒体是哺乳动物细胞中的一种重要细胞器,是合成ATP 为细胞生命活动提供能量的主要场所,被称作“能量工厂”。同时线粒体还参与各类新陈代谢活动,参与调节细胞内钙离子浓度与神经元信号传递[1],也在细胞凋亡、先天性免疫[2]、组装铁硫簇[3]等众多细胞活动中发挥作用。线粒体是半自主性细胞器,拥有自身的遗传物质线粒体DNA(mtDNA)[4]。mtDNA 是环状双链DNA,是哺乳动物唯一存在于细胞核外的遗传物质,可以独立进行复制、转录和翻译。人类mtDNA 长度约16.5 kb,包含37 个基因,能够编码13 种呼吸链的多肽亚基,其余组装线粒体的蛋白质由核基因组编码合成[5]。核基因组编码的蛋白质与mtDNA 编码的多肽相互作用形成5 个多亚基复合物,在线粒体膜内组成线粒体呼吸链。哺乳动物细胞内存在多拷贝的mtDNA,一些特定的细胞中还存在mtDNA拷贝数动态变化的现象[6]。mtDNA 突变时常发生,细胞内突变型mtDNA 与野生型mtDNA 混合共存的现象称为mtDNA 的异质性(Heteroplasmy)[7]。
1 线粒体DNA 遗传“瓶颈效应”及其理论基础
1.1 线粒体DNA 的松弛复制 mtDNA 与核基因组不同,在单一细胞内以多拷贝形式存在,不同细胞类型、细胞功能以及细胞年龄的mtDNA 拷贝数也不尽相同,一般哺乳动物细胞中mtDNA 拷贝数在1~10 000[8]。mtDNA的复制不依赖于细胞周期,在线粒体融合(Fusion)和分裂(Fission)的过程中以松弛型复制模式持续进行[6]。mtDNA 松弛型复制模式存在一定程度的偏好性,突变型mtDNA 分子发生复制的概率和频率较野生型更高[9]。这种现象导致细胞内mtDNA 基因频率在分裂前就发生了变化,即mtDNA 基因频率的变化不依赖于细胞周期,而且这种变化随着细胞的分裂还会被放大。
1.2 线粒体DNA 遗传“瓶颈效应”的概念 “瓶颈效应”又称“种群瓶颈效应”,是指在世代交替过程中,原本的大群体由于某些原因发生崩溃导致种群数量急剧减少,原种群中仅有极少数个体得以存活。这个过程类似于种群经过一个细小的“瓶颈”,大部分个体被 “瓶颈”挡住无法通过,因此被形象的称为“瓶颈效应”。当一个种群经过了“瓶颈”的作用后,原本的群体异质性将大幅度降低,加之遗传漂变作用,等位基因频率快速变化,甚至出现某些基因完全消失以及某些等位基因固定的现象。
早期对荷斯坦奶牛卵母细胞发育的研究中发现,mtDNA 等位基因频率在遗传过程中存在快速变化的现象,mtDNA 由突变产生的新基因型能在短短2~3 代内从较低的等位基因频率快速得到固定[10]。mtDNA 分子可以理解为一个单倍型个体,假设野生型和突变型2 种mtDNA 自由混合在大群体中,每次只选取少数的mtDNA 保留,则每次所选择的mtDNA 中突变型与野生型的比例都是不同的。经过遗传瓶颈,亲代mtDNA仅有万分之二到千分之二的拷贝能够传递给子代,该部分DNA 复制、扩增,构成子代的mtDNA[11]。这一选择性保留的过程存在较大的随机性,使得母代和子代、子代个体之间mtDNA 基因频率出现差异。研究者已在果蝇、斑马鱼、小鼠以及人类致病性mtDNA 突变的遗传中发现了类似现象[12]。
1.3 线粒体DNA 遗传经历2 次“瓶颈” 线粒体DNA 瓶颈效应主要发生在卵细胞发生时期和胚胎植入前期[13]。第1 次“瓶颈”发生在原始生殖细胞(PGCs)增殖分化形成初级卵母细胞的过程中,初级卵母细胞包含的mtDNA呈现较低水平。Wai 等[14]发现小鼠原始生殖细胞中mtDNA 拷贝数平均为6 000 左右,而初级卵母细胞中mtDNA 拷贝数下降了一半以上。绵羊卵母细胞成熟过程中,线粒体和mtDNA 大幅度增殖,1 枚绵羊成熟的卵母细胞中mtDNA 拷贝数可达70 万[15]。第2 次“瓶颈”发生在受精后早期胚胎发育时期,早期胚胎发育过程中线粒体和mtDNA 不进行复制增殖,囊胚期前整个胚胎的mtDNA 拷贝总数保持稳定。随着卵裂的发生,mtDNA随线粒体被分配到各个卵裂球中,胚胎内细胞数量增多使得单个细胞内mtDNA 拷贝数相应减少(图1)。
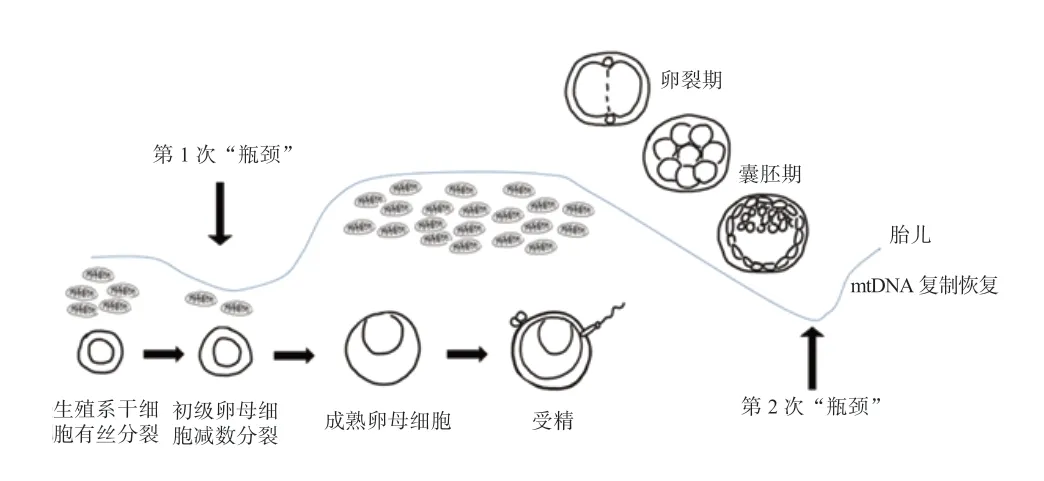
图1 mtDNA 遗传经历2 次“瓶颈”[13]
2 线粒体DNA 遗传“瓶颈效应”的机制
mtDNA 在母系遗传过程中受到物理瓶颈的限制,导致子代mtDNA 保留数量减少[16]是解释“瓶颈效应”最简单直接的假说。然而对于生殖细胞在不同时期异质性水平的研究表明,mtDNA 拷贝数减少并不能完全解释“瓶颈效应”的机制[17]。目前尚未研究出瓶颈效应的确凿机制,Cao 等[18]提出瓶颈效应除了通过mtDNA绝对拷贝数降低产生外,还可以通过mtDNA 局部复制或线粒体自噬,以减少mtDNA 有效分离单元的方式产生。有研究提出在细胞和亚细胞结构对线粒体进行选择的机制[19]:在细胞层面上来说,一个细胞内部的异常线粒体达到一定数量,影响了细胞正常生存,这个细胞会发生凋亡;同时,如果一个线粒体内部的mtDNA 拷贝异常,且异常的mtDNA 拷贝数达到阈值影响了线粒体功能,这个异常功能的线粒体会被细胞通过自噬清除;在线粒体复制时如果出现错误,线粒体自噬机制会启动清除该线粒体。
3 线粒体DNA 对早期胚胎发育的影响
线粒体是卵母细胞中数量最为丰富的细胞器之一[20],在早期胚胎发育中发挥关键作用。卵母细胞携带的线粒体与mtDNA 在卵母细胞成熟过程中进行积累直到排卵受精[8],受精后胚胎线粒体数和mtDNA 拷贝数不增加,线粒体通过位置迁移和物理形态变化的方式提高工作效率[21]。哺乳动物mtDNA 遵循母系遗传,受精结束后精子所携带的父源线粒体和mtDNA 被迅速清除[22],因此受精后胚胎内线粒体和mtDNA 与受精前卵母细胞保持一致。
mtDNA 拷贝数影响成熟卵母细胞受精。Reynier 等[23]研究表明,卵母细胞发生异常以及卵胞质成熟不完全会导致mtDNA 拷贝数降低,影响体外受精(IVF)正常受精比率。Santos 等[24]针对人类胚胎的实验发现,接受IVF 或胞浆内单精子注射(ICSI)而未受精的卵母细胞内的mtDNA 拷贝数显著低于受精的卵母细胞。猪IVF 实验也有类似的结果,卵母细胞受精前mtDNA拷贝数必须达到一个“安全阈值”胚胎才可以正常发育[25]。有研究证明,体外成熟卵母细胞线粒体DNA 较低会影响受精后减数分裂纺锤体的形成[26]。从以上研究可以看出,在囊胚期mtDNA 复制得到恢复之前,MII 期卵母细胞中较高的mtDNA 拷贝数对于支持受精和早期胚胎发育是必要的。这也提示卵母细胞成熟前mtDNA 经过第1 次“瓶颈”的重要意义:在卵母细胞成熟mtDNA 大量复制前减少异常的突变体mtDNA 比例,降低mtDNA 异质性,使得成熟卵母细胞内线粒体功能异常概率尽可能下降,维持受精等生殖过程的正常进行。Diez-Juan 等[27]发现,能够附植的囊胚期胚胎滋养层细胞内mtDNA 拷贝数低于不能附植的胚胎。Fragouli等[28]发现了同样的现象,并且提出了以一个滋养层细胞内mtDNA 拷贝数的阈值判断胚胎是否能够正常附植。能够正常附植的囊胚中细胞内mtDNA 拷贝数较低,与mtDNA 遗传第2 次“瓶颈”相符。mtDNA 在胚胎附植前不复制,卵裂时mtDNA 随线粒体迁移至不同卵裂球内,胚胎细胞在不断分裂时每个细胞的mtDNA 拷贝数较低且逐渐降低。
4 结 语
线粒体DNA 遗传“瓶颈效应”的意义在于清除突变体,保证线粒体正常功能,维持细胞生命力。mtDNA 缺乏组蛋白保护且修复机制不完善,在线粒体这样高度活跃的生理生化环境下突变的发生在所难免。而mtDNA 相对封闭的母系遗传方式使得突变更加容易在遗传过程中累积,从而落入“穆勒棘轮”中走向有害突变不停累积的恶性循环。通过mtDNA 遗传“瓶颈效应”的手段使突变型和野生型基因快速分离,达到尽可能消灭有害突变并维持正常生理功能作用。针对mtDNA 突变在动物配子生成和胚胎发育的研究,以及为提高 IVF、胚胎移植(ET)、体细胞核移植(SCNT)等胚胎工程技术效率的措施的探索,越来越多的证据提示线粒体和mtDNA 在动物繁殖活动中发挥着关键作用,开展mtDNA 遗传相关的研究有重要意义,借助快速发展的现代分子生物学技术,线粒体在动物繁殖中的作用机制将不断被揭示,为提高家畜繁殖效率提供支持。

