DPA-Zn 金属阳离子脂质的合成及转染活性研究
易文婧,阿地力江·阿不力米提,赵志刚
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
基因治疗的关键在于发展安全和高效的基因传递载体[1].阳离子脂质是一类重要的基因载体,其具有诸多优势[2].阳离子脂质的化学结构决定了脂质复合物的物理特性,是决定基因传递效果和细胞毒性的重要因素.阳离子脂质结构一般包括三个部分:阳离子头部,疏水尾部以及这两个部分之间的连接基团[3].阳离子脂质的头部基团在基因递送过程中起着至关重要的作用,其可以与核酸中带负电荷的磷酸骨架结合,缩合DNA.目前研究的大多数阳离子脂质均采用非特异性的胺基为阳离子头部[4].除了阳离子脂质,金属复合物因其具有更丰富的结构和更合理的正电荷密度,作为一种新型的DNA 缩合剂和传递载体受到了研究者们的广泛关注[5-9].这些金属配合物在生理pH 条件下带有正电荷,能通过多种相互作用与聚阴离子核酸结合形成DNA 复合物携带正电荷,可与带负电的细胞膜相结合,并促进复合物内吞.此外,一些金属中心受益于丰富的光物理和电化学性质,使其效用远远超出DNA 缩合剂和传递载体的范畴[5,10-11].Bull 等报道,二价金属离子Zn(II)可以与核酸的磷酸基团结合,通过Zn(II)与核酸自组装实现基因传递[12].Kawakami 等,将Zn(II)引入含咪唑基的聚合物,发现可以极大地提高转染效率[13-14]. Yu等将Zn(II)引入大环多胺聚阳离子体系,同样实现了提高转染率的效果[15].Chen 等将Zn -DPA 引入透明质酸骨架,可以有效地实现基因沉默[16-17].最近,Guo等应用含有二硫键的Zn-DPA 化合物功能化改性低分子量PEI 构建的载体不仅毒性较低,同时还能高效转染难转染的细胞类型[18-19]. Zn -DPA 功能化的仿病毒载体不仅与富含磷脂的细胞膜有很强的亲和力,同时还有趣地发现其具有增加内涵体逃逸的功能[20].
阳离子脂质或金属配合物作为基因载体已有大量研究,但是协同阳离子脂质和金属络合物各自优势构建的金属-脂质基因载体的研究还较少. Noveron等,报道了一类Cu(II) -两亲配合物,可以将大片段的DNA 传递到真核细胞[21].最近我们制备了一系列基于Zn-DPA 头部的新型单核金属阳离子脂质[22].结构-活性关系研究表明含有十六烷基醇疏水尾部的脂质具有最佳的转染效率. 在前期的研究基础上,本研究基于相同的Zn -DPA 骨架、十六烷基醇疏水尾部和氨基甲酸酯连接键,设计合成了双核金属脂质,并通过多种实验手段比较了其与单核金属脂质的DNA 相互作用能力和基因转染活性.
1 实验部分
1.1 仪器和试剂
仪器:琼脂糖凝胶水平电泳仪,全自动凝胶成像分析仪:美国Bio - Rad;荧光光谱仪:Fluoromax -4(JOBIN-YYON,HORIBA);多功能酶标仪,恒温CO2细胞培养箱:美国Thermo;纳米粒度及电位分析仪:英国Malvern;核磁共振仪:Varian INOVA -400MHz(1H:400 MHz,13C:100 MHz,0.5% TMS 为内标).
试剂:DMEM 及1640 细胞培养基、胎牛血清、胰酶、双抗(链霉素-青霉素)等均购自Invitrogen 公司;0.22 μm 无菌滤器购自Millipore 公司;荧光素酶试剂盒和BCA 试剂盒购自Promega 和Pierce 公司.其他所用药品和试剂均为分析纯.
1.2 目标金属脂质的制备
化合物1,2 参照文献方法合成[17],化合物3,4,6a 参照本课题组前期文献合成[22]. 目标脂质的合成如Scheme 1 路线所示.
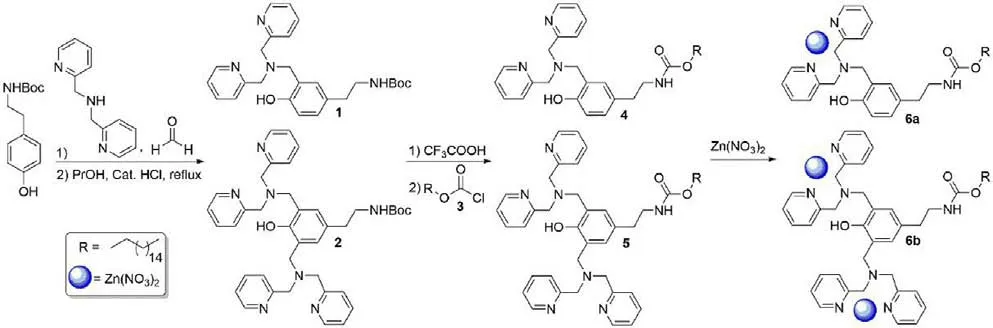
路线1 金属脂质合成示意图Scheme 1 The synthetic route for target metallo-lipids
化合物5 的合成
用3 mL 无水二氯甲烷将1 mmol 化合物2 溶解,冰浴条件下,缓慢滴加3 mL 三氟乙酸.薄层色谱监测反应,反应完全后,减压蒸馏除去溶剂. 产物无需分离,直接进行下一步反应.将残留物用50 mL 无水二氯甲烷溶解,并加入三乙胺(2.2 mmol). 向上述溶液中,缓慢滴加化合物3(1.2 mmol)的二氯甲烷溶液(20 mL).搅拌过夜,依次用饱和NaHCO3溶液和食盐水洗涤,硅胶柱分离,得到黄色油状液体,产率29.8%.1H NMR (400 MHz, CDCl3) δ (ppm) 8.51 (d,J =4.9 Hz, 4H, H -6(Py)), 7.60 (t, J =7.7 Hz,4H, H-4(Py)),7.47 (d, J =7.8 Hz, 4H, H-3(Py)),7.12 (t, J =6.2 Hz, 4H,H -5(Py)),7.01 (s,2H, H -Ph), 5.04 (s, 1H, -OH), 4.00(t, J =6.8 Hz,2H, -COOC H2-), 3.87 (s, 8H,-NC H2Py),3.79 (s,4H, -NC H2Ph),3.40 -3.35(m,2H, - CONHC H2-), 2. 70 (t, J = 7. 0 Hz,2H, -CH2C H2Ph), 1.53 (t, J =6.9 Hz, 2H, -COOCH2C H2- ), 1. 33 - 1. 24 (m, 26H, - CH2(C H2)13CH3),0.88 (t, J =6.6 Hz,3H, -C H3).13C NMR (101 MHz, CDCl3) δ 159.1, 156.8, 154.4,148.8,136.5,129.5,128.4,124.0,123.0,122.0,64.9, 59.8, 54.8, 31.9, 29.7, 29.6, 29.6, 29.5,29.3,29.3,29.0,25.8,22.7,14.1. ESI-MS: C51H69N7NaO3(M +Na)+, Calculate: 850. 53, Found:850.53.
化合物6b 的合成
将0.025 mmol 化合物5 溶解于1 mL 甲醇溶液中.向其加入0.050 mmol 的1 mL Zn(NO3)2·6H2O水溶液.室温搅拌1 h.减压蒸馏除去溶剂,真空干燥后得到目标金属-脂质复合物.ESI -MS:C51H68N9O9Zn2+(M +2Zn +2NO3- H)+, Calculate: 1078. 37,Found:1078.74.
1.3 阳离子脂质体的制备
室温下,将0.0025 mmol 阳离子脂质及等摩尔的中性脂质二油酰磷脂酰乙醇胺(DOPE),加入到10 mL灭菌的圆底玻璃管中,并用2.5 mL 的无水氯仿溶解.用旋转蒸发仪缓慢蒸除溶剂得到脂质体膜,真空干燥8 小时.将脂质体膜用2. 5 mL 灭菌二次蒸馏水溶解,并将混合物置于4 °C 冰箱中溶胀过夜.涡旋1 ~2 分钟以溶解粘附于玻璃管壁的脂质体膜,室温下超声5 分钟生成多层囊泡.进一步使用探头超声制备阳离子脂质体溶液(1 mmol/L).用220 μm 滤膜过滤后,于4 °C 冰箱保存备用.
1.4 凝胶电泳实验
根据不同的电荷比,取适当体积上述阳离子脂质体溶液与的pUC19 质粒DNA (0.125 μg)混合,于37℃水浴孵化30 min 后,进行凝胶电泳实验.
1.5 粒径、电位测定
根据不同的电荷比,取适当体积上述阳离子脂质体溶液与1 μg 的DNA 混合(总体积为1 mL 水溶液),25 °C 条件下测定其粒径和zeta 电位.
1.6 细胞培养
按照文献方法[22]将HEK293 细胞(人肾上皮细胞)培养于含有10%胎牛血清(FBS)和1%抗生素DMEM 培养基,在37 °C、5% CO2培养箱中培养.
1.7 溴乙锭置换实验
使用溴化乙锭(EB)置换方法研究脂质5 与DNA的相互作用能力,并通过荧光光谱仪测定. 将5 μL EB(1.0 mg/mL)放入含有2.5 mL 10 mM 4 -(2 -羟乙基) -1 -哌嗪乙磺酸(HEPES)溶液(pH 7.4)的石英比色杯中. 搅拌均匀后,测量EB 的荧光强度(FEB).然后,将CT DNA(10 μL,1.0 mg/mL)加入到上述EB 溶液中,混合均匀后,测定DNA -EB 复合物的荧光强度(F0). 随后,进一步测量将脂质5 的溶液(1.0 mM,每次添加7.5 μL)加入上述混合溶液的荧光强度(F).所有样品在520 nm 激发,并在600 nm 测量发射光谱.纯EB 溶液和不含阳离子脂质体的DNA-EB 溶液分别用作阴性和阳性对照. 使用公式%F=(F-FEB)/(F0-FEB)测定相对荧光百分比(%F),其中FEB 和F0分别表示纯EB 溶液和DNA -EB 溶液的荧光强度.
2 结果与讨论
2.1 目标金属脂质的合成
目标脂质的合成路线如Scheme 1 所示.化合物2可通过N-(叔丁氧基羰基) -4 -羟基苯乙胺与二甲基吡啶胺和甲醛反应生成. 将2 通过三氟乙酸脱除Boc-保护基后的产物与十六烷基碳酰氯3 反应,得到脂质前体化合物5. 进一步与二倍当量的Zn(NO3)2反应,得到目标金属脂质6. 化合物的结构通过核磁和质谱表征.
2.2 金属阳离子脂质体与DNA 的相互作用研究
金属阳离子脂质体由金属脂质和DOPE 按摩尔比1:1 制备.通过凝胶电泳和溴乙锭置换实验考察了金属脂质形成的脂质体与DNA 的相互作用能力. 由图1A 可知,6a-b 形成的脂质体均可在电荷比等于或高于4 时,完全包裹DNA,阻滞DNA 的迁移.进一步通过溴乙锭置换实验,考察了两种脂质形成脂质体与DNA 的结合能力. 由图1B 可知,随着电荷比的增加(0 -5),原始荧光强度显著降低.在电荷比为4 时,仅有10%左右的原始荧光强度. 淬灭原始荧光强度为50%时,6b 所需的电荷比小于6a,表明双金属脂质的结合能力强于单金属脂质.凝胶电泳和溴乙锭置换实验均证明金属脂质6a-b 对DNA 有很好的结合能力.
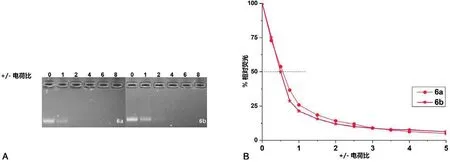
图1 不同电荷比条件下脂质6a-b 的凝胶电泳(A)和溴乙锭置换(B)Fig. 1 Electrophoretic gel retardation (A) and EB displacement (B) assays of lipids 6a-b under various charge ratios
2.3 金属脂质体/DNA 复合物的粒径电位表征
6a-b 形成的金属脂质体与DNA 形成复合物的粒径和zeta 电位结果如图2 所示.图2A 显示,在较低的电荷比(电荷比 =2)时,脂质体/DNA 形成复合物的粒径均最大. 随着电荷比的增加,粒径变小. 对于6a 而言,当电荷比大于6 时,粒径趋于稳定,在150 nm左右.而化合物6b 的粒径随电荷比的增加有减小的趋势.在更高的电荷比条件下,6b 比6a 有更小的粒径,表明其具有更强的DNA 缩合能力.这个结果与溴乙锭置换结果一致(图1B).由图2B 可知,6a-b 脂质体/DNA 复合物的电位均随着电荷比的增加而增加.6a/DNA 复合物的电位随电荷比的增加变化较大,6b/DNA 复合物电位在电荷比大于4 后增加趋势放缓.
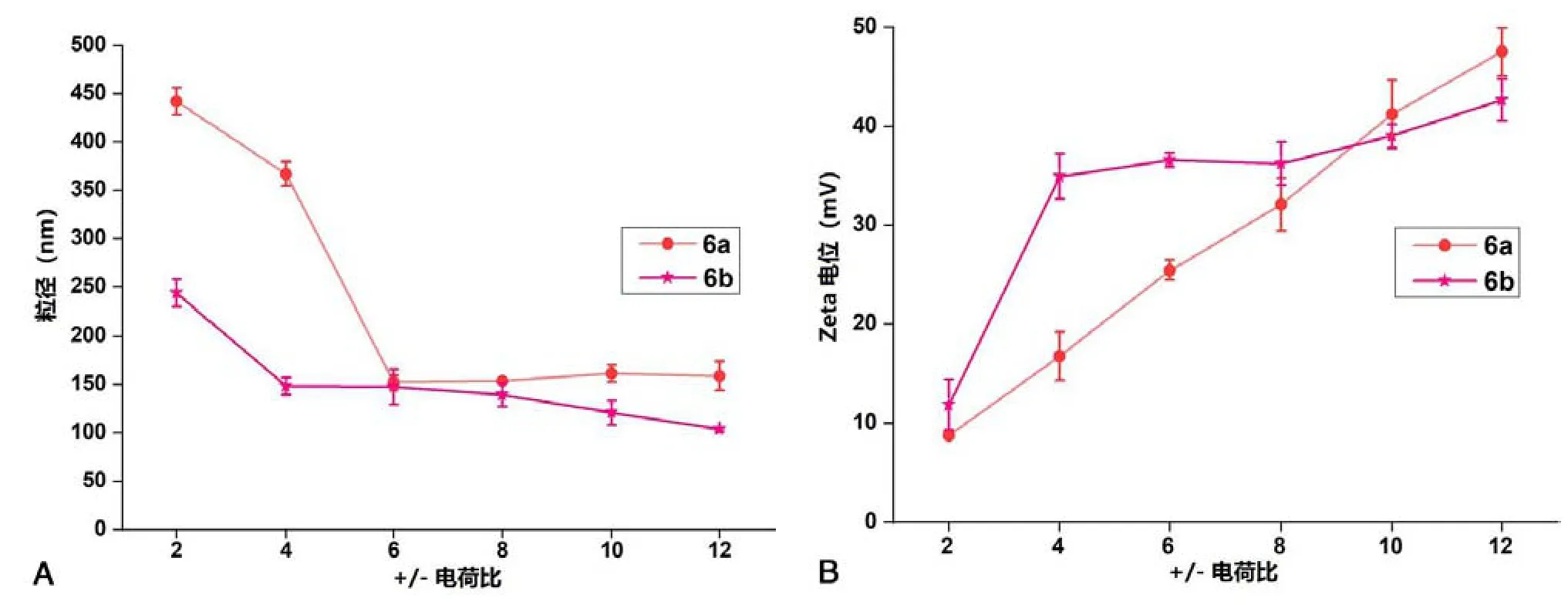
图2 不同电荷比条件下脂质6a-b/DNA 复合物的粒径(A)和电位(B)Fig. 2 Mean particle sizes (A) and surface charge (B) of the lipoplex 6a-b under various charge ratios (2,4,6,8,10 and 12)
2.4 金属脂质体与DNA 复合物的细胞毒性研究
合成基因载体的低细胞毒性是其应用于临床基因治疗的关键因素之一. 通过MTT 法测定阳离子脂质体/DNA 复合物在HEK293 中的细胞毒性,以商品化试剂Lipofectamine 2000 和bPEI 25k 作为对照. 由图3 可知,6a-b 的细胞毒性与Lipofectamine 2000 和bPEI 25k 相当,细胞存活率大于80%左右.
2.5 金属脂质体的基因转染活性研究
以pGL3 质粒作为荧光素酶报告基因, 在HEK293 细胞中研究脂质体复合物的体外基因转染效率,并以商品化试剂Lipofectamine2000 为对照.图4表明,6a-b 两个脂质的转染效率在电荷比8 ~12 范围均随着电荷比的增加而增加. 但是,进一步增加会使得载体细胞毒性变大,进而导致转染效率降低. 此外,6a 的转染效率高于6b,与Lipofectamine2000 相当.6b 转染效率低的原因,可能在于其与DNA 的结合能力过强,不利于DNA 在细胞内释放,影响DNA的进一步表达.
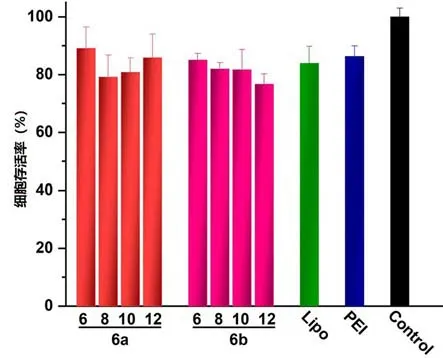
图3 不同电荷比条件下脂质6a-b/DNA复合物的细胞毒性Fig. 3 Cell toxicity of the lipoplexes 6a-b prepared at various charge ratio with lipofectamine 2000 and bPEI 25k as controls
3 结论
本文基于DPA -Zn 金属阳离子头部,以十六烷醇为疏水尾部、氨基甲酸酯键为连接基团,制备了单/双核金属阳离子脂质.通过多种实验方法考察了其与DNA 的相互作用、金属脂质/DNA 形成复合物的粒径电位、细胞毒性和基因转染活性.结果表明,双核金属脂质虽转染效率低于单核脂质,但具有与单核金属脂质相似的细胞毒性,并表现出更强的包裹缩合DNA的能力.后续研究,将继续利用DPA -Zn 与DNA 磷酸骨架的特异结合作用,开发具有刺激响应特性的新型金属脂质基因载体,并提高其转染效率.

图4 脂质6a-b/DNA 复合物在HEK293 细胞中的转染效率Fig. 4 Transfection efficiencies of lipid 6a-b in HEK293cells with lipofectamine 2000 as the control

