利用VIGS技术研究NtbHLH93基因在烟草甾醇代谢中的功能
武明珠,刘瑞霞,王 中,郑庆霞,张剑锋,李泽锋,谢小东,魏 攀,李 锋,罗朝鹏,曹培健,杨 军*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
2.郑州师范学院,郑州市惠济区英才街6号 450044
转录因子bHLH(Basic/helix-loop-helix,碱性/螺旋-环-螺旋)广泛存在于生物体内,是真核生物中一类拥有众多成员的重要转录因子。bHLH转录因子的作用广泛,主要参与调控植物的生长发育、抗逆性、次生代谢过程[1-3];参与调控动物的神经发育、肌肉发生、心脏发育等过程[4-5];参与调控酵母的磷吸收和糖酵解过程[6]。
bHLH转录因子一般具有典型的螺旋-环-螺旋结构(Helix-loop-helix,HLH)。HLH区域大约由40个氨基酸组成,位于bHLH结构域的C端,含有既亲水又亲脂的α-螺旋(α-Helix)。两个α-螺旋之间被不同长度的连接区(Loop)分开,形成螺旋-环-螺旋结构。bHLH转录因子家族成员的碱性区域(Basic region)位于bHLH结构域的N端并与HLH基序相邻,由10~15个氨基酸组成,其中包括6个共有氨基酸残基,该区域主要与DNA结合。同一个bHLH转录因子的两个α-螺旋或不同bHLH转录因子α-螺旋之间可以相互作用,形成同源或异源二聚体,从而与靶基因启动子的不同部位结合,对基因的转录发挥调控作用[7]。
目前,拟南芥和水稻中分别预测到158个和173个bHLH转录因子,并且把bHLH基因家族分为26个亚类。Li等[8]发现在水稻和拟南芥中,有72个bHLH基因在根、茎、叶和花中都有表达。其中,10个在根部特异表达,1个在茎部特异表达,9个在叶片中特异表达,30个在花和种子中特异表达。bHLH转录因子普遍表达的特点与其广泛的生物学功能相对应。拟南芥AtbHLH93转录因子可以调控拟南芥在短日照情况下的生长发育和开花时间,GUS染色发现AtbHLH93基因主要在拟南芥幼苗的叶脉及根冠中表达[9]。Feldman 等[10]研究发现AtbHLH93还可调控拟南芥甾醇类和异戊二烯类物质的合成代谢,突变体bhlh93和野生型相比,突变体中甾醇类物质含量显著下降,其中豆甾醇的含量下降最多。
烟草中的甾醇类物质主要有胆甾醇、菜油甾醇、豆甾醇和β-谷甾醇等[11],霉变烟叶中还可能含有麦角甾醇[12]。植物甾醇在一定温度下裂解均能产生稠环芳烃类化合物(PAHs)[13-14]。含有大量甾醇的烟草己烷萃取物是卷烟烟气PAHs的主要前体物,卷烟烟气中61%的苯并[a]芘(B[a]P)由它裂解产生[9]。豆甾醇在750℃下热解可以生成B[a]P[11,15],在豆甾醇裂解过程中,可能甾醇骨架的一系列单分子反应后形成了菲、蒽等PAHs,而菲、蒽等PAHs的形成依赖于甾醇多环骨架[16-17]。PAHs是最早发现的具有“致癌、致畸、致基因突变”的有毒物质[18]。降低烟草中甾醇含量,可降低烟气中PAHs的含量。前期实验中克隆到栽培烟草红花大金元NtbHLH93基因,发现其与拟南芥AtbHLH93基因序列高度相似[19]。为此,对NtbHLH93基因的沉默植株进行分析,旨在解析NtbHLH93在烟草甾醇合成中的功能。
1 材料与方法
1.1 材料和试剂
本氏烟草(Nicotianabenthamiana)种子经10%NaClO消毒后,种植于MS培养基中。成苗期进行移栽后,种植于国家烟草基因研究中心温室。
Fast High Fidelity Polymerase高保真酶购于北京全式金生物技术有限公司;胶回收试剂盒、反转录试剂盒、大肠杆菌DH5α感受态细胞、pMD19-T载体均购于宝生物工程(大连)有限公司;连接试剂盒购于北京天根生化科技有限公司;MS培养基购于美国Sigma-Aldrich公司;SYBR Premix Ex TaqTM购自宝生物工程(大连)有限公司。其他试剂均为国产分析纯。所用引物和产物的测序均由北京华大基因科技股份有限公司完成。
1.2 pTRV2重组载体的构建
根据NtbHLH93基因的全长序列,设计引物用于构建pTRV2重组载体。正向引物:5'-TACACCAT GGGAACATTGAATCGTCCAG-3',反向引物:5'-TCA TGAGCTCCTCTTTGTAATTTCCCAG-3'。分别在两条引物上添加NcoⅠ和SacⅠ酶切位点和相应的保护碱基。PCR程序:94℃预变性5 min;94℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,30个循环;72℃延伸10 min;4℃保温。PCR产物经酶切回收后连接到pTRV2空载体上,4℃过夜。连接载体转化感受态细胞DH5α后培养过夜,挑取白色单菌落,37℃摇床培养12 h(200 r/min)。以菌液为模板进行PCR,验证是否为阳性克隆。对含有目的片段的重组质粒进行双酶切验证和测序。
1.3 农杆菌的转化
农杆菌转化参照魏攀等[20]的方法。八氢番茄红素去饱和酶(PDS)基因为农杆菌侵染的报告基因。将 VIGS质粒pTRV1、pTRV2、pTRV2-PDS和pTRV2-NtbHLH93通过冻融法转入农杆菌菌株EHA105中,经菌落PCR验证后,将阳性菌落接种到LB培养基中28℃过夜培养。LB培养基含有50 mg/L卡那霉素、25 mg/L利福霉素、20 μmol/L乙酰丁香酮(AS)及10 mmol/L 2-N-吗啉基乙磺酸(MES)。菌液4 000 r/min离心5 min后,弃上清液。用 10 mmol/L MgCl2、200 μmol/L AS、10 mmol/L MES配制侵染缓冲液,再用侵染缓冲液重悬菌体,将菌液稀释至OD600为1.0左右。以本氏烟草为侵染对象,注射生理盐水的烟草为空白对照(Con),阴性和阳性对照分别为注射pTRV2和pTRV2-PDS质粒的农杆菌,实验组为注射pTRV2-NtbHLH93质粒的农杆菌。将含质粒pTRV1和pTRV2,pTRV1和pTRV2-PDS,pTRV1和pTRV2-NtbHLH93的农杆菌按1∶1的比例进行混合,用无菌注射器将农杆菌注入本氏烟草下部叶片中。
1.4 甾醇含量的测定
用GC-MS/MS检测转基因烟草中甾醇代谢物(胆甾醇、菜油甾醇、豆甾醇、β-谷甾醇等)含量的变化,每个样品3次生物学重复。样品前处理及分析:称取冻干烟叶样品50 mg,加1.5 mL正己烷、30 μL内标(10 ng/mL 5α-胆甾烷),涡旋6 s后室温超声提取20 min。将提取液静置15 min,6 000 r/min离心5 min。取500 μL上清液至1.5 mL进样瓶中,氮气吹干后加入50 μLN-三甲基硅基-N-甲基三氟乙酰胺(MSTFA)。在37℃下反应50 min后,进行GC-MS/MS分析。气相色谱条件:
色谱柱:DB-5MS(30 m×0.25 mm×0.25 μm);进样量:1.0 μL;分流比:10∶1;进样口温度:280 ℃;载气:He;流速:1 mL/min;升温程序:60 ℃(20 min)。离子源温度:230℃;四极杆温度:150℃;离子源:EI源;采集模式:选择离子监测(SRM)。
选择特征离子对甾醇化合物进行定量:根据鲜烟叶中主要甾醇化合物的结构特征离子,选择甾醇化合物的定量离子,分别对各种甾醇化合物进行定量分析,每个化合物同时选择2~3个离子碎片进行辅助定量。根据特征离子峰面积与内标峰面积比值进行绝对定量。
1.5 荧光定量PCR
根据NtbHLH93、Niben101Scf06249g03002.1和Niben101Scf06249g03002.1基因序列设计qPCR引物。NtbHLH93上游引物:5'-CACAGGTTGCGTGAA GATC-3',下游引物:5'-GAGGGTTTCTGACAAGTG C-3';Niben101Scf06249g03002.1上 游 引 物 :5'-GGCACAGTCACCCACAAA-3',下游引物:5'-ATCC CTTCGCCTGAACAT-3';Niben101Scf06249g03002.1上游引物:5'-GCACCGTCACTCACAAAG-3',下游引物:5'-CTGCTGCATCACCAACTA-3'。烟草26SrRNA为内参基因,上游引物:5'-GAAGAAGGTCCC AAGGGTTC-3';下游引物:5'-TCTCCCTTTAACAC CAACGG-3'。用FluorescentQuantitativePCRDetector(美国BIO-RAD公司)进行qPCR。
在冰上配制20µL的反应体系:2×SYBR Premix Ex TaqTM10 µL,10 μmol/L上、下游引物各0.5 µL,30 ng/µL cDNA 1 µL,ddH2O 8 µL。进行3次独立生物学重复,以不加模板的反应为阴性对照。qPCR反应程序:预变性94℃30 s;94℃变性5 s,60 ℃退火20 s,72 ℃延伸20 s,45个循环。反应结束后,根据得到的CT值,用 2-△△CT方法计算相对表达量[21]。经26S rRNA基因标准化后,设相同处理时间下对照的相对表达量为1,基因的相对表达量则为该基因与对照处理的比值。
1.6 转录组测序及数据分析
取VIGS诱导的基因沉默烟株和对照烟株(移栽4周后的本氏烟草,每个处理3个生物学重复)叶片,液氮速冻后,置于泡沫箱中用柱状干冰运输至金唯智生物科技(北京)有限公司,进行转录组测序。转录组数据经过简单拼接,用de novo生物信息学软件进行组装。组装后的数据使用NCBI数据库(http://www.ncbi.nlm.nih.gov/)和中国烟草基因组数据库(V3.0)进行比对分析,选取表达差异倍数≥2的基因。使用blast2 go软件进行GO功能分析。
1.7 数据处理
采用SPSS 16.0软件对数据进行统计分析,选择Duncan’s测验(P<0.05)进行差异显著性分析。
2 结果与分析
2.1 NtbHLH93基因的载体构建
根据已克隆到的NtbHLH93基因全长序列设计VIGS引物,并进行PCR扩增。对PCR扩增产物进行验证,发现扩增条带长度在500 bp左右(图1a)。将PCR产物连接到PTRV2空载体上,对pTRV2-NtbHLH93重组载体进行双酶切,发现酶切产物长度在500 bp左右(图1b)。对重组质粒进行测序,发现插入片段的序列与NtbHLH93基因的编码序列一致。
2.2 农杆菌侵染结果
由图2可知,本氏烟草在注入pTRV2(阴性对照)农杆菌10 d后,其表型和空白对照(Con)没有明显差异。而注入pTRV2-PDS(阳性对照)农杆菌10 d后,新长出的叶片出现明显的白化症状,表明PDS基因被沉默,同时也表明农杆菌的侵染效率较高。pTRV2-NtbHLH93农杆菌侵染烟草后,烟株也出现明显的白化症状,说明NtbHLH93基因可能影响烟株中叶绿素的合成。

M1.Marker 2000 1,2.PCR扩增产物 M2.Marker 10 000 3,4.pTRV2-NtbHLH93重组载体双酶切产物 a.NtbHLH93基因的PCR电泳图 b.pTRV2-NtbHLH93重组载体双酶切的PCR电泳图

图2 农杆菌侵染本氏烟草10 d后的烟株表型Fig.2 Phenotype of tobacco seedlings on the 10th day after infection by Agrobacterium tumefaciens
2.3 农杆菌侵染后NtbHLH93基因的表达
接种两周后,选取6株被pTRV2-NtbHLH93农杆菌侵染烟草的上部叶用于检测NtbHLH93基因的表达。由图3可知,在空白对照(Con)和注射pTRV2空载体的烟株中,NtbHLH93基因的表达差异不显著。但是在注射pTRV2-NtbHLH93载体的烟株(R1~R6)中,NtbHLH93基因的表达量明显下降,与对照(Con)相比表达量平均降低46.3%。
2.4 NtbHLH93基因对甾醇含量的影响
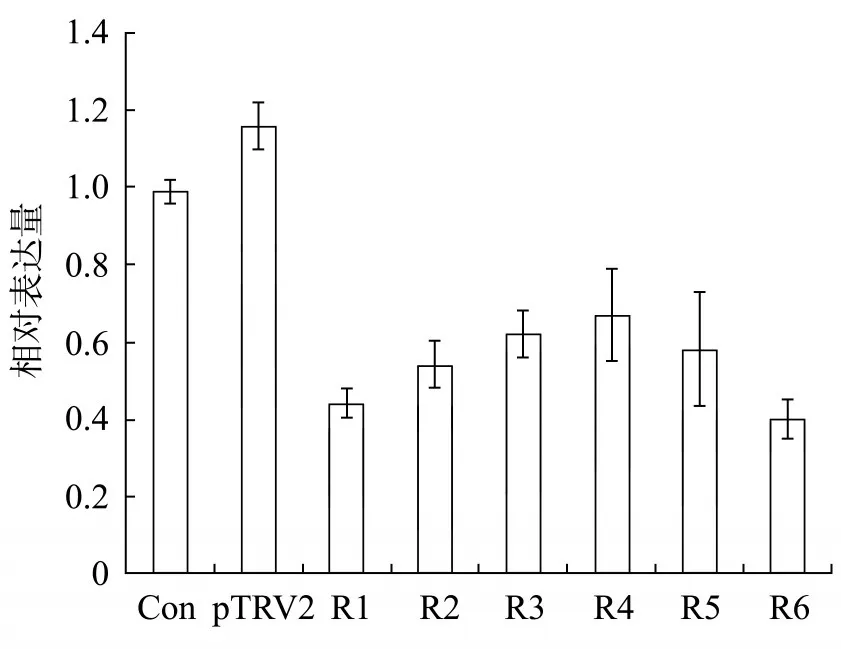
图3NtbHLH93基因的qPCR检测结果Fig.3 qPCR result of NtbHLH93

表1 甾醇含量的测定①Tab.1 Determination of sterol content (μg·g-1)
测定了对照(Con)及注射pTRV2-NtbHLH93烟株(R4株系)中的总甾醇、豆甾醇、菜籽甾醇、菜油甾醇、β-谷甾醇及羊毛甾醇含量(表1),发现注射pTRV2-NtbHLH93烟株中的总甾醇、豆甾醇、胆固醇和β-谷甾醇含量明显下降。与对照(Con)相比,分别降低17.97%、21.48%、14.02%和9.09%。其他种类甾醇的含量没有明显变化。
2.5 NtbHLH93基因对烟草叶绿素合成的影响
下调NtbHLH93基因后,烟叶出现了明显的白化症状。转录组测序结果(表2)表明,在265个差异表达的基因中,有44个与叶绿素合成相关的基因下调表达:①与捕光色素蛋白复合体相关的基因有25个,其中,与捕光色素蛋白复合体Ⅰ相关的基因有9个,与捕光色素蛋白复合体Ⅱ相关的基因有16个;②与光合系统相关的基因有19个,其中,与光合系统Ⅰ相关的基因有11个,与光合系统Ⅱ相关的基因有8个。以上结果表明NtbHLH93基因不仅影响甾醇类物质的合成,还影响叶绿素的合成。
2.6GO分析
分析对照和NtbHLH93基因表达量下调烟株的转录组数据,发现一些与生物学过程、分子功能、细胞组分相关的差异表达基因。其中,与生物学过程相关的基因最多,分子功能次之,细胞组分最少(图4)。生物学过程中,与代谢过程及细胞过程相关的基因最多,分别占生物学过程总基因数量的62.5%和54.4%。分子功能中,与催化、结合及结构分子相关的基因最多,分别占分子功能总基因数量的22.4%、23.6%和21.2%。细胞过程中,与细胞、细胞组分、大分子复合物相关的基因最多,分别占细胞过程总基因数量的49.4%、49.4%和24.3%。
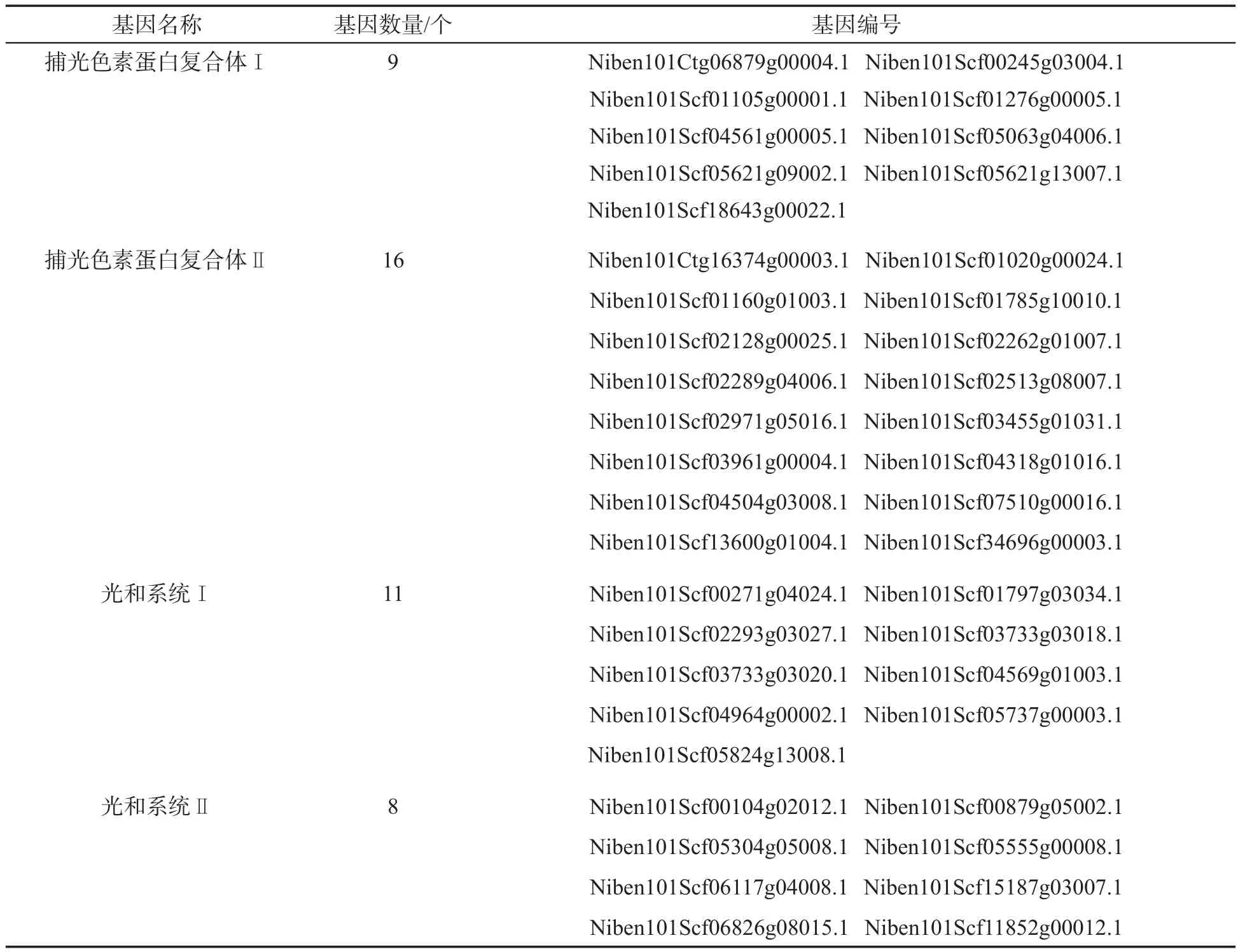
表2 pTRV2-NtbHLH93烟株中与叶绿素合成相关的差异表达基因Tab.2 Differentially expressed genes related to chlorophyll synthesis in pTRV2-NtbHLH93 tobacco seedlings

图4 差异表达基因的GO分析Fig.4 GO analysis of differentially expressed genes
2.7KEGG代谢通路分析
通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库来分析转录组数据中差异表达的基因,发现了一些基因参与萜类化合物的生物合成。在MEP(2-C-Methyl-D-Erythritol-4-Phosphate,2-C-甲基-D-赤藓糖-4-磷酸)代谢中,有2个基因(Niben101Scf00063g13014.1和Niben101Scf06249g03002.1)在NtbHLH93沉默植株(R4株系)中分别上调了2.67和2.95倍。进一步通过qPCR验证,发现与Con对照相比,这两个基因分别上升了3.81和4.23倍(图5)。Niben101Scf00063g13014.1和Niben101S cf06249g03002.1与GGPPS基因的序列高度相似,推测当甾醇合成通路受阻时,MEP代谢通路中的GGPPS基因表达上调。

图5 NtbHLH93下调对Niben101Scf00063g13014.1和Niben101Scf06249g03002.1表达的影响Fig.5 Effects of downregulated NtbHLH93 on Niben101Scf00063g13014.1 and Niben101Scf06249g03002.1 expressions
3 讨论
甾醇是卷烟烟气PAHs的主要前体物[9,11,15]。Feldman[10]发现拟南芥转录因子 bHLH93与甾醇及异戊二烯类物质的合成有关,与野生型相比,拟南芥bhlh93突变体中甾醇类物质含量显著下降。本研究中,利用VIGS技术下调烟草中NtbHLH93基因的表达后发现,总甾醇、豆甾醇、胆固醇和β-谷甾醇的含量显著降低。在植物质体中,萜类物质的合成通过MEP代谢途径完成,而GGPPS基因是MEP代谢途径中的关键基因。由GGPPS催化合成的牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl diphosphate,GGPP)与甾醇合成途径共用两个前体物:异戊烯基二磷酸(Isopentenyldiphosphate,IPP)和二甲烯丙基二磷酸(Dimethylallyldiphosphate,DMAPP)[22]。本研究中,通过转录组分析发现在pTRV2-NtbHLH93烟株中,参与MEP代谢途径的Niben101Scf00063g13014.1和Niben101Scf06249g030 02.1表达量明显升高,这两个基因与GGPPS基因序列高度相似,推测GGPPS基因表达量的上升可能与bHLH93基因被抑制有关。此外,NtbHLH93基因表达下调后,烟草叶片发生了明显的白化。在拟南芥中过表达bHLH93基因后,植株叶片显著变绿,表明该基因还能影响叶绿素的生物合成[9]。
4 结论
①利用VIGS技术将烟草中已克隆到的NtbHL H93基因进行沉默,发现pTRV2-NtbHLH93烟株中NtbHLH93基因的表达量与对照植株相比平均降低了46.3%。②对pTRV2-NtbHLH93烟株中的甾醇含量进行测定,发现总甾醇、豆甾醇、胆固醇和β-谷甾醇的含量显著降低,分别降低了17.97%、21.48%、14.02%和9.09%。③转录组分析发现在pTRV2-NtbHLH93烟株中,参与MEP代谢途径的Niben101Scf00063g13014.1和Niben101Scf06249g0300 2.1表达量明显升高,分别升高了2.67和2.95倍。

