单中心1336例经导管封堵卵圆孔未闭患者主要并发症回顾性分析
何璐 张玉顺
经导管封堵卵圆孔未闭(patent foramen ovale,PFO)技术随着先天性心脏病介入治疗的发展而成熟。我国经导管封堵PFO的开展始于21世纪初,而随着人们对PFO认识的不断深入、介入器材的不断改进、介入医师经验的不断积累以及介入技术的逐步提高,经导管封堵PFO的数量和质量在2012年后有了大幅度提升[1]。2018年7月,发表于英国医学杂志的PFO临床实践指南也为经导管封堵PFO技术提供了有力的循证医学证据[2]。而新英格兰医学杂志上三大随机对照试验(randomized controlled trial,RCT)结果的公布也进一步证实了经导管封堵PFO的安全性[3-5]。目前我国尚缺乏经导管封堵PFO并发症的大数据分析。本研究收集了西安交通大学第一附属医院结构性心脏病中心1336例经导管封堵PFO患者术中及术后发生的并发症,总结经验如下。
1 对象与方法
1. 1 研究对象
回顾性分析2012年1月至2016年12月在本院门诊和(或)住院患者行经胸超声心动图(transthoracic echocardiography,TTE)和(或)经食管超声心动图(transesophageal echocardiography,TEE)确诊为PFO,行TTE声学造影(contrast transthoracic echocardiography,cTTE)检查确诊为大量右向左分流(right-to-left shunt,RLS)患者共4386例。结合临床症状、影像学检查、患者意愿等,共1467例PFO合并大量RLS患者入住本院结构性心脏病中心,拟行经导管封堵PFO。所有患者或其亲属术前均签署手术知情同意书。
纳入标准:(1)隐源性卒中(cryptogenic stroke,CS)或短暂性脑缺血发作(transient ischemic attack,TIA)合并PFO,有大量RLS;或给予抗血小板/抗凝治疗仍有复发;或有明确下肢深静脉血栓;(2)药物治疗无效的偏头痛合并PFO,有大量RLS;(3)PFO合并静脉血栓或下肢静脉曲张或瓣膜功能不全,有大量RLS;(4)斜卧呼吸-直立性低氧血症伴PFO,有大量RLS;(5)PFO伴颅外动脉栓塞,有大量RLS;(6)临床难以解释的缺氧合并PFO,有大量RLS;(7)PFO合并房间隔膨出瘤(atrial septal aneurysm,ASA)或间隔活动度过大、大PFO、PFO合并静息RLS。排除标准:(1)可以找到任何原因的脑栓塞;(2)有抗血小板/抗凝治疗禁忌;(3)下腔静脉或盆腔静脉血栓形成导致完全梗阻,全身或局部感染、败血症、心腔内血栓形成;(4)妊娠;(5)合并肺动脉高压或PFO为特殊通道;(6)急性卒中2周以内;(7)术前心电图(electrocardiogram,ECG)和24~72 h动态心电图(Holter)检查为心房颤动;(8)颈部血管超声检查为严重颈动脉狭窄;(9)当cTTE不能区分RLS来源时,计算机断层扫描肺血管造影(computed tomographic pulmonary angiography,CTPA)检查为肺动静脉瘘(pulmonary arteriovenous fistula,PAVF)。最终有131例患者被排除在外,共1336例患者入选本研究。
1. 2 超声心动图及右心声学造影
采用GE-ViVid-E9型彩色多普勒超声显像仪(美国通用电气公司),TTE探头频率为2~4 MHz,TEE探头频率为4~7 MHz。所有患者术前均先行常规TTE检查,其中360例(26.9%)因肥胖、肺气过多等因素TTE显示不清者行TEE检查。术中及术后3、6、12、24个月随访时均使用TTE,观察封堵器形态、位置是否良好,有无心包积液,封堵器有无影响心脏瓣膜功能等。若12~24个月随访时cTTE检查发现大量残余右向左分流(residual right-to-left shunt,rRLS),则行TEE检查。
cTTE检测RLS,常选择经肘静脉入径“弹丸式”注射激活盐水,选择心尖四腔切面,观察静息状态下右心显影后及Valsalva动作停止后左心内有无微气泡显影及显影的量[6]。RLS半定量分级标准根据单帧图像左心微泡的数量将其划分为4级:0级(无RLS),即未见微泡进入左心房;Ⅰ级(少量RLS),即左心房内可见1~10个微泡/帧;Ⅱ级(中量RLS),即左心房内可见11~30个微泡/帧;Ⅲ级(大量RLS),即左心房内可见>30个微泡/帧,或左心房几乎充满微泡并导致透声情况明显减低[7]。显影时间在右心显影后3~5个心动周期内,RLS多考虑来源于PFO,超过5个心动周期多考虑为肺动静脉通路。术前大量RLS为经导管封堵PFO的适应证。术后3、6、12、24个月复查cTTE随访观察rRLS,若某个随访时间节点无rRLS,则后续无须再进行cTTE检查。
1. 3 经导管封堵PFO
所有患者术中进行ECG及压力、血氧饱和度监测,在2%利多卡因局部麻醉下穿刺股静脉入径,在X线透视指引下,由具有多年先天性心脏病介入治疗经验的成熟术者严格按照《卵圆孔未闭预防性封堵术中国专家共识》[8]完成手术操作。所用封堵器为PFO专用封堵器或房间隔缺损(atrial septal defect,ASD)封堵器,由美国AGA公司、北京华医圣杰科技有限公司及上海形状记忆合金材料有限公司提供。术后所有患者均接受低分子肝素10 U/(kg · h)、每日2次皮下注射共48 h,阿司匹林100 mg、每日1次口服维持6个月,氯吡格雷50~75 mg、每日1次口服维持3个月。
1. 4 观察指标
将遗留严重功能障碍及需要经介入或外科手术处理的并发症定义为主要并发症,包括死亡、心脏压塞、主动脉-右心房瘘、需要输血的大出血和致命性肺栓塞。将其余并发症定义为次要并发症,包括不需要输血的出血、封堵器栓塞后经导管成功回收、短暂性心房颤动、冠状动脉气栓、中-大量rRLS和血管通路并发症[9]。
1. 5 术后随访
随访时间为术后3、6、12、24个月,采用门诊和(或)病房复查、当地医院检查资料邮寄、电话、传真或发送电子邮件等方式。心律失常经ECG和(或)Holter确定,心包积液、急性心脏压塞及主动脉-右心房瘘经TTE和(或)手术证实,血管通路并发症(假性动脉瘤、血肿及股动静脉瘘)经血管超声证实,术后中-大量rRLS由cTTE证实。
1. 6 统计学分析
2 结果
2. 1 所有患者基线特征
1336例患者中,男性731例(54.7%),女性605例(45.3%),年龄9~65(45.7±13.5)岁,有125例(9.4%)患者年龄>60岁。病种分布上,CS和TIA患者共726例(54.3%)、药物治疗无效的偏头痛共528例(39.5%)、其他病种82例[6.1%,包括斜卧呼吸-直立性低氧血症2例(0.1%)、正常冠状动脉心肌梗死2例(0.1%)、肢体动脉栓塞2例(0.1%)、睡眠呼吸暂停综合征5例(0.4%)、癫痫6例(0.4%)、合并其他先天性心脏病12例(0.9%)、原因不明头晕/晕厥41例(3.1%)、单纯体检发现PFO 12例(0.9%),表1]。

表1 1336例患者病种分布[例(%)]
2. 2 手术结果
共1320例患者手术成功,手术成功率98.8%。未成功的16例患者均为术中导管、导丝反复尝试通过PFO处未成功。此1320例患者平均手术时间为(24.7±6.8)min,平均放射时间为(3.4±0.9)min。术后再次评估,发现除了细小PFO外,多数经CTPA证实为合并小的PAVF。封堵器类型上,1302例(98.6%)患者置入PFO封堵器,其中18/18 mm有26例(2.0%)、18/25 mm有973例(73.7%)、30/30 mm有159例(12.0%)、25/35 mm有144例(10.9%);18例(1.4%)患者置入ASD封堵器,其中12 mm有3例(0.2%)、14 mm有7例(0.5%)、16 mm有6例(0.5%)、18 mm有2例(0.2%,表2)。
2. 3 并发症及随访
主要并发症发生率为0.1%(2/1336),其中1例于术中、另1例于术后2 h发生心脏压塞,均经心包穿刺后缓解。次要并发症发生率为1.3%(18/1336),其中短暂性心房颤动2例(0.1%),有1例发生于术后2周,患者自行恢复窦性心律,另1例发生于术后3个月,经胺碘酮治疗后转复为窦性心律。血管通路并发症7例(0.5%),包括股动静脉瘘3例(0.2%)、假性动脉瘤4例(0.3%)。术中ECG提示冠状动脉气栓9例(0.7%)。术后共498例(37.3%)患者完成了24个月的随访,其中有24例(4.8%,24/498)患者发现中-大量rRLS。

表2 1320例封堵成功患者封堵器类型及型号[例(%)]
3 讨论
经导管封堵PFO成功率高、创伤小、术后恢复快,已成为有适应证患者的首选治疗方法。加强对经导管封堵PFO并发症的早期识别和处理,具有重要的临床意义。
3. 1 心脏损伤和穿孔
有文献报道,心脏穿孔的发生率为0.5%~1%[10],常因跨房间隔的导丝固定于左心耳处而发生左心耳穿孔[11]。其他部位穿孔较少见,包括右心室、右心房和肺静脉[12]。本研究患者发生2例(0.1%)心脏压塞,1例发生于术中,1例发生于术后2 h,均经心包穿刺后缓解。这2例患者手术操作时间均较长,术中导管、导丝反复通过PFO处,可能为导管、导丝造成的右心房壁损伤。结合这2例患者术前cTTE结果,均提示Valsalva动作后左心内微气泡密度低,考虑为PFO细小,导管、导丝难以通过PFO处而造成的操作相关性心脏穿孔。因此,术前准确的cTTE和(或)对比增强经颅多普勒超声检查十分必要,必要时可行TEE检查,以明确PFO的大小。单中心经验认为,对于大量RLS者,手术成功率高,手术并发症少。
3. 2 心律失常
经导管封堵PFO术后最常见的心律失常为心房颤动,发生率2%~5%,绝大多数心房颤动发生于术后4周内,另一部分发生于术后6个月内[13-14]。有研究报道,使用不同封堵器术后心房颤动发生率不同,使用STARFlex封堵器,术后心房颤动发生率为5.7%[15];而使用Amplatzer PFO封堵器,心房颤动发生率仅为0.2%[16];使用Helex封堵器,心房颤动发生率为6.6%[4]。Taaffe等[17]对660例患者用3种封堵器的封堵效果进行了RCT,随访30 d,心房颤动发生率分别为Amplatzer封堵器1.4%、Helex封堵器0.9%及STARFlex封堵器5%。封堵PFO术后心房颤动发生机制不清,可能为封堵器对邻近心肌的刺激,加强了其自律性,局部刺激更容易在周围形成激发活动。还有假说认为封堵器作为解剖上的异物导致心房内电活动紊乱[18]。另外,亦有经导管封堵PFO术后新发一度房室传导阻滞的报道,也和术后房性心律失常的风险增加有关[19]。本研究中共2例(0.1%)患者发生短暂性心房颤动,1例于术后2周自行转复为窦性心律,另1例发生于术后3个月,予以胺碘酮治疗后转复为窦性心律。对于经导管封堵PFO的患者,详尽的术前检查十分必要,尽可能排除术前已存在的阵发性/持续性心房颤动患者。因为经导管封堵PFO为预防性手术,合并心房颤动的患者即使封堵PFO,术后仍存在卒中风险。
3. 3 残余分流
经导管封堵PFO术后rRLS可能会导致血栓栓塞事件复发。心房水平分流可发生于封堵器周围或内部。与ASD封堵不同,经导管封堵PFO术后rRLS不能用单纯的TTE或TEE检查,而需cTTE检查。临床上出现新发或原有症状复发,需进行TEE检查来评估有无rRLS或原有rRLS有无加重,以及除外其他引起rRLS的病因。经导管封堵PFO术后多见有少量rRLS,大量rRLS较罕见,术后1年rRLS发生率<3%[20]。rRLS与封堵器种类有关,单中心同一术者应用3种封堵器的RCT显示,经导管封堵PFO术后完全闭合率Amplatzer PFO封堵器最高,CardioSEAL次之,Helex最差[20]。我国仅有Amplatzer PFO封堵器和国产类似封堵器(Cardio-OFix PFO封堵器),其产生rRLS的原因如下:(1)早期rRLS与封堵器特性有关。PFO封堵器与ASD封堵器不同,不通过封堵器腰部直径来支撑缺损,而是将原发隔拉向继发隔,进一步通过内皮化实现封堵。早期内皮化期间往往有rRLS,亦是早期应用PFO封堵器较ASD封堵器封堵rRLS多的原因。(2)大量rRLS与部分患者可能存在未检测出的另一缺损有关。在CLOSUREⅠ研究[21]中就有类似病例报道,术前未发现同时合并小的ASD,术后出现大量rRLS,TEE检查发现合并小的ASD。(3)PFO的结构特征亦与rRLS有关。有研究发现ASA和卵圆窝纵向直径>20.8 mm是术后1年发生rRLS的独立预测因子(OR 7.6,95%CI 1.38~42.35,P=0.02;OR 8.5,95%CI 1.55~46.95,P=0.014)[22]。除了心房水平的rRLS外,如果合并PAVF,封堵术后也可出现少量rRLS。少量的rRLS并无实际临床意义。本研究中,498例患者完成了术后24个月的随访,共24例(4.8%)发现中-大量rRLS,这与文献报道相一致[23]。24例患者均进行了TEE检查,发现8例(33.3%)患者合并小的ASD,术前未进行TEE检查而忽略了ASD的存在(图1);9例(37.5%)患者因继发间隔厚,封堵器和房间隔贴合较差,从而产生了伞中分流(图2);另外7例(29.2%)患者因合并ASA或原发间隔活动度过大,选择了18/25 mm封堵器而产生了封堵器边缘rRLS(图3)。单中心经验认为,为了减少rRLS的发生率,术前详尽的PFO解剖结构评估十分重要。对于有条件的中心,术前100%的TEE普及率,能够提高ASA、房间隔活动度大、继发隔肥厚、长隧道型PFO的检出率,个体化选择封堵器,最大程度地减少rRLS发生率。
图1 TEE提示封堵器后缘存在小的ASD

图2 TEE提示伞中分流(黄色箭头)
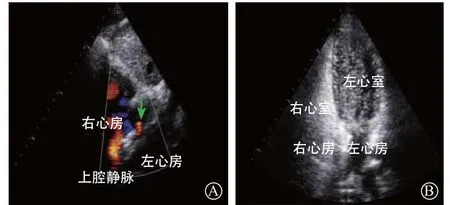
图3 经导管封堵PFO术后1年 A. TEE提示封堵器下方可见细小分流束;B. cTTE提示大量RLS
3. 4 其他并发症
本研究中发生9例冠状动脉气栓,发生原因为鞘管输送封堵器过程中排气不彻底,使气体进入左心房、左心室、主动脉。而右冠状动脉开口位置正好在主动脉根部的右前方,空气很易进入,致右冠状动脉气栓,从而引起急性心肌缺血症状。因此,封堵器输送过程中彻底排空鞘管和封堵器中气体十分必要。
另外,1336例患者中,发生血管通路并发症7例(0.5%),包括股动静脉瘘3例(0.2%)、假性动脉瘤4例(0.3%)。与患者穿刺点过低或股动脉与股静脉走行异常、拔除鞘管时压迫不当有关。经导管封堵PFO一般使用直径7~10 F的输送鞘,鞘管退出后压迫不当容易出现血管通路并发症。手术操作中从股静脉退出穿刺鞘管时若有鲜红色血液喷出,切忌插入扩张鞘或输送鞘。另外,掌握股动静脉的解剖结构、熟练的操作医师、小心穿刺等都可降低血管通路并发症的发生率。
有文献报道,对超过28 000例患者的Meta分析表明,与ASD封堵器相比,PFO封堵器有着更高的血栓形成率,为2.5%~13.3%,通常在术后6个月内随访时发现,大部分于术后1个月内发现[24]。本研究中,随访最长24个月未发现封堵器上血栓形成,可能与术后未进行TEE检查有关。单中心经验认为,选择封堵器避免过大化、封堵术后加强抗凝和抗血小板治疗,可最大程度降低封堵器上血栓形成的概率。
综上所述,经导管封堵PFO操作简便,术中及术后并发症发生率较低,尤其是严重并发症发生率极低,可以安全应用于临床。术前严格筛选患者和规范手术操作可进一步提高手术成功率和降低并发症发生率。

