小鼠骨骼肌挫伤修复过程中周细胞数量变化及其与损伤时间相关性
温书恒 ,田志岭 ,张淼 ,张孟周 ,王帅 ,陈京伟 ,孙英富 ,王昌亮 ,4,赵锐 ,官大威
(1.中国医科大学法医学院 法医司法鉴定中心,辽宁 沈阳 110013;2.辽宁省智慧检务创新研究院 智慧司法鉴定联合实验室,辽宁 沈阳 110122;3.司法鉴定科学研究院 上海市法医学重点实验室 上海司法鉴定专业技术服务平台,上海 200063;4.辽宁省人民检察院,辽宁 沈阳 110033)
在日常生活中,骨骼肌损伤的发生率较高。在法医学、运动医学等领域中对骨骼肌损伤愈合的研究有一定的科研价值。在法医学实际应用中,对损伤时间的推断一直是法医学鉴定中需要解决的重要问题之一[1-2]。精确推断损伤时间或缩小推测时间的范围,可以对案件发生的时间、嫌疑人的确认或排除提供重要的参考依据。因此更好地了解和掌握骨骼肌损伤愈合的一般过程,可以为法医学损伤时间推断提供参考依据。
研究结果[3]表明,骨骼肌损伤修复是一个受多因素调节的炎症性组织愈合过程,可分为急性期、修复期和组织塑形期,全过程包括损伤肌纤维的坏死,炎症细胞的募集,生肌细胞的激活、分化并融合为新的肌纤维,以及肌成纤维细胞形成纤维组织瘢痕[4-5]。目前,已知骨骼肌中有多种细胞具有肌源性潜能,其中卫星细胞以往被认为是骨骼肌修复再生过程中最重要的细胞[6-7],近年来,研究的注意力投向了在婴幼儿骨骼肌生长过程中不可或缺的周细胞[8-10]。
在骨骼肌中,周细胞参与构成卫星细胞的“鞘”结构,不仅促进其肌源性分化,还参与诱导卫星细胞的静息状态[11-12]。骨骼肌周细胞具有异质性,尚无单一特异的标记物,公认的是神经元胶原抗原2(neuron-glial antigen2,NG2)和血小板源性生长因子受体β(plateletderived growth factor receptor beta,PDGFRβ)[13-16],NG2和PDGFRβ双阳性的细胞被认为是周细胞,并可以将周细胞分为1型(nestin-GFP-/NG2/PDGFRβ阳性)和2型(nestin-GFP+/NG2/PDGFRβ阳性)两个主要亚型[17-18]。在骨骼肌损伤和疾病中,周细胞可以自发地与成肌细胞融合形成肌管,有助于骨骼肌再生[19]。此外,文献报道在骨骼肌损伤后,肌纤维基底膜下部分移植的周细胞可表达卫星细胞标记物配对盒转录因子(paired-box transcription factor,Pax7)蛋白[10],这一现象与骨骼肌周细胞可以生成卫星细胞的假设相印证[20]。目前,周细胞在肌肉组织损伤后是否具有时间规律性的表达尚不明确。
本课题组持续关注如2型大麻素受体(cannabinoid receptor type 2,CB2R)[21]、肌钙蛋白Ⅰ(troponinⅠ)[22]、α7尼古丁乙酰胆碱受体(α7-nicotine acetylcholine receptor)[23]、Pax7及生肌决定因子(myoblast determination,MyoD)1[24]、同源域相互作用蛋白激酶2(homeodomain interacting protein kinase 2,HIPK2)[25]等指标在皮肤和骨骼肌损伤时间推断中的应用。本研究拟应用双重及三重免疫荧光染色等方法,研究在小鼠骨骼肌挫伤后周细胞的时间规律性表达,并初步探讨其可能的作用,以期为法医学的肌肉损伤时间推断提供一个新的参考指标,同时为肌肉损伤愈合的治疗提供新的思路。
1 材料与方法
1.1 动物模型制作及分组
动物模型的建立与操作遵照“中国医科大学实验室动物管理办法”的标准,并经中国医科大学实验动物福利与伦理委员会(Institutional Animal Care and Use Committee,IACUC)审查通过。根据本课题组前期小鼠骨骼肌挫伤模型建立方法[25],取雄性C57B6/L小鼠40只,周龄8~10周,体质量18.1~24.1g。经腹腔注射戊巴比妥钠(350mg/kg)麻醉后,将小鼠右后肢置于伸膝、踝背屈90°位置,将质量80 g的不锈钢小球(直径12mm)在高45cm处通过内径14mm的管道自由垂直落于打击器上,打击处于静止状态的小鼠右后小腿腓肠肌中部,打击器的打击面积为28.26 mm2。挫伤后,各鼠分笼饲养,保持12h昼夜循环交替环境,垫料清洁及空气通畅。
小鼠于挫伤后1、3、5、7、9、14、28d(各时间段5只小鼠)腹腔注射致死量的戊巴比妥钠(350 mg/kg)。5只对照组小鼠经腹腔注射致死量的戊巴比妥钠(350mg/kg)。取小鼠右后肢腓肠肌用于组织病理学观察。解剖证实骨骼肌损伤率达100%,且未见胫、腓骨骨折。
1.2 苏木素-伊红染色
取常规石蜡切片经二甲苯脱蜡后,梯度乙醇水化。由苏木素-伊红(hematoxylin-eosin,HE)染色后经梯度乙醇脱水、二甲苯透明,中性树胶封片后在Olympus cellSens Entry 1.18显微成像系统(日本Olympus公司)中观察染色结果。
1.3 免疫荧光染色
1.3.1 NG2/PDGFRβ双重免疫荧光染色
小鼠骨骼肌样本经4%多聚甲醛和磷酸盐缓冲液(pH=7.4,phosphate buffer saline,PBS)固定后,进行石蜡包埋,制作3μm厚组织病理学切片,通过NG2和PDGFRβ双重免疫荧光染色进行周细胞鉴定和定位检测。组织病理学切片经脱蜡、柠檬酸热修复后,用5%驴正常非免疫血清(中国Solarbio Life Science公司)封闭。其后将切片与小鼠源性NG2单克隆抗体(MAB5384,德国Merck公司)和山羊源性PDGFRβ多克隆抗体[GT15065,安诺伦(北京)生物科技有限公司]经抗体稀释液(TA-125-ADQ,美国Thermo Fisher Scientific公司)稀释(体积稀释浓度均为1∶200)后,在4℃孵育过夜。Alexa Fluor®488驴抗小鼠IgG(1∶200,A-21202,美国Thermo Fisher Scientific公司)和Alexa Fluor®594驴抗山羊IgG(A-11055,美国Thermo Fisher Scientific公司)经抗体稀释液稀释后(体积稀释浓度均为1∶200)于室温与切片孵育2h。应用4’,6-二脒基-2-苯基吲哚[4’,6-diamidino-2-phenylindole,DAPI]染色液进行细胞核染色。切片经防荧光淬灭封片剂封片,并通过荧光显微镜观察染色结果。切片以PBS代替一抗作为阴性对照,未见非特异染色。
1.3.2 NG2/PDGFRβ/Pax7和 NG2/PDGFRβ/MyoD1三重免疫荧光染色
为明确骨骼肌周细胞与卫星细胞的关系,分别选取卫星细胞处于静息状态和激活状态的挫伤后1 d、挫伤后3d组的组织病理学切片,通过NG2、PDGFRβ、Pax7或NG2、PDGFRβ、MyoD1三重免疫荧光染色进行周细胞与静息或激活状态卫星细胞的共定位检测。组织病理学切片经脱蜡、柠檬酸热修复后,用5%驴正常非免疫血清封闭。其后小鼠源性NG2单克隆抗体、山羊源性PDGFRβ多克隆抗体和兔源性Pax7多克隆抗体(1∶200,ab187339,英国Abcam公司)或兔源性MyoD1多克隆抗体(1∶200,ab64159,英国Abcam公司)经抗体稀释液稀释后与切片在4℃孵育过夜。然后,Alexa Fluor®488驴抗小鼠IgG(A-21202,美国Thermo Fisher Scientific公司)、Alexa Fluor®594驴抗山羊IgG和Alexa Fluor®647驴抗兔IgG经抗体稀释液稀释(1∶200)后于室温与切片孵育2 h。应用DAPI进行细胞核染色。切片经防荧光淬灭封片剂封片,并通过荧光显微镜观察染色结果。切片以PBS代替一抗作为阴性对照,未见非特异染色。
1.4 形态学测量分析及统计学分析
在DMi8激光扫描共聚焦显微镜(德国Leica公司)×400倍镜下,每张切片分别于挫伤中心区及周边区各随机选择10个视野,进行阳性细胞计数。挫伤周边区限定为挫伤中心区边界至其外200 μm范围内。对每个镜下视野中的NG2/PDGFRβ阳性、NG2/PDGFRβ/Pax7阳性和NG2/PDGFRβMyoD1阳性细胞进行计数,10个随机选择视野的阳性细胞数取平均值以评估各挫伤样本。应用Image-Pro Plus 6.0软件进行形态学观察和分析。
通过GraphPad Prism 6软件,应用比例检验(ratio)对数据进行统计学分析。应用独立样本单因子变异数分析(one-way ANOVA)对细胞数组间数据进行分析,应用Fisher精确检验对各组间细胞数比例进行统计学分析。检验水准α=0.05。
2 结 果
2.1 HE染色
小鼠骨骼肌挫伤后,挫伤区内可见组织出血、肌纤维水肿以及坏死等改变(图1)。挫伤后1d,挫伤区内可见大量分叶核细胞。圆形的单个核细胞在挫伤后1d出现,并在挫伤后3d数量增加。挫伤后3d,纺锤状的成纤维样细胞出现在挫伤区内。挫伤后5~9 d,挫伤区内可见大量多核新生肌管以及成纤维样细胞。挫伤后14 d和28 d,新生肌管的核逐渐边聚、数量逐渐减少,挫伤区内仍可见少量成纤维样细胞并伴随胶原纤维沉积。
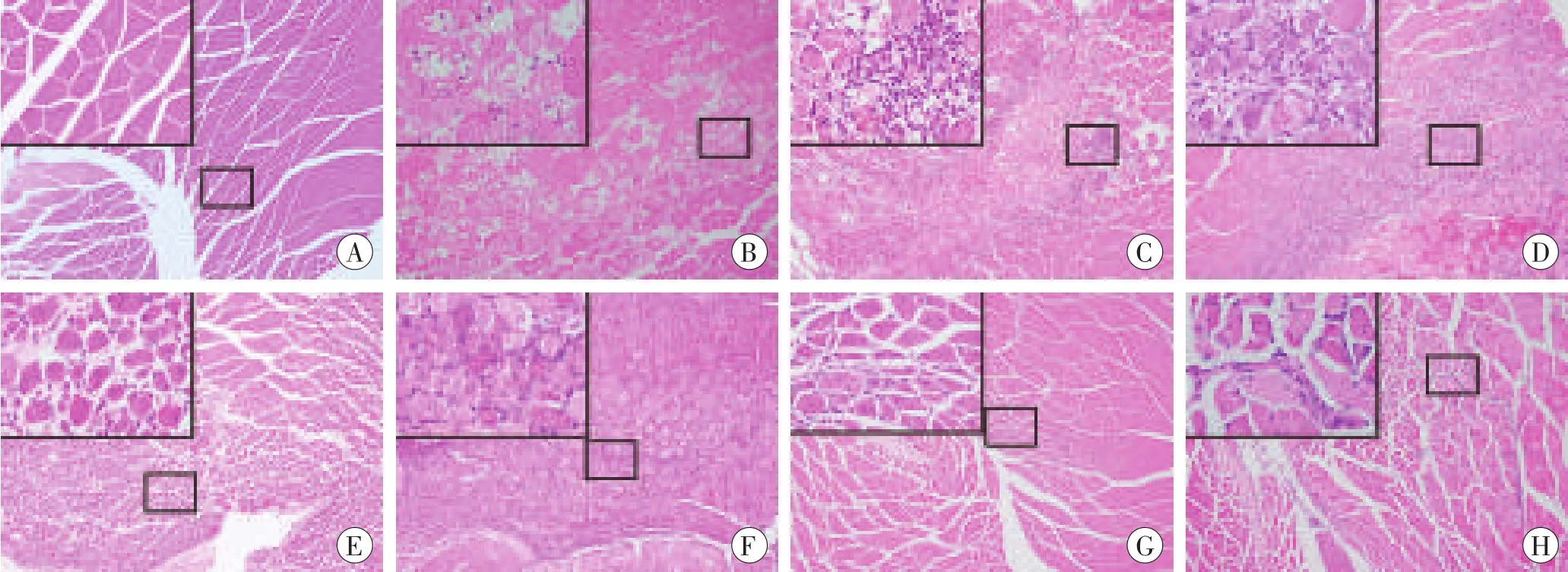
图1 小鼠骨骼肌挫伤后组织病理学改变(HE×100)
2.2 NG2/PDGFRβ双重免疫荧光染色
为检测周细胞在挫伤后不同时间的状态和数量变化情况,应用周细胞标记物NG2和PDGFRβ进行双重免疫荧光染色定位周细胞(图2)。形态学上,与正常骨骼肌中细长形态的周细胞相比,挫伤后1d开始,挫伤区NG2/PDGFRβ阳性细胞体积增大、形态变圆,细胞核呈圆形,其中挫伤周边区和中心区分别于挫伤后14 d和28 d可见恢复至正常细长形态的NG2/PDGFRβ阳性细胞。此外,挫伤后5~14d,挫伤中心区可见大量NG2/PDGFRβ阳性的新生肌管(图2A)。

图2 小鼠骨骼肌挫伤后NG2/PDGFRβ双重免疫荧光染色
经分析检验,挫伤中心区、周边区与全挫伤区的NG2/PDGFRβ阳性细胞数量及NG2/PDGFRβ阳性细胞与总细胞数的比例在挫伤后各时间段均呈单峰分布(表1)。NG2/PDGFRβ阳性细胞数量在挫伤中心区于挫伤后5 d达到峰值(P<0.05),挫伤周边区于挫伤后5d和7d达到峰值(P<0.05),全挫伤区于5、7、9d达到峰值(P<0.05)。挫伤后28 d,挫伤中心区、周边区及全挫伤区的NG2/PDGFRβ阳性细胞数量均仍高于对照组(P<0.05)。NG2/PDGFRβ阳性细胞与总细胞数的比例在挫伤中心区于挫伤后5、7d达峰值(P<0.05),挫伤周边区于挫伤后7 d达到峰值(P<0.05),全挫伤区于5、7、9d达到峰值(P<0.05)。挫伤后28d,挫伤中心区、周边区及全挫伤区NG2/PDGFRβ阳性细胞与总细胞数的比例与对照组相比差异均仍具有统计学意义(P<0.05)。
2.3 NG2/PDGFRβ/Pax7和NG2/PDGFRβ/MyoD1三重免疫荧光染色
挫伤后1 d,挫伤区可见大量NG2/PDGFRβ/Pax7阳性细胞,并可见少量NG2/PDGFRβ/MyoD1阳性细胞(图3);挫伤后3d,挫伤区可见大量NG2/PDGFRβ/MyoD1阳性细胞,并可见少量NG2/PDGFRβ/Pax7阳性细胞(图4)。

表1 小鼠骨骼肌挫伤后各时间段NG2/PDGFRβ阳性细胞数及阳性细胞比例
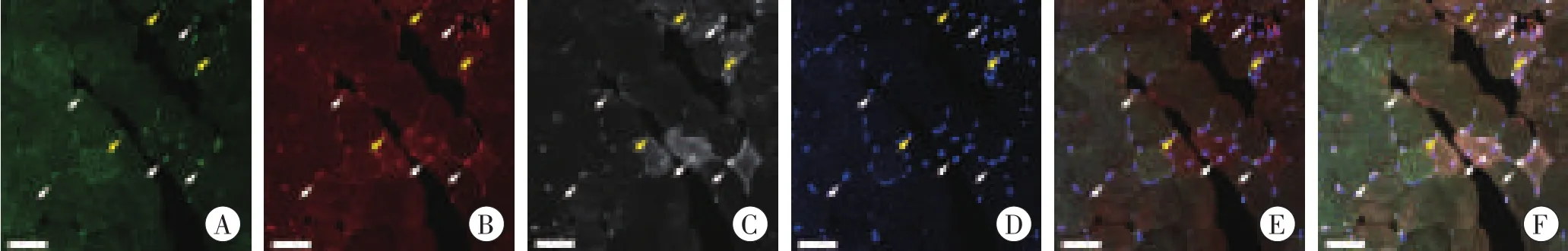
图3 挫伤后1d NG2/PDGFRβ/Pax7三重免疫荧光染色结果

图4 挫伤后3d NG2/PDGFRβ/MyoD1三重免疫荧光染色结果
3 讨 论
卫星细胞被普遍认为在骨骼肌再生中起主要作用[7]。已有研究[26]表明,肌肉损伤后处于静息状态的卫星细胞会被激活、增殖并向损伤区域迁移,最终与损伤的肌纤维相融合形成新生肌管,从而参与肌肉修复再生过程。骨骼肌周细胞更多被认为是卫星细胞或其他生肌细胞的前体细胞[20]。而近年来的研究[15,18]逐渐揭示了周细胞在肌组织损伤后也会参与骨骼肌修复再生,并同时参与组织塑形期的胶原生成和纤维组织沉积过程。有研究[20]发现,在骨骼肌损伤后,肌纤维基底膜下小部分移植入体内的周细胞表达卫星细胞标记物Pax7,提示损伤后部分骨骼肌周细胞可能会发挥卫星细胞的功能。体外实验[9-10]证实,骨骼肌周细胞在细胞培养中可形成肌管,生成肌纤维;在体实验中,移植入体内损伤区域的周细胞可以增殖生成肌纤维而参与肌肉修复再生过程。从本研究得到的挫伤后骨骼肌周细胞的表达情况来看,挫伤后1d,部分周细胞表达静息状态卫星细胞标记物Pax7,挫伤后3d也有部分周细胞表达激活状态卫星细胞标记物组织病理学切片,与周细胞在骨骼肌损伤后可以发挥卫星细胞功能的研究发现相互印证,并进一步提示周细胞的作用可能还包含了募集和激活卫星细胞并参与骨骼肌再生和修复的过程。而挫伤后5d可观察到有表达周细胞标记物的新生肌管,这与前述骨骼肌周细胞可以生成肌管的发现相一致,提示了周细胞在肌肉再生过程中除起到前体细胞的辅助作用之外,可能还参与生肌作用。本研究还发现,挫伤中心区和挫伤周边区的周细胞数量和周细胞与所有细胞的比例在骨骼肌损伤后的急性期、修复期和组织塑形期过程中均有明显增加,提示在骨骼肌损伤修复的全过程中,周细胞均参与并发挥作用。此外,挫伤中心区在挫伤后28d可见形态恢复至正常细长状的周细胞,而挫伤周边区则在挫伤后14d观察到恢复至正常形态的周细胞,结合挫伤中心区在挫伤后28d仍处于修复期和组织塑形期,而挫伤周边区则在挫伤后14d基本完成了骨骼肌修复再生过程。因此,挫伤中心区与挫伤周边区周细胞形态恢复时间的差异,提示骨骼肌周细胞的形态改变与其参与组织修复过程相关。
在法医学实践中,大多数研究应用较为简便的组织学和免疫组织化学实验进行损伤时间判定[1,27]。本研究采用双重免疫荧光染色共定位法对小鼠骨骼肌挫伤后周细胞表达的时间规律性进行了观察。结合本研究结果,小鼠骨骼肌挫伤中心区、挫伤周边区及全挫伤区的周细胞(NG2/PDGFRβ阳性细胞)数量、周细胞与总细胞数的比例均在挫伤后有时间规律性表达,且在挫伤后特定的时间范围(3~9 d、5~7 d、14~28 d)及时间点(5、7d)存在人体肌肉损伤时间推断的潜在参考意义,有可能在中长期肌肉损伤时间推断中发挥作用。
综上所述,本研究表明小鼠骨骼肌挫伤后,部分周细胞表达卫星细胞标记物,部分新生肌管也表达周细胞标记物,提示周细胞参与骨骼肌损伤后的肌肉修复再生过程。挫伤区周细胞的数量变化具有一定的时间规律性,提示其可能作为肌肉损伤时间推断的一个参考指标。

