地熊蜂非视觉相关beta-arrestin基因的克隆与表达谱分析
唐朋,赵沫涵,杨慧鹏,苏松坤,吴杰*
(1.福建农林大学 蜂学学院,福建 福州 350002;2.中国农业科学院 蜜蜂研究所,北京 100093;3.云南农业大学 动物科学技术学院,云南 昆明 650201)
Arrestins蛋白家族分为2类:视觉蛋白(arrestin1和arrestin4),它几乎完全位于光感受器细胞[1];和非视觉的beta-arrestins1和2(也分别命名为beta-arrestin2和beat-arrestin3),它无处不在[2]。Arrestins可以终止许多不同G蛋白偶联受体传递的信号,抑制受体和配体之间的联系[3]。非视觉beta-arrestin作为胞浆蛋白参与各种各样的信号活动[4],包括质膜受体降解,循环和信号传递,也可以作为支架蛋白,调节多种细胞表面受体的活性,包括G蛋白偶联的受体(GPCRs)[5]。beta-arrestin蛋白和GPCR受体家族共同作用[6],通过自身发出信号,让受体内吞,使G蛋白信号脱敏[7, 8]。Beta-arrestin是GPCRs脱敏不可缺少的受体,在饱和的细胞反应中配体的浓度保持较低[9]。这些蛋白质紧密相关且在物种中的序列高度保守[10]。
已知的脊椎动物arrestins有2类[11]:视觉相关arrestins和非视觉相关arrestins。视觉相关arrestins包括conearrestin和rodarrestin2种,它们几乎都位于光感受器细胞中,Rodarrestin与视紫红质的脱敏作用有关[12]。而非视觉相关的arrestins,包括beta-ARR1和beta-ARR2两种,其在大多数组织中都有表达且可以使GPCRs脱敏[13]。在昆虫中,很早就从蝗虫和烟草夜蛾幼虫的触角中鉴定出了2种beta-arrestin蛋白,这2种beta-arrestin蛋白被认为是昆虫非视觉相关beta-arrestin蛋白的代表[14]。黑腹果蝇arrestins基因研究较早,也比较全面,深入研究果蝇的arrestins基因包括kurtz、beta-arrestin1和phosphoprotein共3个成员[15],其中在果蝇只有一个非视觉的beta-arrestin,编码(kurtz),对果蝇的生存发育和神经方面是不可缺少的,其存在果蝇整个发育阶段[16]。家蚕Bombyxmori作为重要的鳞翅目模式昆虫,在家蚕基因组中共鉴定出了3个基因,包括BmKurtz[17]、BmARR1和BmARR2[18]。目前,在蜜蜂科中还没有做过相关基因类似研究。而熊蜂蜂王相较于其他昆虫有很多不同的地方,蜂王在独居越冬阶段、单王成群阶段以及蜂群衰败阶段生理机能状态会发生几次剧烈变化[18]。因此,我们选取了蜂王不同发育时期及特定组织的样品。本研究克隆了地熊蜂arrestin家族中的1个非视觉相关beta-arrestin基因,鉴定了该基因在地熊蜂不同发育时期及特定组织的表达特征。为进一步探索其在地熊蜂中的功能奠定了基础。
1 材料与方法
1.1 材料与主要试剂
试验熊蜂品种为地熊蜂(Bombusterrestris),由2018年3月至8月中国农业科学院蜜蜂研究所农业部授粉昆虫生物学重点开放实验室饲养,在温度(29±2) ℃、相对湿度60%条件下用白糖和新鲜花粉饲养。取出房前1天蜂王、出房第1天蜂王、交配结束后5天蜂王、越冬3个月后蜂王、越冬5个月后蜂王、产卵第1天蜂王以及饲养3个月蜂王为材料于液氮中迅速冷却后置于-80 ℃超低温冰箱保存备用。
Trizol试剂购自Invitrogen公司,反转录试剂盒购自Promega公司,PMD18-T、Trans-DH5α菌株载体为北京全式金生物技术有限公司产品,引物均由金唯智科技有限公司,测序由上海生工生物技术生物工程有限公司完成,其它试剂均为国产或进口分析纯试剂。
1.2 总RNA提取及cDNA合成
取出所有蜂王的头、卵巢、中肠以及脂肪体经液氮研磨后使用Trizol试剂提取总RNA,1%琼脂糖凝胶电泳检测RNA质量。并按照反转录试剂盒说明书反转录合成cDNA保存于-20 ℃备用。
1.3 地熊蜂beta-arrestin基因编码序列克隆
根据熊蜂基因组数据库预测的beta-arrestin的ORF序列设计引物(表1),以反转录合成的熊蜂为模板扩增目的基因。PCR反应体系(25 μL):Mix12.5 μL;cDNA1 μL;上下游引物(10 μmol·L-1)各1 μL;ddH2O9.5 μL。PCR反应程序:94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共35个循环;最后72 ℃延伸2 min。PCR产物经1%琼脂糖凝胶电泳检测后凝胶回收纯化并连接PMD-18T载体,转化涂板后筛选阳性克隆送测序。

表1 引物信息Table 1 Primers used in this study
1.4 地熊蜂beta-arrestin基因序列的生物信息学分析
利用lasergene软件将进行基因序列拼接获得地熊蜂beta-arrestin基因cDNA全长序列,使用lasergene进行ORF的预测和氨基酸序列的翻译,并预测蛋白质的分子量和等电点等基本性质并分析其保守结构域特征。在NCBI上利用BLAST程序搜索目的基因编码蛋白的同源序列,通过用lasergene软件进行序列比对,并用MEGA6.0软件采用邻接法在1 000次bootstrap检测后构建系统进化树。
1.5 统计分析
荧光定量PCR的试验均重复3次,数值表示平均值±标准差。利用IBM SPSS Statistics 19单因素方差法对beta-arrestin基因在蜂王不同发育阶段及特定组织中的表达进行差异分析(P<0.05)。
2 结果与分析
2.1 地熊蜂beta-arrestin基因的克隆
以Genebank中地熊蜂beta-arrestin基因预测序列为参考,以地熊蜂工蜂cDNA为模板进行PCR扩增。结果如图1所示,泳道1是引物对beta-arrestin-F/beta-arrestin-R的扩增结果,引物设计产物条带为1 600 bp左右,结果与预测的大小一致。对条带进行克隆测序,获得beta-arrestinCDS序列。
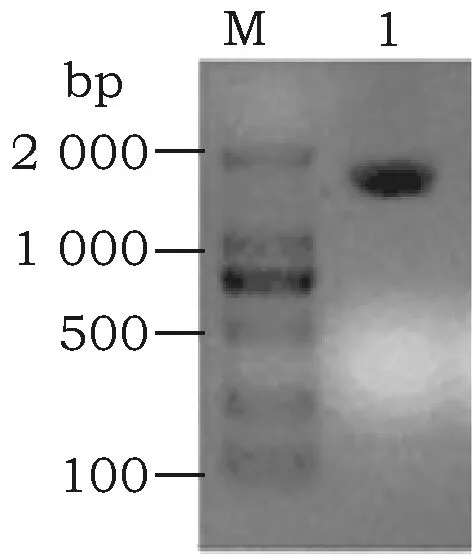
图1 地熊蜂beat-arrestins基因PCR扩增产物Fig.1 PCR amplification products of beta-arrestin of Bombus terrestrisNote: M: D2000 DNA marker,1: beta-arrestin PCR products
2.2 地熊蜂beta-arrestin基因的核苷酸与氨基酸序列分析
通过NCBI数据库对该基因结构分析表明,地熊蜂beta-arrestin基因含有8个外显子,7个内含子,本研究的beta-arrestin基因mRNA全长5 819 bp,利用PCR成功克隆了beta-arrestin基因编码序列,其CDS长1 248 bp(图2);CDS编码一个415 aa的蛋白,分子量大小45.98 kD,等电点为6.51,为酸性氨基酸(表2)。ExPASy ProtParam 在线分析表明,beta-arrestin蛋白分子式为C2053H3281N555O618S11。在组成beta-arrestin蛋白的20种氨基酸中,亮氨酸(Leu)所占比例最高,达9.9%;蛋氨酸(Met)所占比例最低,为1.0%;带正、负电荷的氨基酸总数分别为56和60。总平均亲水性系数、脂溶指数、不稳定系数分别为0.359、89.49、39.55,表明beta-arrestin是一种稳定的脂溶性蛋白。该蛋白氨基酸序列中第27~182个氨基酸残基为Arrestin-Nsuperfamily的保守结构域(E值:1.53e-41);第201~354个氨基酸残基为Arrestin-Csuperfamily的保守结构域(E值:1.07e-35)。二级结构预测结果显示,beta-arrestin编码的蛋白以卷曲环(coil loop)为主,占50.84%,β-折叠(strand)和α-螺旋(helix)所占比例分别为:44.34%和4.82%。beta-arrestin基因编码的氨基酸序列和NCBI中收录的地熊蜂转录组数据的氨基酸序列进行比对,结果表明克隆的地熊蜂beta-arrestin基因编码的氨基酸序列与NCBI中收录的地熊蜂转录组数据的氨基酸序列一致性高达97%,经分析缺失的2个氨基酸不在该基因外显子边界附近,因此这可能是不同基因座上的拷贝,也可能是个体之间单核苷酸多态性导致(图3)。
2.3 同源序列比对与系统进化分析
本研究分别选取了黑腹果蝇Drosophilamelanogaster、家蚕Bombyxmori、意大利蜜蜂Apismellifera、中华蜜蜂Apiscerana、北美熊蜂Bombusimpatiens和地熊蜂Bombusterrestris的非视觉相关beta-arrestin基因进行同源序列比对。结果表明,地熊蜂beta-arrestin在进化上与其他物种中的同源蛋白具有同源性。地熊蜂beta-arrestin与黑腹果蝇Drosophilamelanogaster(AAF32365.1)和家蚕Bombyxmori(AGF86399.1)kurtz蛋白的氨基酸序列一致性分别高达73%和80%(表3)。将编码的氨基酸序列导入MEGA6.0软件中构建系统发育树,结果表明地熊蜂beta-arrestin与已知的家蚕BmKurtz和家蚕BmARR2亲缘关系较近(图4)。
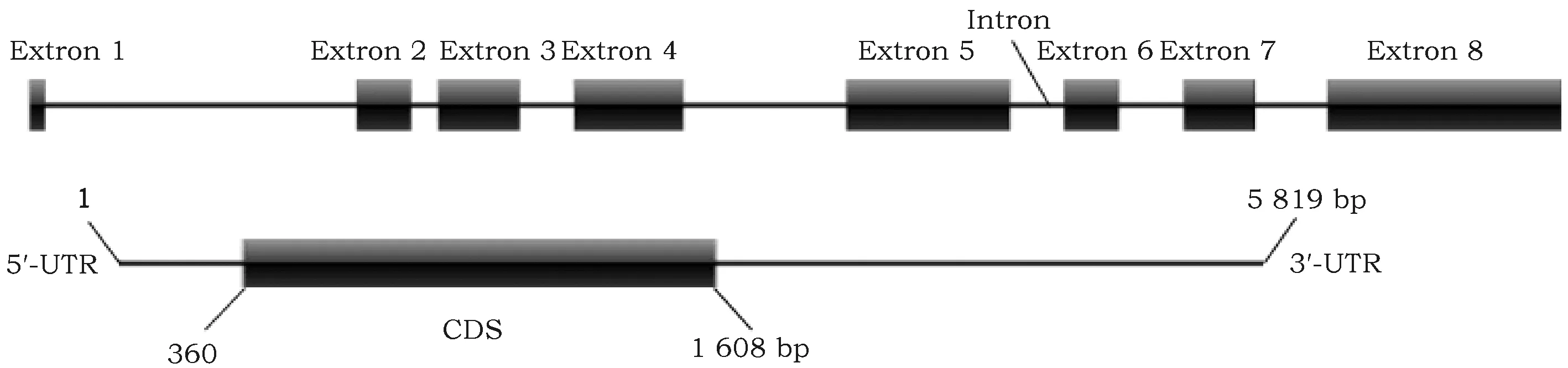
图2 地熊蜂beta-arrestin基因的cDNA和基因组结构分析Fig.2 cDNA sequence and genomic structure of Bombus terrestris beta-arrestin gene
表2地熊蜂beta-arrestin基因氨基酸序列分析表
Table2Aminoacidsequenceanalysisofbeta-arrestingeneinBombusterrestris

氨基酸数量/aa分子量/kD等电点Beta-arrestin41545.986.51

图3 地熊蜂beta-arrestin基因与NCBI数据库氨基酸序列比对Fig.3 The beta-arrestin gene of Bombus terrertris was compared with the amino acid sequence of NCBI database
表3地熊蜂beta-arrestin基因同源序列比对表/%
Table3Thehomologoussequencealignmentofbeta-arrestingeneinBombusterrestris

黑腹果蝇Drosophila melanogaster(AAF32365.1)家蚕Bombyx mori(AGF86399.1)Beta-arrestin7380
2.4 Beta-arrestin基因和内参基因GAPDH荧光定量标准曲线的建立
经计算得到beta-arrestin基因和内参基因GAPDH的质粒拷贝数,做出beta-arrestin基因的标准曲线:y=-3.421x+ 32.262 (y:Ct值,x:起始模板量)。曲线回归系数R2=0.9996,这说明在标准质粒稀释质量浓度范围内具有良好的线性关系,曲线的扩增效率为E=96%(图5)。内参基因GAPDH的标准曲线:y=-3.932x+ 36.736 (y:Ct值,x:起始模板量)。曲线回归系数R2=0.9995,这说明在标准质粒稀释质量浓度范围内具有良好的线性关系,曲线的扩增效率为E=79%(图6)。
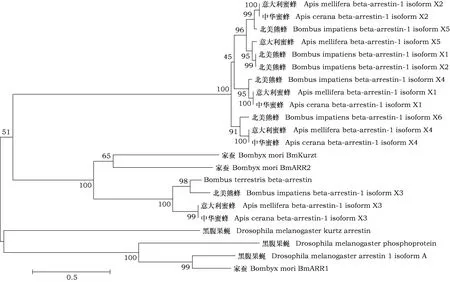
图4 基于氨基酸序列构建的地熊蜂与其他昆虫beta-arrestin的进化树(邻接法)Fig.4 Phylogenetic relationship of beta-arrestin from Bombus terrertris and other insects based on amino acid sequence (neighbor-joining method)
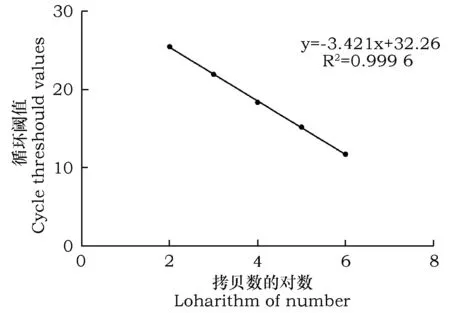
图5 Beta-arrestin基因 Real-time PCR标准曲线Fig.5 The standard curve of Real-time PCR of beta-arrestin gene
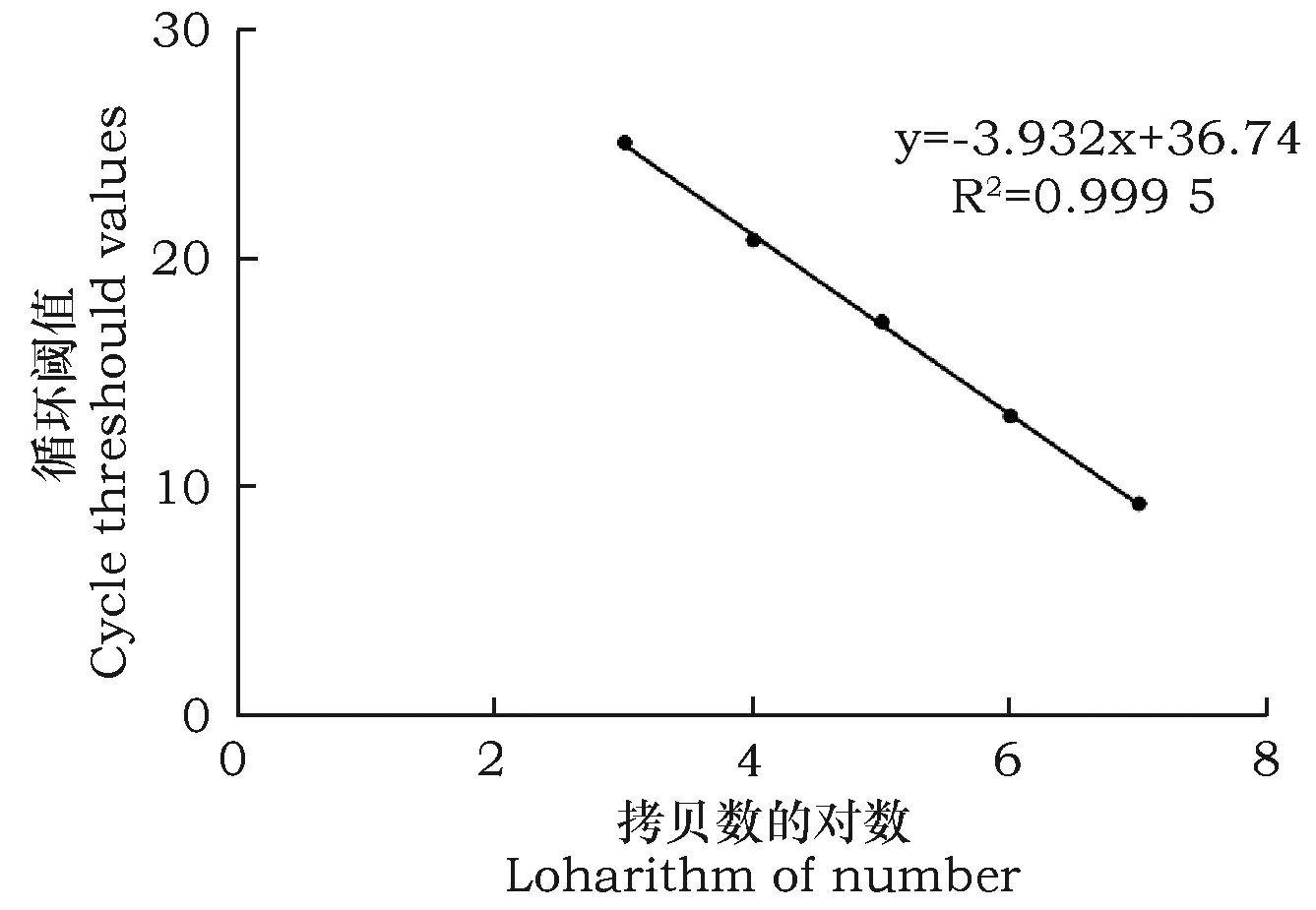
图6 GAPDH基因 Real-time PCR 标准曲线Fig.6 The standard curve of Real-time PCR of GAPDH gene
2.5 荧光绝对定量PCR测定beta-arrestin基因的表达
Beta-arrestin基因时空表达谱结果表明,beta-arrestin基因在地熊蜂所有检测的发育阶段及特定组织均有所表达,但表达量差异很大。其中在蜂王头部表达量较高的时期是越冬3个月蜂王,在越冬5个月蜂王头部表达量次之,均极显著高于其他时期(图7);在蜂王卵巢中表达量较高的时期是出房第1天蜂王,在越冬5个月蜂王卵巢表达量次之,均极显著高于其他时期(图8);在蜂王中肠表达量最高的时期是越冬3个月蜂王, 在越冬5个月蜂王中肠表达量次之,产卵第1天蜂王中肠表达量最少,其它4个时期表达量差异不明显(图9);在蜂王脂肪体中表达量较高的时期是出房第1天蜂王,在越冬3个月蜂王脂肪体表达量次之,在出房第1天蜂王和产卵第1天蜂王脂肪体表达量最少,其它3个时期表达量差异不明显(图10)。在饲养3个月蜂王的卵巢组织中荧光定量PCR未检出。
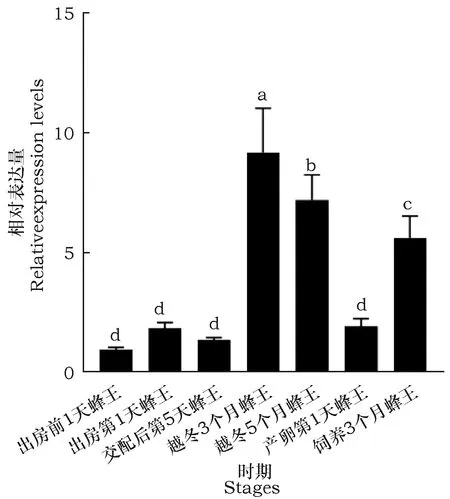
图7 beta-arrestin基因在不同时期蜂王头部的表达谱Fig.7 Expression level of beta-arrestin gene in different stages brain of queens注:数据均代表3次生物学重复的平均值±标准差,每次生物学重复包括1头蜂王。柱上标有不同字母表示差异显著。(P<0.05,利用IBM SPSS Statistics 19软件单因素方差法比较),下同。Note: The data are mean ± SD of 3 biology repeat,Each biology repeat includes one queen,Historams with different letters indicate significant different at 0.05 level by one-way ANOVA in IBM SPSS Statistics 19 software. The same below.
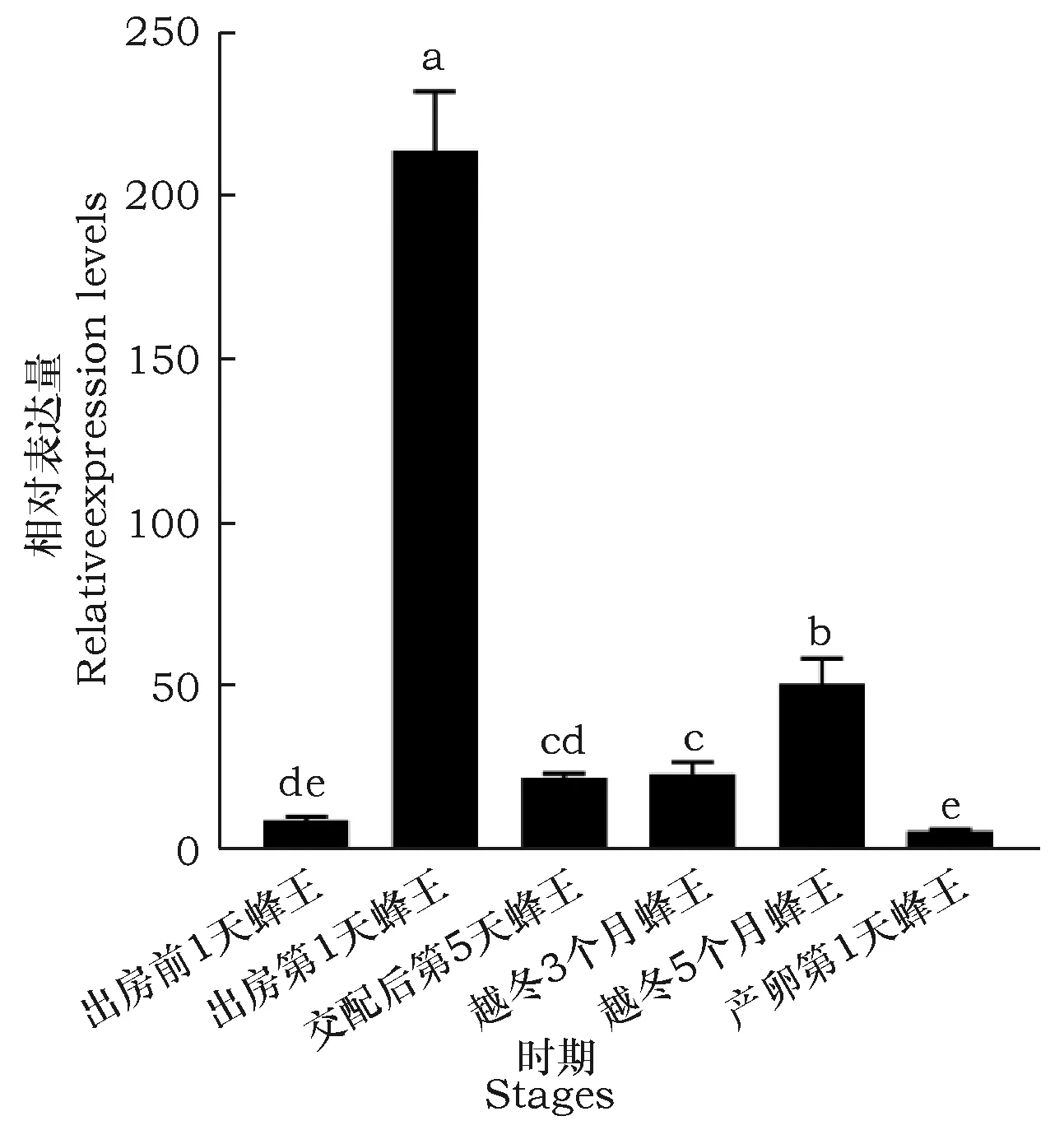
图8 beta-arrestin基因在不同时期蜂王卵巢的表达谱Fig.8 Expression level of beta-arrestin gene in different stages ovary of queens
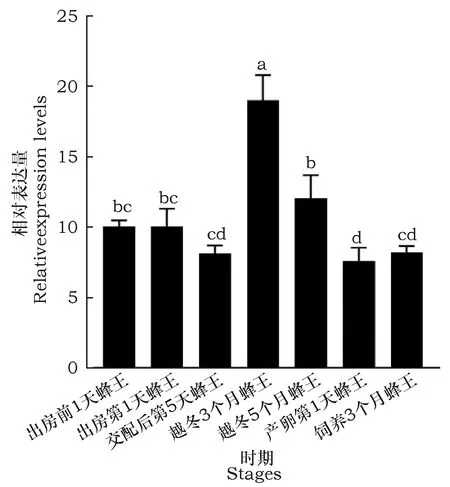
图9 beta-arrestin基因在不同时期蜂王中肠的表达谱Fig.9 Expression level of beta-arrestin gene in different stages midgut of queens
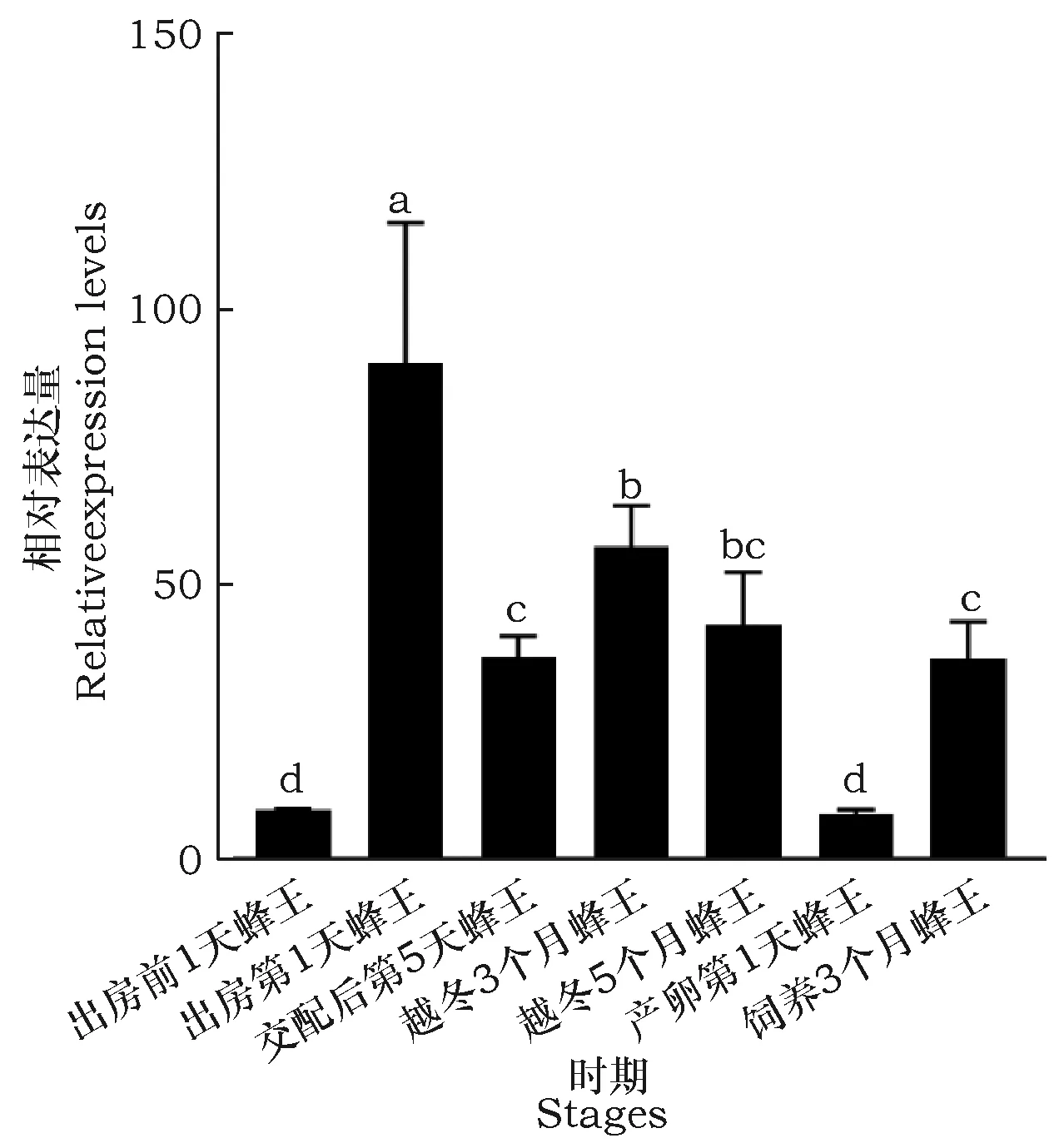
图10 beta-arrestin基因在不同时期蜂王脂肪体的表达谱Fig.10 Expression level of beta-arrestin gene in different stages fat body of queens
3 讨论
Arrestins家族作为一类重要的抑制蛋白广泛存在于各种动物和昆虫中[19],其中非视觉beta-arrestin作为胞浆蛋白参与各种各样的信号活动,包括质膜受体降解,循环和信号传递,也可以作为支架蛋白,调节多种细胞表面受体活性,包括G蛋白偶联的受体(GPCRs)[5]。本研究通过PCR扩增从地熊蜂中克隆非视觉相关beta-arrestin基因。系统进化分析表明这个基因能够与黑腹果蝇和家蚕的非视觉相关beta-arrestin聚为一支,且在进化上具有一定的保守性,说明地熊蜂beta-arrestin基因编码的蛋白可能与其他昆虫中的非视觉相关beta-arrestin基因在转录调控方面具有相似的功能。
地熊蜂是膜翅目,蜜蜂总科,熊蜂属,是一类多食性的社会性昆虫[20],为多种植物,特别是豆科、茄科植物的重要授粉[21]。目前利用熊蜂为温室果蔬作物授粉是一项低成本、高效率、无污染的现代化高新农业技术措施[22]。地熊蜂属于变态发育,在发育过程中经历了卵、幼虫、蛹和成虫这4个阶段[23];其外部形态、内部结构、生理机能及生活方式等[24]方面都发生了剧烈的改变[25]。这一系列过程也涉及到各种基因转录调控的变化[18]。在果蝇中非视觉相关的beta-arrestin,编码(kurtz),存在果蝇整个发育阶段,对果蝇的生存发育和神经方面是不可缺少的[16]。在果蝇早期胚胎发育时Kurtz一直存在,后期其集中在中枢神经系统中表达。Kurtz在脂肪体有高表达,由于脂肪体的分解致使黑色素瘤中出现Kurtz突变体[26]。Kurtz在神经组织中的表达对果蝇幼虫生存能力至关重要。果蝇的研究表明Kurtz对G蛋白偶联的受体脱敏和嗅觉灵敏度是必需的,认为arrestins的许多常见功能在多个物种之间是保守的。Han等研究表明敲除beta-arrestin基因会使小鼠胚胎致死[27]。Ruiz等研究表明敲除beta-arrestin基因导致斑马鱼胚胎表型Smo突变体蛋白水平降低,出现腹曲体,头部发育不全,部分独眼,和导致U形体节等现象[28]。同时在家蚕中非视觉相关的BmKurtz,参与GPCR的脱敏反应以及调节胞外信号调节激酶ERK的磷酸化,对家蚕的生理机能和生存发育至关重要[17]。为进一步研究beta-arrestin的功能,本研究采用绝对定量real-time PCR分析beta-arrestin基因在地熊蜂不同发育时期及特定组织的表达情况,beta-arrestin基因在地熊蜂蜂王所有检测的发育时期及特定组织中都有表达,差异性较大;其中在越冬3个月和越冬5个月蜂王的头部中的表达量显著高于其它组,推测其可能和GPCR受体家族共同作用,调控蜂王越冬期间生理代谢过程。在出房第1天蜂王的卵巢与脂肪体的表达量显著高于其它组,推测其可能和GPCR受体家族共同作用,参与蜂王性成熟阶段的激素分泌活动。下一步将考虑通过构建表达载体进行细胞水平上的功能验证,并利用RNAi等方法进行深入研究地熊蜂beta-arrestin基因的生物学功能及可能的作用机制。
4 结论
本研究成功克隆了地熊蜂非视觉相关beta-arrestin基因CDS序列。生物信息学分析结果表明beta-arrestin基因氨基酸序列与NCBI中收录的地熊蜂转录组数据的氨基酸序列一致性高达97%。Real-time PCR结果表明,beta-arrestin基因在地熊蜂所有检测的发育阶段及特定组织均有所表达,但表达量差异很大(P<0.05);其中在头部和中肠表达量较高的时期是越冬3个月蜂王,在卵巢和脂肪体表达量较高的时期是出房第1天蜂王。推测其与蜂王越冬期间生理代谢过程和蜂王性成熟阶段激素分泌活动有关,具体功能还需要进一步验证。

