熊蜂抗冻蛋白基因序列分析及表达特性研究
徐凯,陈东海,王志,刘玉玲,王振伟,牛犇,蔡向强,牛庆生
(吉林省养蜂科学研究所,吉林 132108)
在热带和温带海域以外的广阔地域,季节周期变化或者偶然因素会导致气温降至较低的低温水平,这些低温环境往往对昆虫的个体生长发育、群体繁衍以及区域分布具有较大的影响[1]。为了避免或缓解漫长冬季的影响,昆虫逐渐进化出一系列的生理机制来抵御低温对自身的伤害,昆虫抗寒相关蛋白质的积累与变化便是其中一个主要的分子抗寒机制。抗冻蛋白(Antifreeze protein,AFP)是一类有效抑制冰晶生成的蛋白质,其在不改变体液熔点的前提下以非依数性地降低体液的冰点。抗冻蛋白独具3种理化特性,即热滞活性、抑制冰晶的再次结晶以及加强细胞膜与膜蛋白间的相互作用[2]。昆虫抗冻蛋白具有较强的热滞活性,有研究表明某些昆虫抗冻蛋白的活性较鱼类AFPs高出近10倍[3]。最近关于昆虫抗冻蛋白的研究仍主要集中在独居型昆虫中,主要对各种昆虫的抗冻蛋白的克隆、序列分析以及通过原核表达或真核表达的方式表达出该蛋白后进行相关的抗冻保护试验[4,5]。由于抗冻蛋白序列在物种间存在较大的差异,即使相同目的昆虫抗冻蛋白的相似性较低,这为昆虫抗冻蛋白序列的获得造成较大的阻碍。但随着转录组学在生命科学领域的广泛应用,通过转录组学测序的方法筛选昆虫抗冻蛋白序列已成为获得未知抗冻蛋白序列的有效途径,该方法已应用在白蜡蚧虫抗冻蛋白的筛选上[6]。目前研究较多的昆虫抗冻蛋白主要集中在鞘翅目的黄粉虫Tenebriomolitor、赤翅甲Dendroidescanadensis、小胸鳖甲Microderapunctipennis以及鳞翅目的云杉卷叶蛾Choristoneurafumiferana,这些昆虫AFPs有许多相似的特点,比如多种异构型、氨基酸重叠基序以及β螺旋结构[7]。研究表明,抗冻蛋白可增加昆虫对寒冷的耐受型,可作为昆虫耐寒研究的候选基因[8]。但由于各种昆虫过冬方法的不同,其体内AFPs的含量也存在着极大的差异,而且不同地域间光周期、环境温度以及发育时期也会对昆虫体内抗冻蛋白的表达产生较大的影响[9,10]。
熊蜂属于膜翅目、蜜蜂总科、熊蜂属,是当前备受国内外关注的授粉昆虫。熊蜂经人工驯化并实行工厂化繁育后,可广泛应用于农作物的授粉,不仅能够提高作物收益,还降低人工成本和激素应用的化学污染[11]。作物授粉中温度的变化将会对熊蜂的采集行为以及蜂群的繁殖产生较大的影响。目前关于膜翅目昆虫抗冻蛋白基因的研究相对较少[12,13],熊蜂抗冻蛋白的研究未见报道,且关于熊蜂温度调节机制的研究鲜见报道。本研究对前期转录组测序获得的熊蜂抗冻蛋白基因BtAFP序列进行生物信息学分析,并检测该基因在熊蜂不同发育时期、不同组织以及不同低温环境胁迫下的mRNA表达量,探究该基因在熊蜂生长发育和低温环境下的表达规律,也为膜翅目昆虫抗冻蛋白基因表达特性的研究提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试虫选择
本研究所用熊蜂(Bombusterriestris)均采集自吉林省养蜂科学研究所熊蜂人工繁育场。饲养温度为(28±1)℃,湿度为(60±5)%。分别从3群群势相同(100只工蜂左右),蜂王繁育时期相同的蜂群中采集小幼虫、大幼虫、粉眼蛹(复眼为粉红色,体表为白色)、褐眼蛹(复眼为褐色,体表为白色)和工蜂成虫。采集1~5日龄个体大致相同的熊蜂工蜂个体100只于冰上进行解剖,解剖的组织包括:触角、头部、胸部、腹部、足、翅膀和中肠。采集个体大致相同的熊蜂工蜂个体100只,分别放入扎孔的15 mL离心管中后迅速进行低温胁迫处理,低温处理的温度选取0 ℃(冰水临界温度)和-20 ℃(参考蜜蜂体液完全结冰温度-18 ℃),在前期低温胁迫中发现在熊蜂0 ℃恒温恒湿箱中可存活很长的时间,其在0 ℃胁迫环境下24 h内依旧可以恢复至正常的生理状态。熊蜂在-20 ℃环境下会迅速进入冷昏迷状态(还可恢复至正常生理活动),但在1 h后极易出现死亡。本研究在前期研究基础上分别选4 h和20 min作为0 ℃和-20 ℃胁迫环境的时间间隔。各样品自采集后迅速投入液氮速冻,随后于-80 ℃保存备用。
1.1.2 主要试剂与仪器
本研究主要用到的试剂包括TRIzolTM(invitrogen公司)、SYBRPremixExTaqTMⅡ、PrimeScriptTMRT Master Mix(TaKaRa公司)、RNA-free Water(全式金公司)以及三氯甲烷、异丙醇、无水乙醇等常规试剂。本研究主要用到的主要仪器包括5810R 高速冷冻离心机(Eppendorf),7500 FAST 型荧光定量PCR仪(ABI),AB-9902 型触摸式PCR仪(AB)。
1.2 试验方法
1.2.1 BtAFP序列分析
本研究利用多种生物信息学分析软件对BtAFP的氨基酸序列、同源性、进化树以及该基因5’UTR区域启动子和转录因子进行预测分析,所用到的生物信息学软件见表1。

表1 生物信息学分析所用软件Table 1 The software for bioinformatic and phylogenetic analyses
1.2.2BtAFP基因的mRNA表达
从-80 ℃冰箱内取出样品,经液氮研磨后,按照Trizol 试剂盒说明书提取各组织总RNA,测定浓度和纯度后,再根据PrimeScriptTMRT Master Mix 试剂盒(TaKaRa公司)说明书反转录为cDNA模板。反转录产物用RNAfree水稀释5倍后于4 ℃保存备用。在前期进行的熊蜂转录组序列比对分析的基础上,获得BtAFP的序列信息。根据所得序列的CDS序列设计荧光定量引物,引物信息为BtAFPF:5’-GCTCAGGAATCTGCGCTATC -3’;BtAFPR:5’-TTAGCCAAAGGACCACCAAC -3’,内参基因选用β-actin,引物信息为β-actinF:5’-ACTACGGCCGAACGTGAAAT-3’,β-actinR:5’-GGAAAAGAGCCTCGGGACAA-3’。引物交由生工生物工程(上海)股份有限公司合成。根据TaKaRa 的SYBR Premix Ex TaqTMⅡ试剂盒说明书进行实时荧光定量PCR。反应体系总体积为20 μL,每个组织样本重复测定3次。
1.2.3 数据统计与分析
荧光定量PCR中,根据标准曲线以及荧光曲线的Ct值,采用2- ΔΔCT法进行数据分析。运用SPSS17.0软件中的单因素方差分析,并选用TUKEY法进行多重比较。
2 结果与分析
2.1 熊蜂BtAFP蛋白序列分析
熊蜂BtAFP ORF区域共包含1 143 bp,编码380个氨基酸,其核酸序列以及相对应的氨基酸序列如图1A所示。利用多种生物学软件对BtAFP蛋白质的理化性质进行预测分析,结果表明BtAFP预测蛋白分子量为38 kDa,含量最多的3种氨基酸残基分别为丙氨酸、亮氨酸和谷氨酰胺(图1B);该蛋白的第1~20氨基酸残基间为信号肽区域,无跨膜结构域;pI为6.13,不稳定系数为39.11,脂溶指数为88.84,总平均亲水性为-0.121。该蛋白的三级结构与二级结构主要为α螺旋和无规则卷曲(图1C和图1D)。分别利用NetOGlyc 3.1 Server和NetPhos 3.1 Server对BtAFP的O糖基化位点、N糖基化位点(图1E)和磷酸化位点(图1F)进行预测,结果发现BtAFP存在一个O糖基化位点:T370,存在5个N糖基化位点: K2,K21,K119,K159,K204以及25个磷酸化位点,即:T23,Y33,Y35,S42,S63,S106,S111,S130,T156,T157,S189,S209,Y221,T223,T224,S267,S310,S323,S324,S340,S341,S352,S359,S363,Y373。

图1 熊蜂抗冻蛋白序列分析结果Fig.1 The results of bioinformatics analysis of BtAFP注:1 A:熊蜂抗冻蛋白编码区核酸序列与氨基酸序列;1B:熊蜂抗冻蛋白氨基酸组成;1C:熊蜂抗冻蛋白的蛋白质三级结构;1D:熊蜂抗冻蛋白的蛋白质二级结构;1E:熊蜂抗冻蛋白的N糖基化位点预测结果;1F:熊蜂抗冻蛋白的磷酸化位点预测结果。Note: 1 A: Nucleotide and deduced amino acid sequences of BtAFP; 1B: Amino acid compositions of BtAFP; 1C: protein tertiary structure of BtAFP; 1D: secondary protein structure of BtAFP; 1E: The result of predicted N-glycosylation of BtAFP; 1F: The result of predicted phosphory of BtAFP.
2.2 熊蜂BtAFP序列5’UTR区域启动子及转录因子预测
利用BDGP软件对BtAFP5’UTR区域进行分析,结果发现在距CDS区第一密码子ATG于997~1 047 bp处可能存在一段序列为AAACTGGATTTATAAGACCCATGGAAATATTATTG-ACCTAGCAAAAAAGT的启动子序列,该预测结果相对应的转录起始位点为距离CDS区第一密码子ATG于1 006 bp的鸟嘌呤(G)碱基。利用PROMO在线软件对BtAFP5’UTR第一密码子ATG上游3 000 bp区域的序列上的转录因子进行预测,结果发现在BtAFP序列5’UTR上存在多个与环境相关的转录因子,其中包括11个ZIC,4个Cdx-1,27个BR-C和16个AP-1。
2.3 同源性与进化树分析
经过Blastp比对发现,熊蜂抗冻蛋白与西方蜜蜂抗冻蛋白和中华蜜蜂抗冻蛋白氨基酸序列的一致性最高,均为74%,其次为回条蜂(69%),与其他膜翅目昆虫的一致性在60%以上,该氨基酸序列与鞘翅目马铃薯甲虫抗冻蛋白的一致性最低,为54%。利用MEGA4.0软件NJ法构建基于氨基酸序列的昆虫抗冻蛋白的系统进化树(图2A),结果显示所用昆虫AFPs序列分为2个大的分支,第一个大分支为膜翅目昆虫,第二个大分支为鞘翅目的马铃薯甲虫。第一个大分支中包括了3个小分支,由上到下依次为蜜蜂科昆虫、蚁科和叶蜂科与尾蜂科。熊蜂抗冻蛋白属于第一个小分支,该小分支中还包括西方蜜蜂、中华蜜蜂以及回条蜂。利用DNAMAN软件对熊蜂、西方蜜蜂、中华蜜蜂以及回条蜂的AFPs氨基酸序列进行比对(图2B),结果发现4个氨基酸序列中拥有许多保守的结构域(见图2B的蓝色背景的氨基酸序列),在BtAFP的58~251位氨基酸间区域的相似性较高。利用NCBI数据库的Conserved domains软件对BtAFP的保守结构域进行预测,发现在68~225位氨基酸间存在一个功能未知的DUF745 domain containing protein保守结构域。
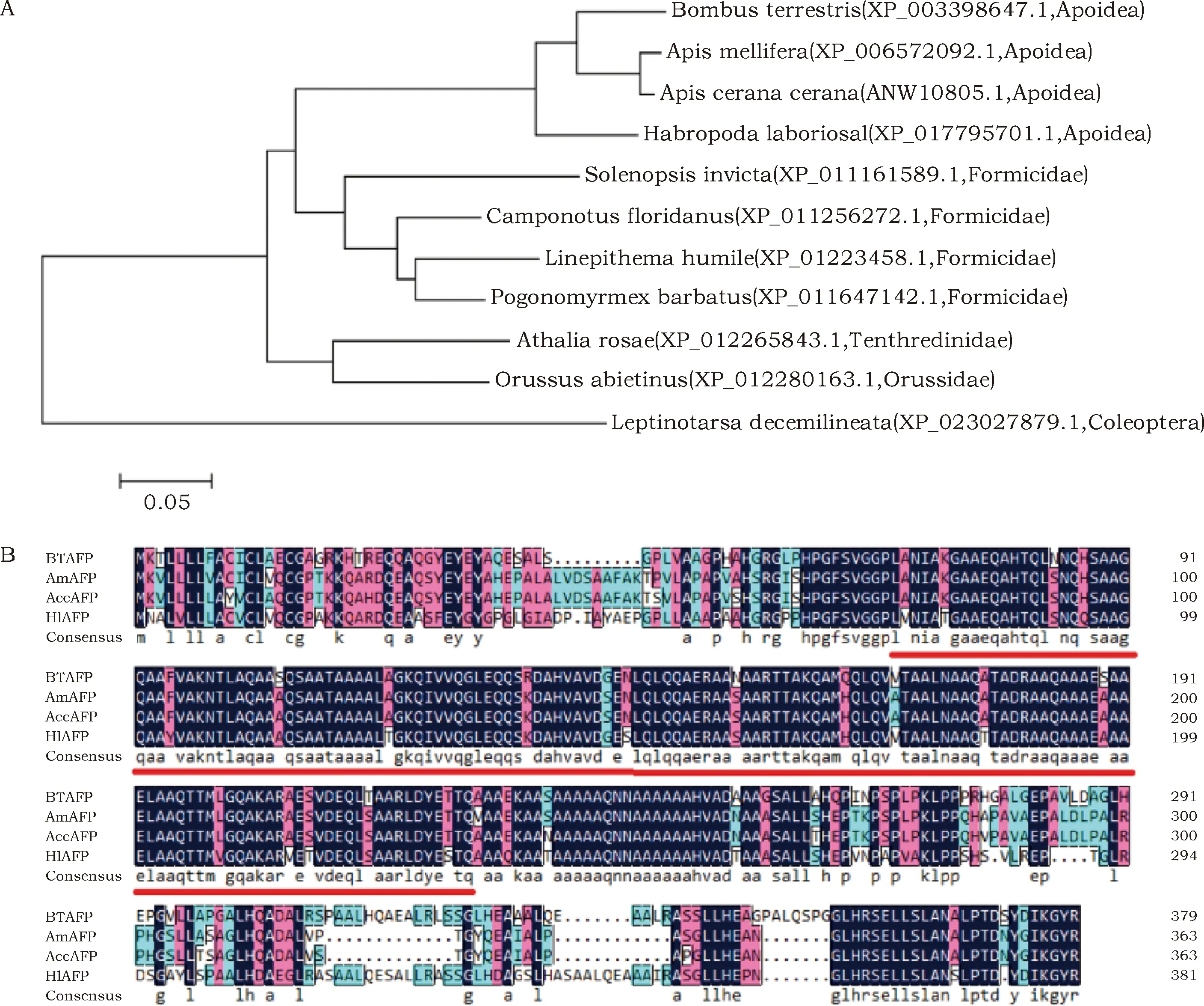
图2 进化树分析与同源性分析Fig.2 Phylogenetic tree and alignment of AFPs based on amino acid sequences from different insect species注: 2 A:基于氨基酸序列构建的昆虫AFPs的系统进化树。AFP序列来源:熊峰:Bombus terrestris;西方蜜蜂:Apis mellifera;中华蜜蜂:Apis cerana cerana;回条蜂:Habropoda laboriosal;红火蚁:Solenopsis invicta;佛罗里达弓背蚁:Camponotus floridanus;阿根廷蚂蚁:Linepithema humile;收获蚁:Pogonomymex barbatus;菜叶蜂:Athalia rosae;尾蜂:Orussus abietinus;马铃薯甲虫:Leptinotarsa decemilineatia,蜜蜂科:Apoidea;蚁科:Formicidae;叶蜂科:Tenthredinidae;尾蜂科:Orussidae;鞘翅目:Coleoptera。2B:蜜蜂科昆虫抗冻蛋白氨基酸序列比对。BtAFP:熊蜂抗冻蛋白;AmAFP:西方蜜蜂抗冻蛋白;AccAFP:中华蜜蜂抗冻蛋白;HlAFP:回条蜂抗冻蛋白,蓝黑色部分代表高度保守区,红色代表相似的氨基酸,划红线部分为DUF745保守结构域。Note: 2 A: Phylogenetic tree of AFPs from different insect species based on amino acid sequences. AFPs amino acids were from the following species: Bombus terrestris, Apis mellifera, Apis cerana cerana, Habropoda laboriosal, Solenopsis invicta, Camponotus floridanus, Linepithema humile, Pogonomymex barbatus, Athalia rosae, Orussus abietinus, Leptinotarsa decemilineatia.; 2B: Alignment of AFPs amino acid of Apidae insects. BtAFP: Bombus terriestris antifreeze protein; AmAFP: Apis mellifera antifreeze protein; AccAFP: Apis cerana cerana antifreeze protein; HlAFP: Habropoda laboriosal antifreeze protein. Conserved and similar amino acid residues were labeled in blue and red backgrouds. The area marked by red line is the conservative structural domain of DUF745 conserved domains.
2.4 熊蜂BtAFP在不同发育时期的表达
BtAFP基因在熊蜂不同发育时期的mRNA表达量如图3所示。由图可知,BtAFP在熊蜂工蜂不同的发育时期存在显著差异(P<0.05)。BtAFPmRNA从小幼虫至成蜂个体间呈现先上升后下降的趋势,其在幼虫期的表达量均较低,进入蛹期后该基因的表达量逐渐上升,并于褐眼期时达到最高表达水平(P<0.05),在成蜂个体阶段,该基因的表达量维持中等的表达水平,其显著低于褐眼蛹期的表达量(P<0.05),但高于其余发育时期。
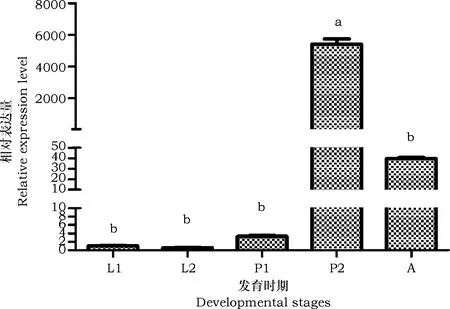
图3 熊蜂抗冻蛋白基因在不同发育时期的表达Fig.3 The expression levels of BtAFP mRNA in different developmental stages注:L1:小幼虫期;L2:大幼虫期;P1:粉眼蛹期;P2:褐眼蛹期;A:成蜂。不同字母表示在该基因在不同发育时期的表达量存在显著差异(P<0.05)。Note: L1, small larval stage; L2: large larval stage; P1: pupal stage with Pink eyes; P2: pupal stage with brown eyes; A: adults. Data with different letters indicated significant difference between different developmental stages at 0.05 level.
2.5 熊蜂BtAFP在不同组织中的表达
BtAFP基因在熊蜂不同组织中mRNA表达量检测结果如图4所示。由图可知,BtAFP在熊蜂工蜂不同的组织中的表达量存在显著差异(P<0.05)。BtAFPmRNA由高到低依次为:触角>翅膀>足>中肠>腹部>头部>胸部,该基因在熊蜂触角中的表达量最高,显著高于其它组织(P<0.05),其在胸部中处于最低的表达水平(P<0.05)。
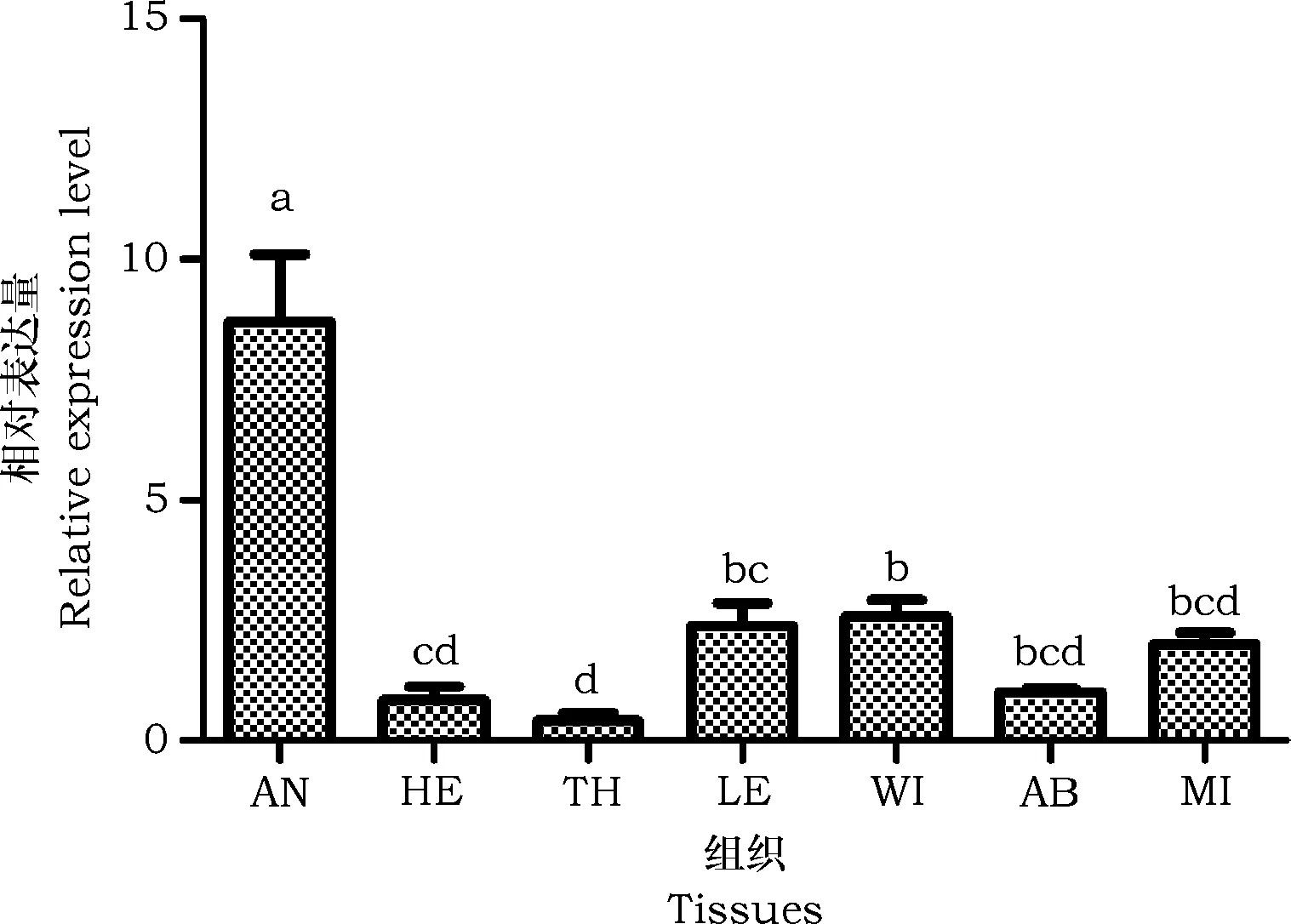
图4 熊蜂抗冻蛋白在不同组织中的表达量Fig.4 Relative expression levels of BtAFP mRNA in different tissues注:AN:触角;HE:头部;TH:胸部;LE:足;WI:翅膀;AB:腹部;MI:中肠。不同字母表示相同温度下不同时间之间差异显著(P<0.05)。Note: An: Antennae; HE: Head; TH: Thorax; LE: Legs; WI: Wings; AB: Abodem; MI: Midgut. Data with different letters indicated significant difference between different processing time of the same temperature at 0.05 level.
2.6 熊蜂BtAFP在低温胁迫下的表达
BtAFPmRNA在-20 ℃(图5 A)和0 ℃(图5B)的表达量检测结果如图3所示。由结果可知,BtAFPmRNA的表达量在低温胁迫前后呈现显著变化(P<0.05)。在-20 ℃环境胁迫下,BtAFP表达量先上升后下降,在20 min时达到最高表达水平,显著高于其它时期(P<0.05)。在0 ℃环境胁迫下,BtAFPmRNA 总体上也呈现先上升后下降的变化趋势,其在4~16 h阶段逐渐上升并在16 h时达到最高表达水平(P<0.05),在16~24 h阶段,BtAFPmRNA逐渐降低。
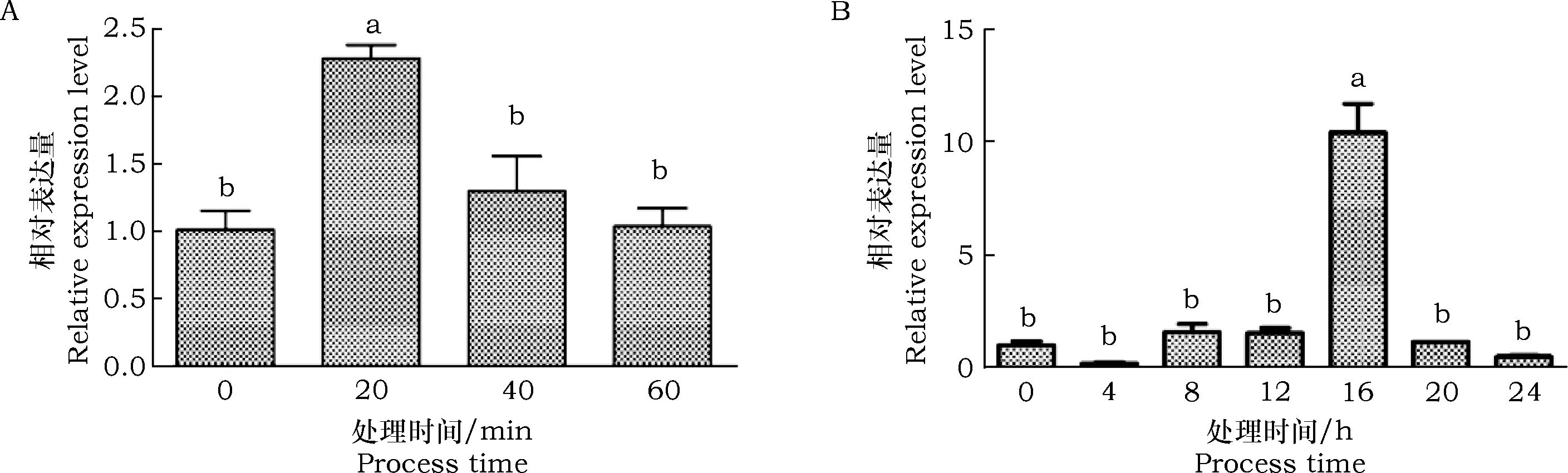
图5 熊蜂抗冻蛋白在-20 ℃(A)和0 ℃(B)环境下的表达量Fig.5 Relative expression levels of BtAFP mRNA in response to different low temperature treatments注:不同字母表示相同温度下不同时间之间差异显著(P<0.05)。Note: Data with different letters indicated significant difference between different processing time of the same temperature at 0.05 level.
3 讨论
昆虫在地球不同的低温气候带均有较为广泛的分布。不同品种昆虫的抗冻蛋白在基因和蛋白结构上在的间存在较大的差异,即使同一种昆虫抗冻蛋白的不同异构型间的相似性也不高。根据现有的研究可知,一般情况下,昆虫AFPs所翻译蛋白的分子质量在7~21 kDa之间,氨基酸序列中富含半胱氨酸或苏氨酸残基(所占比例约40%),且包含12~15个氨基酸残基的重复序列,通过X射线结晶技术测定各昆虫AFPs的蛋白结构后发现,多数昆虫AFPs呈现出β螺旋结构[7]。而在本试验中发现,熊蜂抗冻蛋白包含1 143 bp的CDS区序列,编码380个氨基酸,且蛋白分子质量大约为38 kDa。熊蜂抗冻蛋白富含丙氨酸,通过生物信息学软件对该蛋白二级结构和三级结构进行预测,发现该蛋白质主要结构为α螺旋,还包括少量的无规则卷曲。结合该序列的二级结构和三级结构多为α螺旋的预测结果,可初步推断,熊蜂抗冻蛋白与已知昆虫抗冻蛋白序列并无过多的相似性。但对鱼抗冻蛋白的相关研究发现,鱼type-I型AFPs氨基酸序列中富含丙氨酸,而且其二级结构和三级结构中以α螺旋为主[14,15]。,本研究推测熊蜂抗冻蛋白的生理功能可能与鱼type-I型AFPs的功能相似,即通过降低血液(血淋巴液)的结冰温度来提高机体的耐寒性,该结果与本课题组前期在中华蜜蜂抗冻蛋白的研究结果相近[13]。
糖基化修饰和磷酸化修饰是重要的蛋白修饰方式,这2种蛋白翻译修饰对蛋白质的结构和功能具有重要的影响。本试验分析预测显示,熊蜂抗冻蛋白之间存在1个O糖基化位点、5个N糖基化位点和25个磷酸化位点,这些蛋白修饰位点也暗示熊蜂抗冻蛋白在蛋白质折叠、转运、基因表达以及信号传导等生理功能方面存在一定的特异性[13]。系统进化树分析结果表明,熊蜂抗冻蛋白序列与蜜蜂科昆虫的AFPs相似性最高,该现象与昆虫分类结果相一致。而熊蜂抗冻蛋白序列与其他昆虫的一致性在54%~74%之间,表明AFPs具有较高的变异性,可能与不同昆虫生活习性以及地域分布有关。启动子对基因表达的调控具有重要的影响,多数的研究均认为启动子能够抑制基因表达的水平。本研究中通过探寻TATAbox经典转录元件的方法对熊蜂抗冻蛋白的启动子区域进行预测,结果发现BtAFP的5’ UTR区域存在启动子区域,该预测结果为后续BtAFP的表达调控、基因定位以及调控机制的研究提供了基础[16]。本研究利用PROMO在线软件对BtAFP的5’ UTR区域的与环境变化相关的转录因子进行预测,结果发现该区域存在58个环境变化相关的转录因子,表明BtAFP的表达可能受环境变化的影响。
影响昆虫AFPs的因素有很多,比如,环境温度、湿度以及光周期的长度[9]。相比上述这些外界的环境因素,机体自身的因素同样是影响AFPs表达的重要因素[17]。对云杉卷叶蛾(C.fumiferana)的研究表明,AFPs在云杉卷叶蛾越冬期二龄幼虫中的表达量最高,而且主要集中在幼虫的前端和肠道中表达[18]。对黄粉虫的研究表明,AFPs的表达与黄粉虫的发育时期具有显著的相关性[9]。本研究中发现BtAFPmRNA在熊蜂不同发育时期存在显著差异,其在幼虫期的表达量极低,在成蜂个体中呈现中等表达水平,在蛹期表达量较高,尤其是褐眼蛹期表达量显著高于其它时期,推测熊蜂工厂化繁育过程中熊蜂群体对幼虫的保护能力较强,能够给幼虫提供较为稳定小环境,而蛹期BtAFP的较高表达水平将有助于提高蛹对低温的耐受力,保障其正常的生长发育。除了不同的发育时期外,不同昆虫抗冻蛋白在不同组织中的表达也呈现出一定的差异,Qin等对云杉卷叶蛾的研究表明,CfAFPs在云杉卷叶蛾越冬期幼虫的前端和肠道中表达[18]。本研究中发现BtAFP在熊蜂不同组织间均有表达,且在触角、翅膀和足中的表达量较高,该结果可能是由于该器官距离机体中枢较远,与环境直接接触,抗冻蛋白基因的高表达有助于提高熊蜂对低温环境的敏感性。
对于多数独居型昆虫,在越冬期增加虫体内AFP的含量是一个重要的抗寒保护措施,其也可显著提高昆虫越冬的成功率。Graham等以黄粉虫T.molitor为研究对象,对黄粉虫小幼虫进行4 ℃持续4周的低温处理后,其血淋巴液中抗冻蛋白含量提升了20多倍[9]。Hou等研究表明,从夏季至初冬时期,准格尔小胸鳖甲体内AFPmRNA的表达量升高了13.1倍[19]。张凤娟等研究表明,中华齿刺甲Oodescelischinensis抗冻蛋白基因受低温环境的诱导,其mRNA在-4 ℃和5℃温度胁迫后的表达量会增高2.7~3.9倍[20]。本研究发现,BtAFP的表达受低温环境的诱导,-20 ℃持续20 min和0 ℃ 持续16 h温度胁迫后BtAFPmRNA分别提高了2.3和11倍,与上述研究结果相近。在本研究中,-20 ℃和0 ℃低温胁迫下BtAFP均呈现先上升后下降的表达趋势,表明在低温胁迫初期,抗冻蛋白的增加有助于熊蜂提高自身的低温耐受力,但在胁迫后期由于低温昏迷而导致的机体代谢速率的持续下降而使BtAFP表达量随之下降,也有可能是因为抗冻蛋白的大量积累将会造成熊蜂机体的损伤的原因[21],其具体机制需要进一步的研究来验证。此外,BtAFP的表达受低温环境影响的结果与BtAFP5’UTR上存在多个与环境相关的转录因子的预测结果相一致。
4 结论
BtAFP包含1 143 bp的CDS区序列,编码380个氨基酸,且蛋白分子质量大约为38 kDa。BtAFP的二级和三级蛋白质结构主要为α螺旋,而且该蛋白与其他昆虫AFPs氨基酸序列的一致性为54%~74%之间,表现出该基因在昆虫间的高变异性。BtAFP高表达于熊蜂的褐眼蛹期,其在熊蜂各组织中均有表达,在触角、翅膀和足中的表达量较高。BtAFPmRNA的表达受低温环境的诱导,其在-20 ℃持续20 min以及0 ℃持续16 h时的表达量最高,表明该基因可作为熊蜂抗寒研究的候选基因。

