儿童体外膜氧合合并胃肠道出血的危险因素分析
于新迪,杨寅愉,沈 佳,郭 铮,张 蔚,王 伟,朱德明,徐卓明,张海波
体外膜氧合(extracorporeal membrane oxygenation,ECMO)是体外生命支持技术的重要组成部分,在儿童重症先天性心脏病(congenital heart disease,CHD)术后心衰的救治中发挥了非常重要的作用。胃肠道(gastrointestinal,GI)出血是小儿常见的急症之一,与重症患儿较高的死亡率息息相关[1]。虽然应激性溃疡的预防大大降低了其发病率,但仍有一些患者处于GI出血的危险之中[2]。目前为止,国内外关于儿童ECMO期间GI出血的数据很少。因此,本研究回顾性分析本中心2017年至2018年CHD心肺转流术后接受ECMO治疗患儿的相关资料,对其临床数据进行总结归纳,对其危险因素进行分析,探讨GI出血的发病率和对死亡率的影响。
1 资料与方法
1.1 一般资料 2017年至2018年本中心共有70例CHD患儿心肺转流术后接受ECMO治疗,男38例,女 32例,年龄 0 d~12 岁,体重 2.30~26 kg。 8例在围ECMO期发生了GI出血,其中男4例,女4例,年龄 2 ~ 240(75.87±74.54)d,体重 2.30~5.30(4.03±1.33)kg,病种为完全性大动脉转位 2 例,主动脉弓闭锁1例,完全型肺静脉异位连接1例,房室间隔缺损1例,室间隔缺损3例。收集所有患儿围ECMO期间的医嘱和临床资料[包括ECMO、呼吸机、ICU时间和住院时间,新生儿和体外心肺复苏(external cardiopulmonary resuscitation,ECPR)占比,合并感染、脑出血、肝肾损伤的患儿例数,血培养、降钙素原(procalcitonin,PCT)和 C 反应蛋白(C-ractive protein,CRP)的平均值,每天红细胞(red blood cell,RBC)的平均输注量、血小板计数(platelet count,PLT)最低值和平均值,脱机和存活情况]并进行对比分析,其中不同指标平均值的计算方式为每天同一时间测定值的平均值。详见表1。
1.2 抗凝管理 所有患儿均按本中心的ECMO常规进行管理。期间使用肝素抗凝[2~30 U/(kg·h)],定时监测出凝血指标,维持活化凝固时间180~220 s,活化部分凝血活酶时间50~80 s。临床上若出现严重的出血导致循环功能不稳定时,短时间内可根据需要暂停肝素抗凝。
1.3 胃肠道营养和管理 若患儿胃肠道功能正常,在ECMO 24 h内给予开奶,奶泵起始量为0.5~1 ml/(kg·h)(按 1 ml/d 的量增加)并持续 20 h。 然后暂停奶泵4 h评估是否有胃潴留、腹胀、肠鸣音减弱或消失、呕血、黑便或鲜血便等临床表现,是否有胃肠道近红外光谱值的明显下降、粪便潜血试验阳性(每日一次)和腹部X线的检查结果异常等。
1.4 治疗方法 ①保守治疗:发生GI出血时立即禁食、胃肠减压、抑酸和保护胃黏膜治疗、静脉营养、升级或调整抗生素,必要时予血浆、红细胞及丙种球蛋白等支持治疗,同时调整并维持出凝血功能的稳定。待腹胀症状完全消失、三次粪常规隐血转阴后,由稀释配方奶开始喂养,并逐步增加奶量。②手术治疗:保守治疗无效或伴有少尿、低血压等循环功能不稳定时行手术探查[3-4]。
1.5 统计学处理 所有数据均采用SPSS 22.0统计软件进行统计学分析。使用率、百分比描述一般资料,计量资料用均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料用卡方检验进行分析;对ECMO期间GI出血的合并因素行单因素分析,将筛选出的危险因素行多因素 logistic回归分析。当P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 8例GI出血的患儿中足月儿5例(62.50%),新生儿 3 例(37.50%),其中 1 例(12.50%)为早产儿。体重小于3 kg的为3例(37.50%)。安装原因为:低心排血量综合征(Low cardiac output syndrome,LCOS)2 例;ECPR 5 例(62.50%),手术后无法脱离心肺转流1例。8例患儿在24 h内都已开奶。GI出血的患儿均有粪便潜血试验阳性或X线的检查异常,临床上以黑便、鲜血便伴有腹胀或坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的症状为主。5例(62.50%)血培养为阳性致病菌,仅有1例存活出院。 出血组 PLT 为(42~72.8)×109/L,其中4例(50%)低于 50×109/L;PLT 最低为(10~44)×109/L,其中6 例(75%)低于30×109/L。 4 例GI出血发生在ECMO辅助过程中(1例存活),4例发生在ECMO撤离后3 h~3 d(1例存活)。GI出血时使用质子泵抑制剂(proton pump inhibitor,PPI)、H2受体阻滞剂(H2receptor blocker,H2RA)或凝血酶的为5例(62.50%),其中 1例存活;3例未使用相关药物。详见表1。
2.2 转归 70例 ECMO支持患儿的脱机率为58.57%(41例),存活率为 42.86%(30 例),新生儿35.71%(25例),ECPR 32.86%(23例)。 合并 GI出血的为8例(11.43%),脱机率 50%(4例),存活率25%(2例),其中新生儿 37.50%(3例);ECPR 62.50%(5例),其中 2例患儿(ECPR 时间≤45 min)存活出院,3例死亡(ECPR 时间>45 min);有 3例(37.50%)患儿因发生NEC,同时伴有循环功能不稳定,家属要求保守治疗,均无效死亡。2例(25%)脱机后因合并感染和肾衰而死亡;1例(12.50%)主要因ECMO辅助中出现肾功能衰竭,其次是经济因素导致家属放弃治疗;最终仅有2例患儿(25%)存活出院。

表1 8例GI出血患儿的基本信息
2.3 与未出血组相比,GI出血组的脱机率和存活率明显降低,合并肾脏损伤和感染的发生率偏高,但以上差异均没有统计学意义(P>0.05)。两组相比:出血组ECPR的发生率远远高于未出血组(P=0.04),合并脑出血的发生率明显高(P=0.01),每天的RBC输注量偏多(P=0.04),PLT的最低值和平均值均显著低于未出血组(P<0.05)。两组患儿在呼吸机时间、ICU时间、辅助时间和住院时间上没有统计学差异(P>0.05)。 详见表2。
2.4 单因素分析 两组相比显示ECPR、CRP升高、颅内出血、输血量(每天)和PLT较低几个因素与GI出血有关(P<0.05)。 详见表3。
2.5 多元Logistic回归分析 为排除单个危险因素间的交互作用而产生的混杂效应以获得独立的危险因素,本研究进一步对上述单因素分析具有统计学意义的变量行Logistic回归分析,结果提示ECPR和PLT较低为患儿GI出血的独立危险因素。详见表4。
3 讨 论
随着ECMO技术的广泛应用,GI出血的情况时有发生,但其确切病因和发病机制尚未完全阐明。研究表明应激性溃疡是机体在各类严重创伤和危重疾病等应激状态下发生的急性病变[5];NEC是婴儿常见的胃肠道急症,是由尚不成熟的胃肠道对早产、感染、缺血缺氧、喂养和血流等多种因素综合作用的结果[6];CHD也是患儿发生 NEC的危险因素之一[7]。可见,GI出血是多因素联合作用产生的最终反应。
本研究结果提示ECPR患儿GI出血的发生率高达62.5%。预后和ECPR的时间息息相关,时间越长,GI出血的几率越大,预后越差。合并GI出血且ECPR时间大于45 min的患儿无一例存活。分析原因为:机体处于缺血缺氧的应激状态时血液重新分布,胃肠道因血供相对不足发生应激性溃疡和NEC;心脏骤停导致肠道致病菌大量繁殖,产生内毒素并释放炎性介质,引起肠黏膜缺血和再灌注损伤,同时损伤在开奶后进一步加重[8]。本组5例患儿均在ECPR后24 h内开奶,2例在开奶后24 h内发生GI出血。可见缺血缺氧后开奶时间的选择关系到肠道菌群正常定植和微生态失衡,导致患儿易发生GI出血,且预后会更差[9]。所以该类患儿要积极预防并警惕GI出血的发生。

表2 GI出血组和未出血组的比较

表3 ECMO期间GI出血患儿的单因素分析
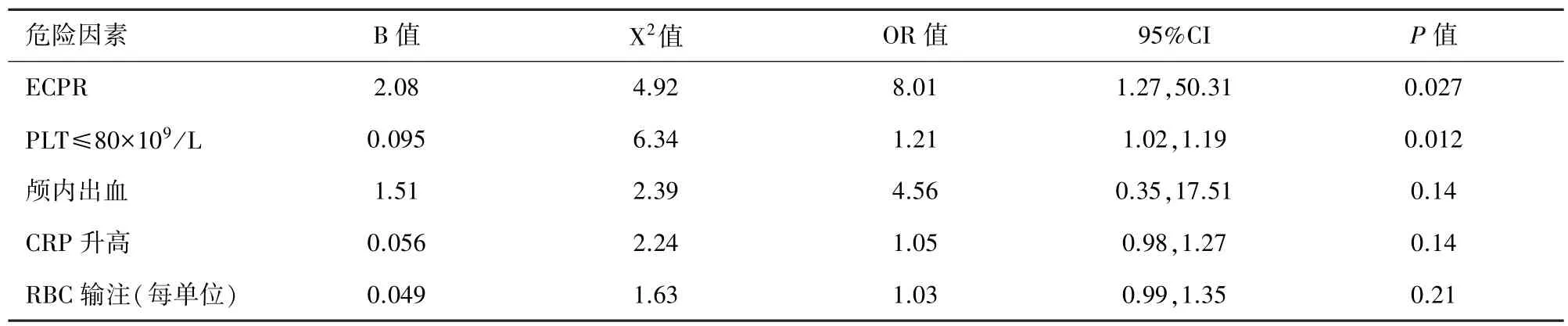
表4 ECMO期间GI出血患儿的多因素logistic回归分析
本组3例NEC患儿是新生儿,其中1例为孕33周的早产儿。研究显示90%~95%的NEC发生于出生胎龄小于36周的早产儿和低出生体重儿,严重的NEC都常是两种或以上的危险因素综合作用的结果[10]。NEC中90%以上的患儿都是在肠道喂养后发病,不适当的肠内喂养会增加NEC发病率[11]。文献认为喂养因素(种类、速度和浓度)与NEC的发生有内在联系,因为新生儿消化系统发育不成熟,易受到缺血损伤;消化酶活性较低,若喂养不当(增量快、配方奶渗透浓度高),不完全消化的产物积聚在肠道就是细菌成长的良好环境[12-15]。
患儿喂养和感染是NEC的主要病因,感染最重要[16-18]。本研究中GI出血合并血培养阳性菌的发生率为62.50%。本组患儿培养出来的克雷伯杆菌、表皮葡萄球菌等是致病力很强的肠道细菌,它们和病毒一起引发肠道致病菌的大量增殖,最终诱发肠壁的炎症反应。研究报道白细胞减低、CRP增高及PLT减少(<100×109/L)是NEC的婴幼儿病情重、预后不良的标志[19]。本组患儿感染时均伴白细胞计数的变化、降钙素原的升高(无特异性),但出血组PLT计数下降(<60×109/L)的更为明显。 这可能由于感染是引起NEC发生的高危因素,PLT下降时肠黏膜受损严重,坏死出血较多;若同时伴有凝血功能异常则感染更严重,预后较差。
综上所述,GI出血是影响ECMO患儿预后的危险因素,ECPR和PLT计数低是GI出血的主要危险因素。ECMO过程中应高度重视这些因素,早期干预,对降低此类患儿的死亡率和改善预后有一定的帮助。

