补骨脂的不同提取物对大鼠毒性的初步研究*
王昭昕 杨 莉 卢国彦 王跃飞 张 玥,2 周 昆,2
(1.天津中医药大学中医药研究院, 天津 300193)(2.天津中医药大学方剂学教育部重点实验室,天津 300193)
补骨脂是传统中药材,为豆科植物补骨脂PsoraleacorylifoliaL.的干燥成熟果实,含香豆素类、黄酮类和单帖酚类等化合物[1],具有补肾助阳、纳气平喘、温脾止泻的功能,外用可治牛皮癣、斑秃、银屑病等皮肤病;补骨脂应用广泛,仅药典中收载的含补骨脂的中成药就有30余种,其他标准和临床医师处方中就更多。补骨脂最早见于《雷公炮灸论》云:“性本大燥,毒。”后世医家对补骨脂也有论述,《开宝本草》云:“治五劳七伤,风虚冷,骨髓伤败,肾冷精流及妇人血气堕胎。”但对其毒性记载甚少。近年来,随着医药科学的发展,人们对补骨脂的研究也越来越深入,临床不良反应以及毒性研究的报道也越来越多,补骨脂药材乃至水提物对动物的肝毒性也被不同的实验证实[2-6],但是中药的提取方式众多,获取的提取物的成分和安全性也会有差别,我们对补骨脂的三种不同提取物进行了口服给药4周的大鼠毒性实验研究,以评价不同提取物的安全性,为后续补骨脂提取工艺的改进和入药的选择提供前期研究基础。
1 材料与方法
1.1 受试样品
补骨脂药材(原药材)、补骨脂生药粉、补骨脂下层渗漉液、补骨脂上层渗漉液、补骨脂渗漉药渣:均为天津中医药大学中医药研究院王跃飞副研究员团队制备提供,产品批号:20120920。
补骨脂生药粉:补骨脂药材直接粉碎,制成的棕色补骨脂生药粉;
补骨脂下层渗漉液(每克提取物折合生药2.66 g):补骨脂原药材经70%乙醇浸泡后渗漉,渗漉液减压回收,静置分层,稠浸膏与环糊精混合制得补骨脂提取物;
补骨脂上层渗漉液(每克提取物折合生药18.43 g):补骨脂原药材经70%乙醇浸泡后渗漉,渗漉液减压回收,静置分层,上层60 ℃减压烘干,制得渗漉上层干膏提取物。
补骨脂渗漉药渣(每克提取物折合生药1.18 g):补骨脂原药材经70%乙醇浸泡后渗漉,渗漉药渣再次水提,60 ℃减压烘干,制得渗漉药渣提取物。各受试样品成分含量如下(表1)。
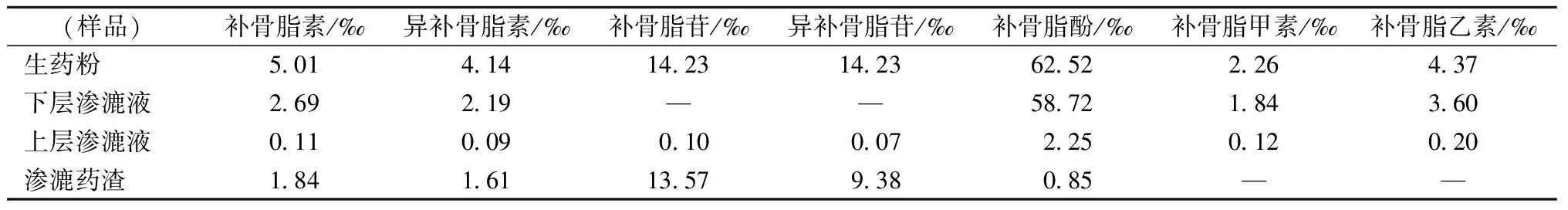
表1 受试样品成分含量Table 1 Contents of the components of the test sample
1.2 动物及饲养
SPF级SD大鼠112只,雌雄各半,购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2009-0015。动物饲养于天津中医药大学实验动物中心,使用许可证号:SYXK(津)2014-0002。所用饲料为全价颗粒饲料,天津市华荣实验动物科技有限公司生产。
1.3 试剂与仪器
TBA(总胆汁酸)、CRE(血清肌酐)、TC(总胆固醇)、TG(甘油三酯)、TP(总蛋白)、ALT(天冬氨酸氨基转氨酶)、ALP(碱性磷酸酶)、ALB(白蛋白)、BUN(尿素氮)以及AST(丙氨酸氨基转换酶)试剂盒均由中生北控生物科技股份有限公司生产。
丙二醛(MDA)测定试剂盒(TBA法)、总抗氧化能力(T-AOC)检测试剂盒(比色法)均由南京建成生物工程研究所生产。
离心机(赛默飞,Legend Micro17型);恒温培养振荡器(上海世平实验设备有限公司,SPH-103B型);全自动封闭脱水机(Leica,ASP300S型),切片机(Leica,RM2135型);显微镜(OLYMPUS,BX51型);包埋机(天津航空机电公司,BMJ-1型);多功能酶标仪(Tecan,InfiniteM200型);全自动生化分析仪(日立,7020型)。
1.4 方法
具体实验方法参考了文献[4]中描述的中药长期毒性实验方法。
1.4.1分组与给药:将大鼠按体质量、性别随机分为8组:对照组(对照组与补骨脂水提物与水提药渣的毒性比较研究相同)、补骨脂生药3 g生药/kg剂量组,补骨脂下层渗漉液6 g生药/kg、3 g生药/kg剂量组,补骨脂上层渗漉液6 g生药/kg、3 g生药/kg剂量组,补骨脂渗漉药渣6 g生药/kg、3 g生药/kg剂量组,每组14只,连续灌胃给药4周,最大给药剂量为2015版药典规定给药剂量的6倍。
1.4.2一般状况观察:给药期间,每周称体质量一次,并根据体质量调整给药剂量;每天给药前后观察动物的毛色、进食、活动等情况。
1.4.3血清生化检测:给药期结束,动物禁食不禁水12 h,腹腔注射水合氯醛进行麻醉。由腹主动脉取血,3 000 r/min离心10 min,分离得到血清,通过自动生化仪检测TBA、CRE、TC、TG、TP、ALT、ALP、ALB、BUN、AST。
1.4.4MDA和T-AOC的含量测定:肝脏加生理盐水研磨制备10%的匀浆,用南京建成T-AOC和MDA试剂盒测定大鼠肝脏中T-AOC和MDA的含量。
1.4.5脏器系数及组织病理学检查:剖腹小心摘取心脏、肝脏、肾脏、脾脏、胸腺称重,计算脏器系数(脏器质量/体质量)。切取大鼠肝脏一叶、左肾于10%中性甲醛溶液中固定,固定液为组织体积的5~10倍,固定48 h,石蜡切片,常规 HE染色,光镜下观察组织病变。
1.5 统计方法

2 结果
2.1 对大鼠一般情况和体质量的影响
给药期间,大鼠进食、活动情况正常,毛色无异,各组动物均无死亡。补骨脂不同提取物灌胃给药4周对大鼠体质量的影响如下(表2,表3):与对照组相比,雄性大鼠下层渗漉液高剂量组在第2周体质量显著降低;雌性大鼠渗漉药渣高剂量组第4周的体质量显著升高,其他组无显著变化。
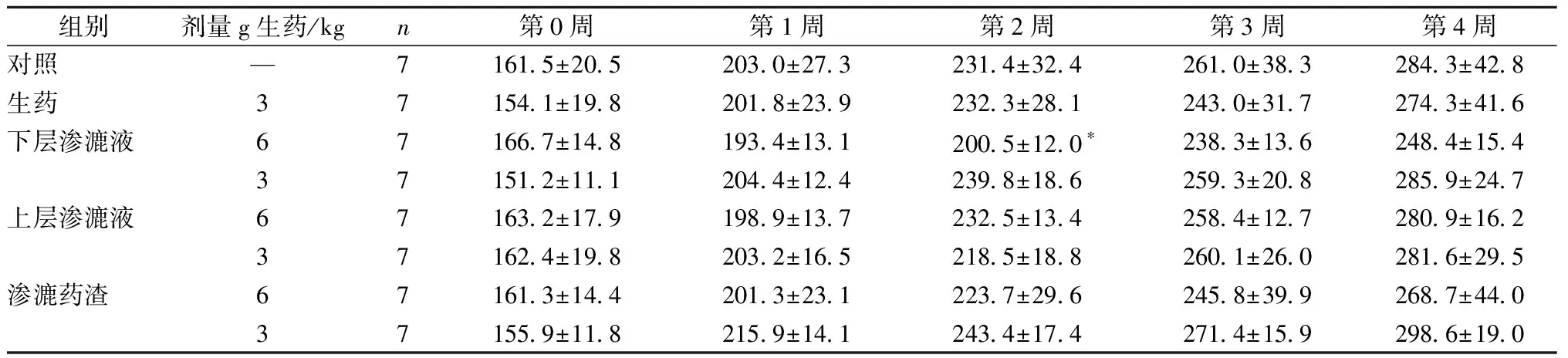
表2 不同提取物的补骨脂对雄性大鼠体质量的影响Table 2 Effects of Psoralen from different extractions on Body Weight of Male Rats
注:与对照组比较,*P<0.05
Note:*P<0.05 vs control group
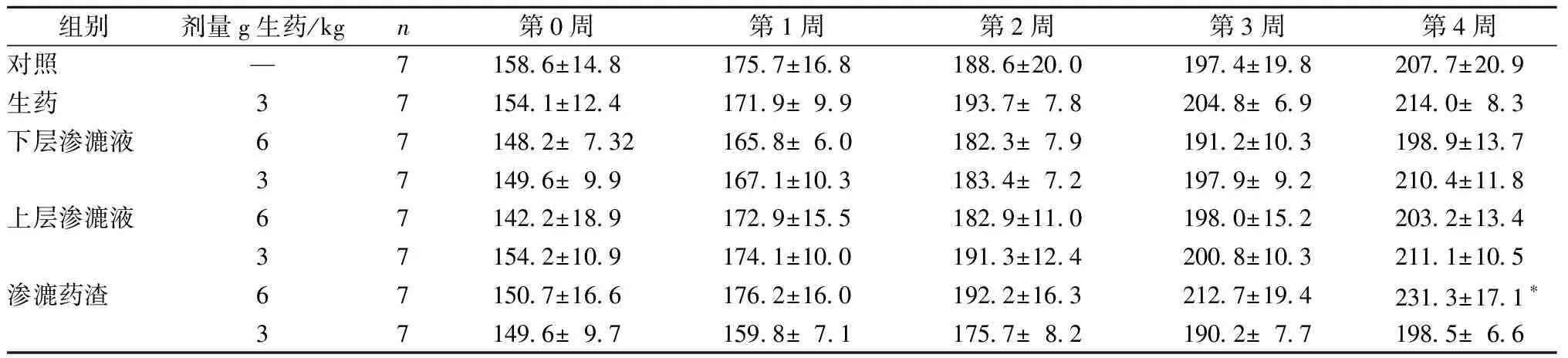
表3 不同提取物的补骨脂对雌性大鼠体质量的影响Table 3 Effects of Psoralen from different extractions on Body Weight of Female Rats
注:与对照组比较,*P<0.05
Note:*P<0.05 vs control group
2.2 对大鼠血清生化影响
与对照组比较,雄性大鼠生药组ALT、ALP、TBA、T-CHO、ALB显著降低;下层渗漉液高剂量组ALT、BUN显著升高,T-CHO、ALB显著降低;下层渗漉液低剂量组TBA、TG、T-CHO显著降低;渗漉药渣低剂量组ALT、TBA、ALB显著降低;上层渗漉液高、低剂量组、渗漉药渣高剂量组无显著性差异。雌性大鼠生药低剂量组ALP显著升高;下层渗漉液高剂量组BUN显著升高,ALB显著降低;下层渗漉液低剂量组ALT显著升高,CRE显著降低;上层渗漉液高剂量组BUN显著升高;渗漉药渣高剂量组ALT、AST显著降低,TBA、T-CHO、BUN显著升高;渗漉药渣低剂量组TP显著升高(表4,表5)。
2.3 对大鼠肝脏MDA和T-AOC的影响
与对照组比较,雄性大鼠生药低剂量组,渗漉药渣高剂量组MDA显著升高;下层渗漉液高、低剂量组,渗漉药渣低剂量组T-AOC显著升高。雌性大鼠生药低剂量组,渗漉药渣高剂量组MDA显著升高,T-AOC显著降低;下层渗漉液高剂量组T-AOC显著降低;渗漉药渣低剂量组MDA显著降低,T-AOC显著降低(见表6,表7)。
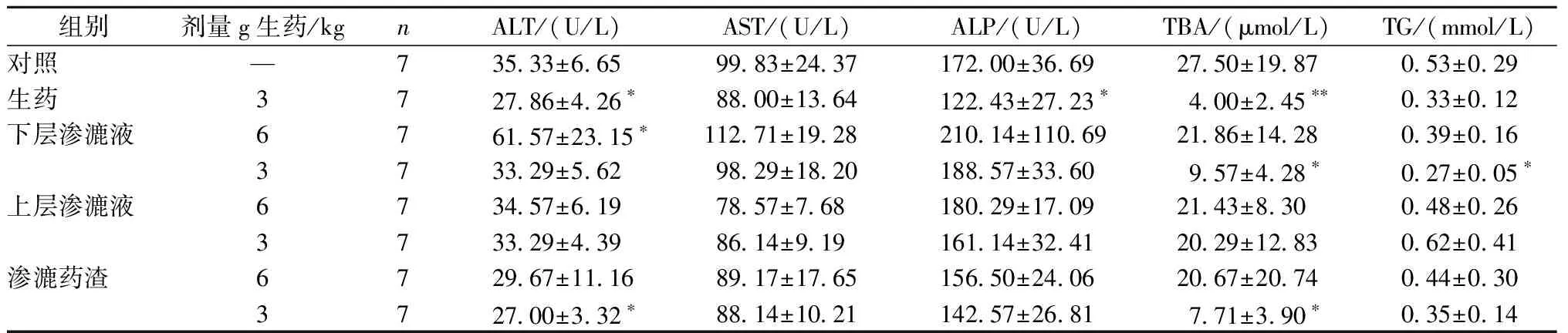
表4 不同提取物的补骨脂对雄性大鼠血清生化指标的影响(一)Table 4 Effects of Psoralen from different extractions on serum biochemical parameters in Male Rats(1)
注:与对照组比较,*P<0.05,**P<0.01
Note:*P<0.05,**P<0.01 vs control group
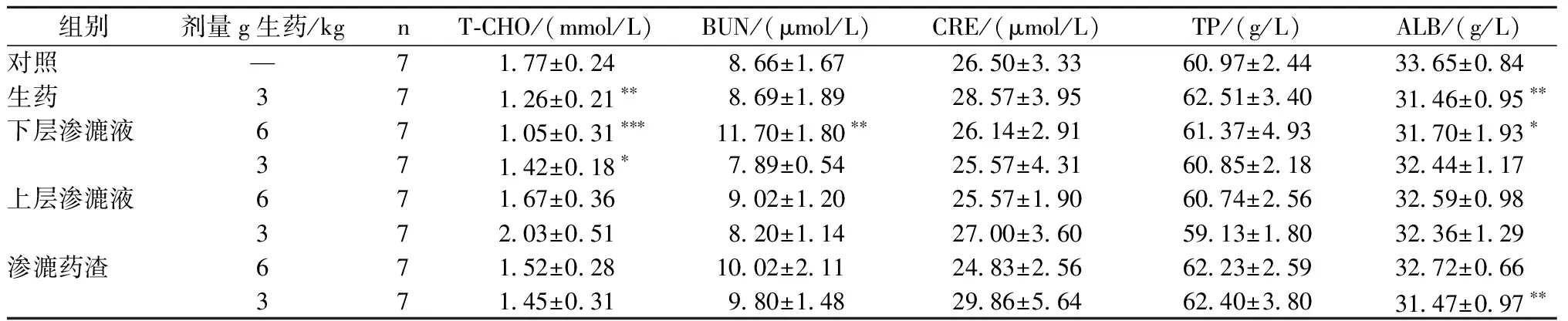
表4 不同提取物的补骨脂对雄性大鼠血清生化指标的影响(二)Table 4 Effects of Psoralen from different extractions on serum biochemical parameters in Male Rats(2)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
Note:*P<0.05,**P<0.01,***P<0.001 vs control group
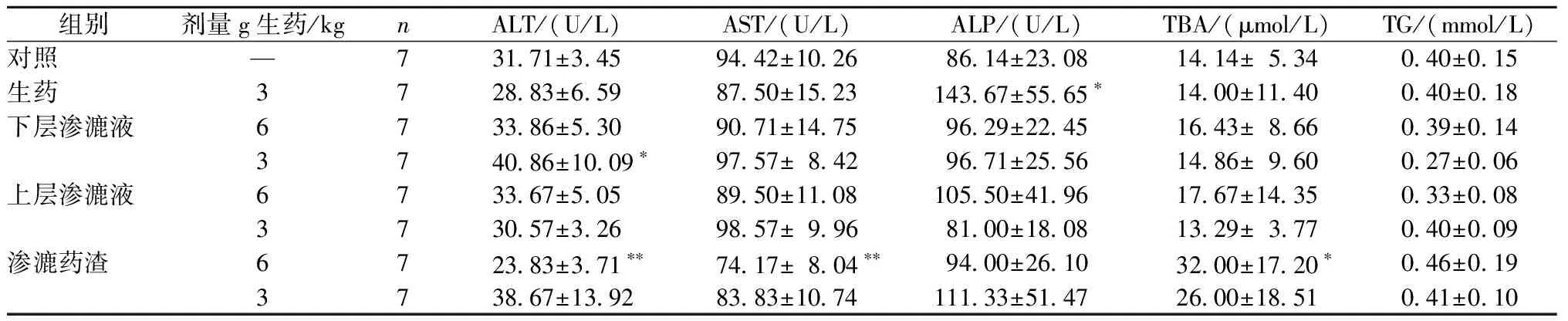
表5 不同提取物的补骨脂对雌性大鼠血清生化指标的影响(一)Table 5 Effects of Psoralen from different extractions on serum biochemical parameters in Female Rats(1)
注:与对照组比较,*P<0.05,**P<0.01
Note:*P<0.05,**P<0.01 vs control group
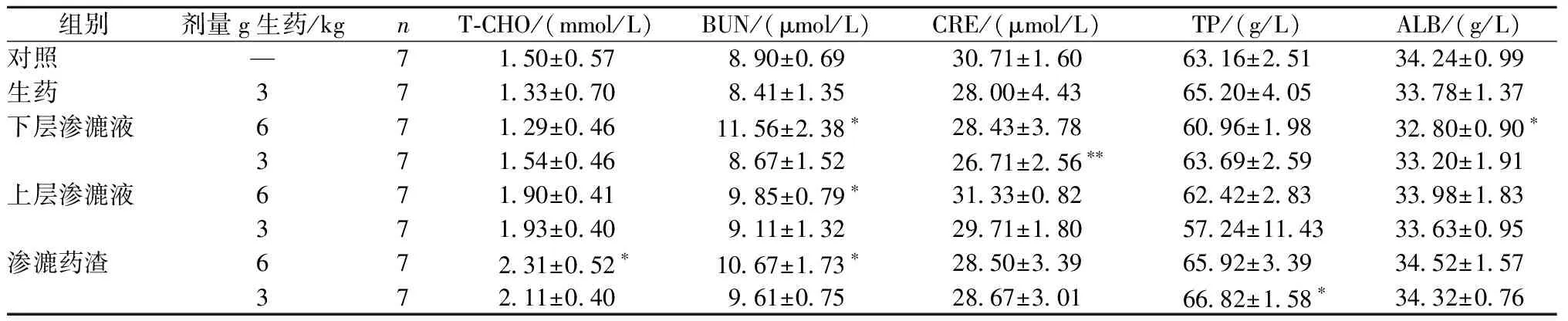
表5 不同提取物的补骨脂对雌性大鼠血清生化指标的影响(二)Table 5 Effects of Psoralen from different extractions on serum biochemical parameters in Female Rats (2)
注:与对照组比较,*P<0.05,**P<0.01
Note:*P<0.05,**P<0.01 vs control group

表6 不同提取物的补骨脂对雄性大鼠MDA的影响Table 6 Effects of Psoralen from different extractionson MDA in Male Rats
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
Note:*P<0.05,**P<0.01,***P<0.001 vs control group
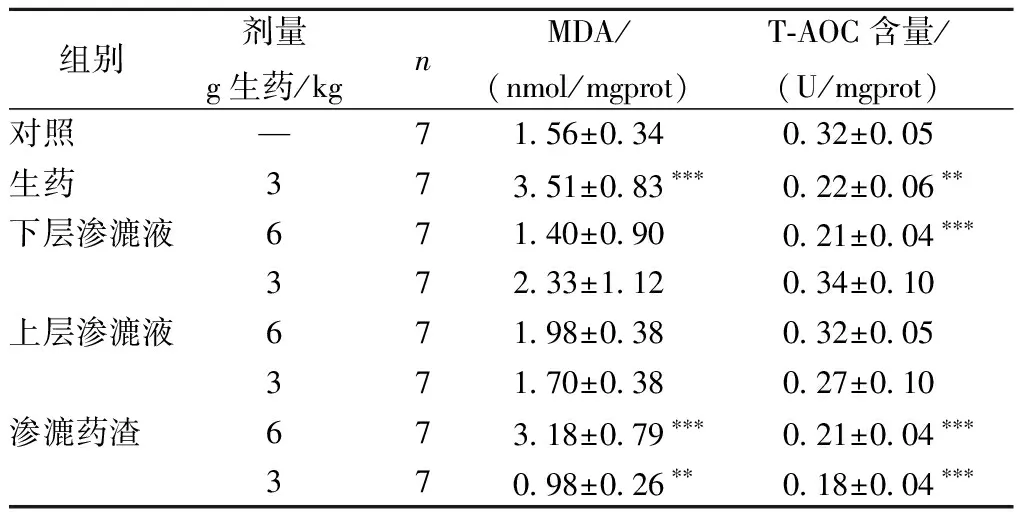
表7 不同提取物的补骨脂对雌性大鼠MDA的影响Table7 Effects of Psoralen from different extractionson MDA in Female Rats
注:与对照组比较,**P<0.01,***P<0.001
Note:**P<0.01,***P<0.001 vs control group
2.4 对大鼠脏器系数及组织病理学的影响
与对照组相比,雄性大鼠生药低剂量组胸腺系数显著降低而肝、肾系数显著升高;下层渗漉液高剂量组,渗漉药渣高、低剂量组肝、肾系数显著升高而胸腺系数显著降低。雌性大鼠下层渗漉液低剂量组,渗漉药渣低剂量组肝、肾系数显著升高而胸腺系数显著降低;生药低剂量组,渗漉药渣高剂量组肝、肾系数显著升高;下层渗漉液高剂量组肝系数显著升高而胸腺系数显著降低;上层渗漉液低剂量组肝系数显著升高,其他各组的值比较差异不具有统计学意义(见表8,表9)。
光镜下观察,给药组大鼠的肝脏、肾脏和生殖器官未见明显的组织病变,与对照组无明显差别。
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
Note:*P<0.05,**P<0.01,***P<0.001 vs control group
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
Note:*P<0.05,**P<0.01,***P<0.001 vs control group
3 讨论
本实验为研究不同提取物补骨脂大鼠口服给药毒性,分别设立对照组、补骨脂生药组,补骨脂下层渗漉液低、高剂量组,补骨脂上层渗漉液低、高剂量组,补骨脂渗漉药渣低、高剂量组。实验所需补骨脂生药和不同提取物的最大给药量为2015版药典规定的6倍。实验结果表明:与对照组相比,补骨脂生药组肝脏脏器系数、ALP、MDA明显升高,胸腺脏器系数、T-AOC显著降低,再次证明补骨脂生药给药4周即对大鼠肝脏有一定的损伤。补骨脂下层渗漉液组肝脏脏器系数、T-AOC、ALT也显著升高,表明补骨脂下层渗漉液也对肝脏有一定的损伤,但雄性大鼠T-AOC值明显升高;补骨脂渗漉药渣高剂量组肝脏脏器系数、MDA显著升高而雌性大鼠T-AOC值显著降低;表明补骨脂渗漉药渣高剂量给药4周对肝脏有一定的损伤,而渗漉药渣低剂量组并没有肝、肾毒性指标出现显著性,表现出较好的剂量相关性;补骨脂上层渗漉液没有明显毒性。总结实验结果也显示三种不同提取物中渗漉药渣的肝毒性最大,其次为下层渗漉液,上层渗漉液的安全性最高。
对三个不同提取物中有效成分的含量测定结果显示,补骨脂上层渗漉液中有效成分的含量极少,其中含量最多的补骨脂酚也只有2.26‰,渗漉药渣中含有较多的补骨脂苷和异补骨脂苷,而补骨脂酚含量极少仅0.58‰,因此二者不适合用作药用;而下层渗漉液中没有检测到补骨脂苷和异补骨脂苷,补骨脂素、异补骨脂素的含量也不多,但补骨脂酚的含量高达58.72‰,有研究认为,补骨脂苷、异补骨脂苷、补骨脂素、异补骨脂素是补骨脂中的主要毒性成分[4]。白茹玉等[8]研究结果表明,大剂量补骨脂素给予小鼠时,引起药物急性毒性反应;异补骨脂素可引起 HepG2 细胞内胆汁酸升高和细胞毒性[9];还有研究表明异补骨脂素和补骨脂素对小鼠肝功能有一定影响[10];补骨脂乙素可抑制Tca8113细胞的增殖并诱导细胞凋亡[11]。同时,已有研究证实补骨脂素和异补骨脂素对小鼠骨质疏松有较好的治疗作用[12],刘颖等[13]的研究表明,补骨脂对维甲酸诱导的大鼠骨质疏松有治疗作用。而补骨脂酚是毒性相对较小有效成分,有抗菌、抗肿瘤、降糖降血脂、抗氧化、消炎、雌激素样等作用[14-18]。综上,下层渗漉液更合适入药。当然,这一结论尚需更多的药效和安全性评价研究来支持。

