高产洛伐他汀红曲菌的筛选及菌种共酵对红曲固态发酵的影响
朱 蕊,彭 林,刘双平,2,韩 笑,2,毛 健,2,*
(1.江南大学食品学院,食品科学与技术国家重点实验室,粮食发酵工艺与技术国家工程实验室,江苏无锡 214122;2.江苏省产业技术研究院食品生物技术研究所,如皋江大食品生物技术研究所有限公司,江南大学(如皋)食品生物技术研究所,江苏如皋 226500)
红曲菌是一种具有我国传统特色的丝状真菌,经固态发酵得到的产物为红曲[1]。红曲作为中国传统的药食兼用天然制品,广泛应用于食品、医药、保健品等行业[2],多将紫色红曲菌用于生产[3]。红曲菌发酵能够产生多种对人体有益的代谢产物[4-8],其中洛伐他汀具有很强的降胆固醇、降血脂的保健作用[9]。
目前我国洛伐他汀的生产主要来源于红曲菌发酵,红曲的固态发酵相比于液态发酵节省了发酵后期的分离纯化工作,更安全且容易吸收,可以直接通过食用达到治疗目的[10-11]。红曲的发展方向多集中于红曲菌菌种选育、优化培养参数提高红曲中洛伐他汀的含量,降低生产成本[1,12-13]。近年来有学者研究发现添加一些外源诱导物可以促进洛伐他汀的合成[14-16],Sun等[17]发现通过添加真菌诱导剂-掷孢酵母滤液可以提高液态发酵的洛伐他汀产量,当酵母滤液在第4 d加入时,最高产量可达446.92 mg/L。研究表明[18],因为培养条件相似,红曲菌与酵母菌、乳酸菌或其他真菌诱导子通过共酵的培养方式能使次级代谢产物的产量有所提高,这提示其他微生物代谢的某些酶或是产物可能对红曲菌生长及洛伐他汀的积累有促进作用。
因此本文在市售红曲中筛选出高产洛伐他汀紫色红曲菌的基础上,利用特性较优的紫色红曲菌株固态发酵生产红曲,采用不同菌种与其共酵的方式进一步优化其洛伐他汀产量,筛选出共酵优秀菌株,并初步探究其诱导机理,为深度开发药食兼用的功能性红曲提供更多参考。
1 材料与方法
1.1 材料与仪器
红曲样品 从福建宁德、浙江温州、广东丽水等地采集市售红曲样品10份;籼米 市售;克鲁斯假丝酵母Y6、酿酒酵母SY、枯草芽孢杆菌4-LCW、植物乳杆菌X5、米曲霉P7、黄酒酵母S2-1392、酿酒酵母2.2084、毕赤酵母S12、热带假丝酵母CS8、贝酵母S.bay 均为本实验室筛选保藏菌株,来源如表1所示;马铃薯葡萄糖水培养基、马铃薯葡萄糖琼脂(PDA)、麦芽汁琼脂(MEA)、察氏培养基(CYA) 广东环恺威生物科技有限公司;洛伐他汀(纯度≥98%) Sigma公司。

表1 不同菌种及其来源
YXQ-LS-50SI型立式压力蒸汽灭菌器 上海博讯医疗生物仪器股份有限公司;PRX-450C型智能人工气候箱 宁波赛福实验仪器有限公司;SW-CJ系列超净工作台 苏州安泰空气技术有限公司;UV-1800型紫外-可见分光光度计 上海美谱达仪器有限公司;Waters e2695高效液相色谱系统(配有2489紫外检测器及Empower 2色谱工作站) 美国沃特世公司。
1.2 实验方法
1.2.1 红曲筛选分离源指标检测 选取来自福建、广东、浙江等不同来源的10份市售红曲米作为筛菌的分离源,初步评价市售红曲,与后续实验中纯种制曲比较,利用高效液相色谱法测定市售红曲中的洛伐他汀含量,紫外分光光度法测定其色价,实验重复3次取平均值。
1.2.2 产洛伐他汀红曲菌的筛选及鉴定
1.2.2.1 红曲菌的筛选 称取5 g红曲样品,在无菌研钵中研磨成粉末后置于95 mL带玻璃珠的无菌生理盐水的三角瓶中,在摇床上振荡30 min后进行梯度稀释。吸取0.1 mL涂布于PDA平板上,28 ℃培养3~4 d,用无菌接种环挑取单个菌落转接至新的PDA平板,经过反复分离纯化,得到具有红曲菌基本特征的较纯菌株,鉴定完毕后甘油管保藏至-80 ℃。
1.2.2.2 菌落形态观察 参考《红曲菌的形态与分类学》[19],采用三点接种法将菌株分别点种于MEA、PDA和CYA培养基上,25 ℃培养7 d,观察菌落的形态特征,包括菌落的正反面颜色、质地、边缘等。
1.2.2.3 分子生物学鉴定 以提取的红曲菌总DNA[20]为模板,利用真菌ITS通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCC GCTTATTGATATGC-3′)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,PCR扩增的反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃延伸10 min。所得产物送至生工生物工程(上海)股份有限公司进行测序,测序所得的序列信息利用BLAST程序在GenBank核酸数据库中进行相似性比对,利用MEGA6.0软件对所测红曲菌与序列同源性高的模式菌株的基因序列进行多序列比对分析,利用Neighbor-Joining邻接法构建系统进化树。
1.2.3 菌种培养 红曲菌菌株活化:用无菌接种环刮取保藏管里的菌种划线于麦芽汁斜面上。28 ℃培养5~7 d,培养至红曲菌长出孢子。
固态发酵:用0.1%无菌吐温水洗下斜面上的孢子,30 g籼米浸泡2 h后转入250 mL锥形瓶,封口后于121 ℃,0.08 MPa灭菌20 min后,趁热将米粒拍散,接种106个孢子/g(大米干重)接种于冷却至室温的固态发酵培养基,补加无菌水调节含水量在40%~50%;拌匀后使培养基堆至瓶内一角,28 ℃静置培养48 h后摇散、摊平;此后每24 h摇瓶1~2次,直到14 d发酵结束。利用高效液相色谱法测定红曲固态发酵产物中的洛伐他汀含量,紫外分光光度法测定其色价,实验重复3次取平均值。
1.2.4 菌种共酵
1.2.4.1 红曲菌共酵菌种活化 分别选取1.1中列举的实验室保藏菌株于马铃薯葡萄糖液体培养基中进行活化,28 ℃活化24 h至培养基浑浊。
1.2.4.2 红曲菌与不同菌种共发酵 按照1.2.3中固态发酵法制备红曲,同时将活化后的菌种菌液以2%接种量接入固态发酵培养基与红曲菌进行共酵实验,以红曲菌H8-2纯种发酵作为对照组。利用高效液相色谱法测定红曲固态发酵产物中的洛伐他汀含量,紫外分光光度法测定其色价,实验重复3次取平均值。
1.2.5 添加不同酵母诱导剂的研究 根据1.2.4的实验结果,选择酿酒酵母2.2084为共酵菌株,以此制备不同酵母诱导剂。酵母菌液:将酿酒酵母28 ℃摇瓶培养24 h取样;酵母发酵液:将上述酿酒酵母摇瓶24 h后的菌液,4 ℃条件下8000 r/min离心所得上清液;高温灭菌液:酵母培养24 h后,100 ℃高温灭菌20 min;酵母破壁液:将酿酒酵母28 ℃摇瓶培养24 h后,4 ℃条件下8000 r/min离心后用无菌水洗涤菌体,重复两次,将酵母菌体置于含有石英砂的灭菌研钵中研磨10 min,吸取至2 mL离心管中4 ℃条件下8000 r/min离心,所得上清液为酵母破壁液。按照1.2.3中固态发酵法制备红曲,同时将酵母诱导剂以2%接种量接入固态发酵培养基与红曲菌进行共酵实验,以红曲菌H8-2纯种发酵作为对照组。利用高效液相色谱法测定红曲固态发酵产物中的洛伐他汀含量,紫外分光光度法测定其色价,实验重复3次取平均值。
1.2.6 洛伐他汀的检测 参考文献[21]检测方法,在实验室条件下进一步优化,采用HPLC法,称取红曲粉0.5 g置于50 mL离心管中,加入甲醇30 mL,50 ℃振荡水浴2 h,摇匀,常温条件下8000 r/min离心5 min,取上清液过0.22 μm微孔滤膜。
色谱条件:色谱柱:Athena C18-WP(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%的磷酸水溶液(65∶35,V/V);流速:1.0 mL/min;紫外检测波长:238 nm;进样量:5 μL;柱温:(30.0±0.5) ℃。以70%乙醇溶液配制400 mg/L的洛伐他汀标准储备液,等比稀释制得浓度分别为3.125、6.25、12.5、25、50、100、200、400 mg/L的洛伐他汀标准工作液,进行外标定量。标曲线性方程为:y=3.64×104x-2.35×105,决定系数R2=0.9912。
1.2.7 色价的测定 采用紫外分光光度计法,参考国标GB 4926-2008《食品添加剂 红曲米(粉)》。
1.3 数据分析
实验操作重复三次,采用Excel进行数据计算,采用Graphpad Prism 7软件进行分析绘图。
2 结果与分析
2.1 高产洛伐他汀红曲菌的筛选和鉴定
2.1.1 红曲菌筛选分离源指标检测 对取样红曲样本进行初步评价,由表2可知,取样的这些市售红曲洛伐他汀含量较低,基本在1.8~3.5 mg/g之间,色价质量参差不齐,洛伐他汀产量和色价之间无必然联系。
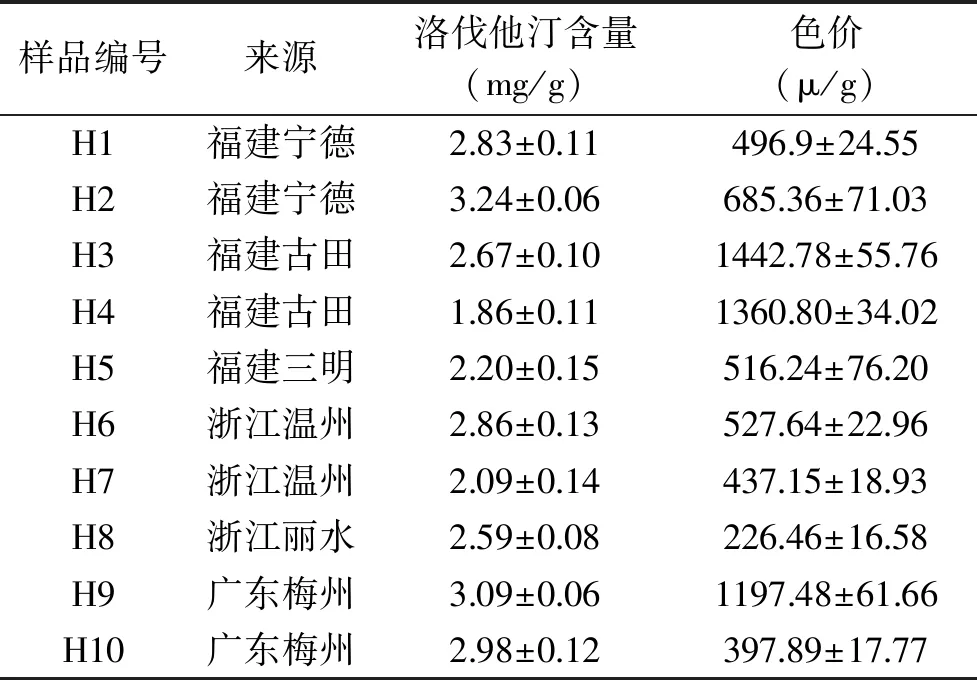
表2 红曲分离源指标检测结果
2.1.2 红曲菌株筛选结果 红曲菌是一种腐生菌,其生长适应的温度范围很广,最适温度为25~30 ℃,能利用多种碳源和氮源生长。相较于其他菌,红曲菌生长比较缓慢,因此采用比较普适的PDA培养基平板,在28 ℃下培养5~6 d进行筛选。通过梯度稀释及反复分离纯化,从上述2.1.1的10份红曲米中分离疑似霉菌菌株的纯培养菌株21株。
根据进一步形态观察,并以产红色素的菌株为挑选标准,选取菌落呈现红色并具有红曲菌典型特征的菌株进一步筛选,共得到10株红曲菌菌种,分别命名为H1-4、H4-2、H4-4、H6-2、H6-3、H7-2、H8-1、H8-2、H9-2、H10-1。
2.1.3 红曲菌的固态发酵特性比较 为筛选得到高产洛伐他汀的红曲菌,本研究对2.1.2中筛选得到的10株红曲菌进行了固态发酵实验,并检测发酵后红曲中洛伐他汀的含量和色价。如图1菌株H8-2的洛伐他汀产量明显高于其他菌株(图1a),色价结果也较优(图1b)。为进一步确定菌株H8-2的发酵稳定性,本研究利用菌株H8-2连续发酵三次后(表3),得到洛伐他汀产量基本稳定,均值达到9.79 mg/g(干重),色价可达1805.43 μ/g,发酵制备的红曲质量远高于2.1.1中菌种来源的市售红曲。说明利用H8-2菌株纯种制曲可得到高产洛伐他汀的红曲,故确定菌株H8-2为后续实验的供试菌株。
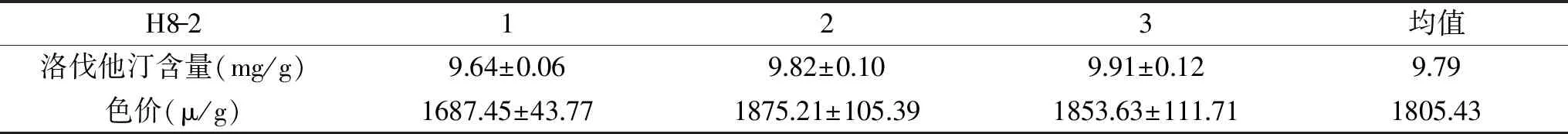
表3 菌株H8-2固态发酵情况
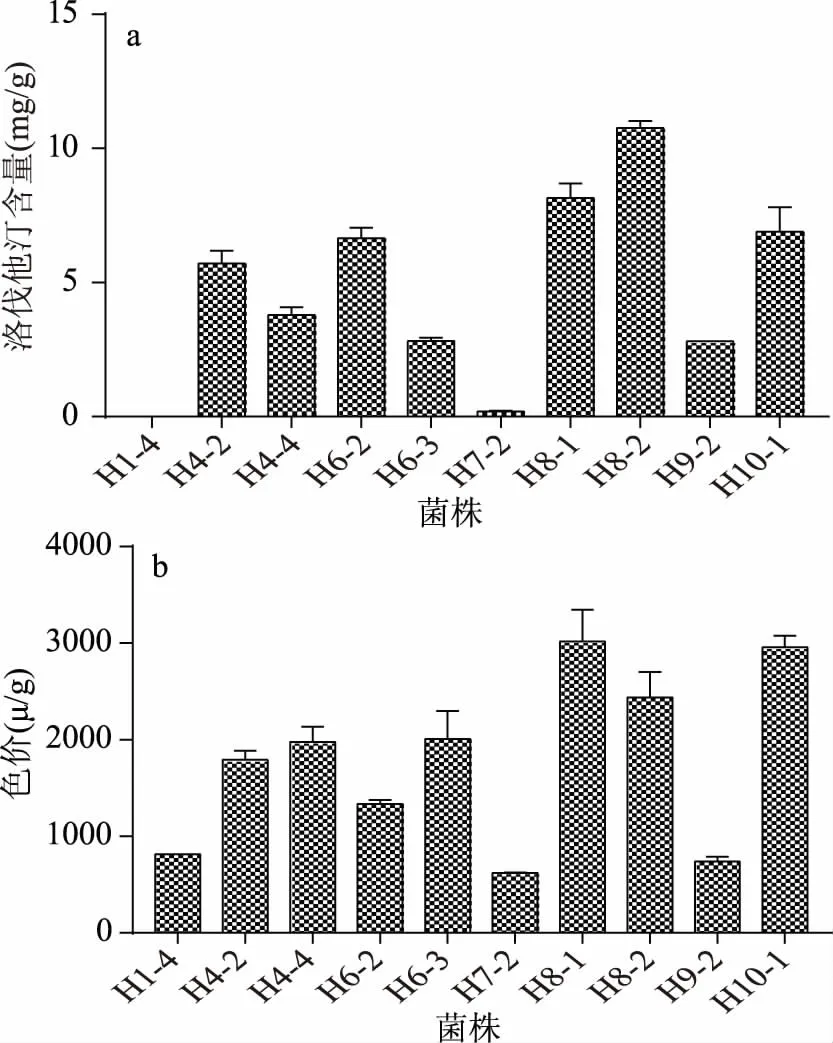
图1 红曲菌菌固态发酵洛伐他汀产量(a)和色价(b)比较
2.1.4 菌株H8-2的鉴定
2.1.4.1 形态观察 将菌株H8-2分别点种于MEA、PDA和CYA培养基上,25 ℃培养7 d。在相同培养条件下这10株红曲菌菌落形态差异很小,其典型菌株形态如图2所示,红曲菌在MEA平板上生长状况最好,明显优于PDA平板和CYA平板,在MEA平板上红曲菌菌落呈绒毡状,有浅色且短的气生菌丝,背面呈现出放射状辐射纹,菌丝体开始为白色,随菌落成熟而变成橙红色至深红色,菌落略微隆起,边缘不整齐。PDA平板上生长状况次之,红曲菌生长速度较慢,放射状辐射波纹减少。CYA培养基上生长状况最不理想,生长速度最慢,未见放射状辐射波纹,菌落颜色也较浅,呈粉色。参考《真菌鉴定手册》[22],并根据《红曲菌的形态与分类学》[19]进行检索,对红曲菌进行初步观察,鉴定菌株为紫色红曲菌。
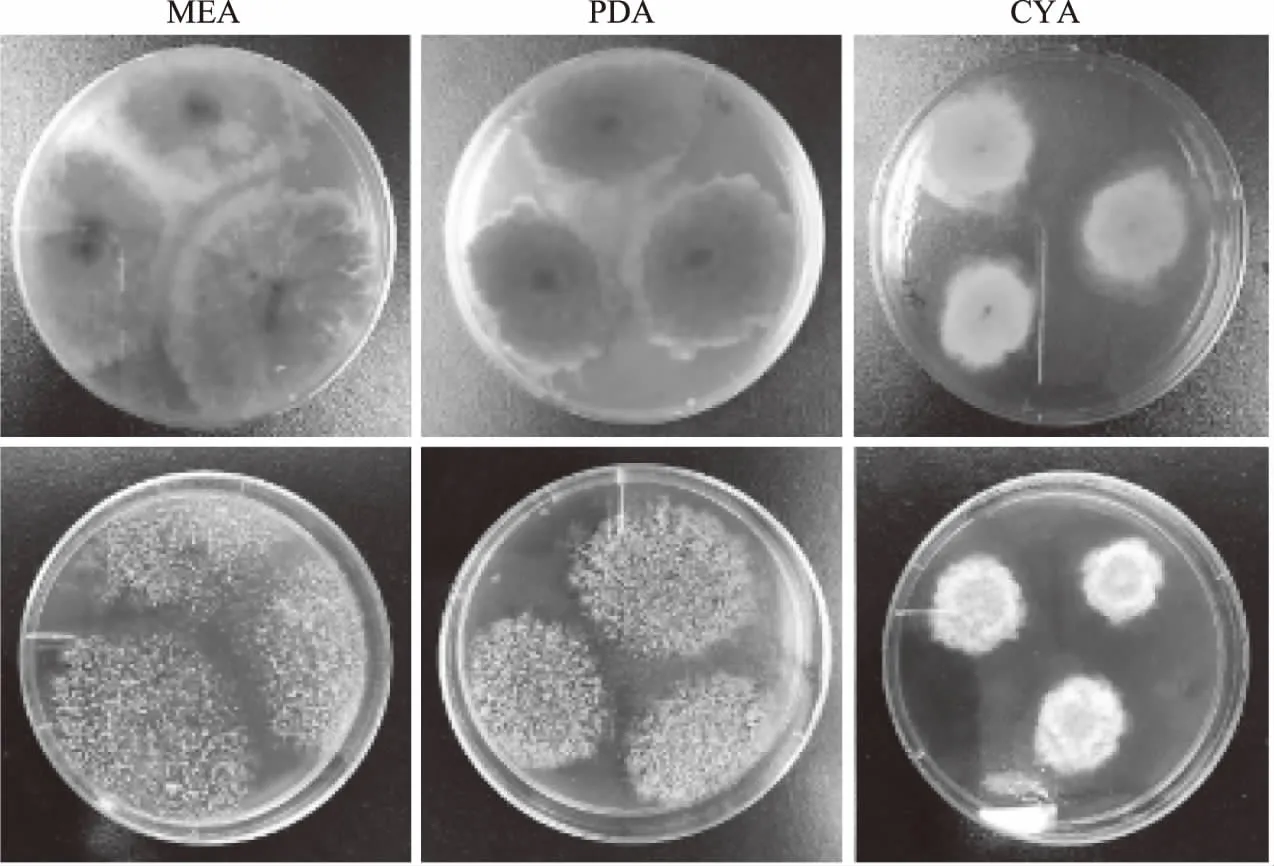
图2 红曲菌株H8-2在不同培养基上的菌落形态
2.1.4.2 分子生物学鉴定 菌株H8-2的rDNA-ITS PCR产物的琼脂糖凝胶电泳鉴定结果如图3所示,扩增产物长度在500~700 bp之间,条带明亮单一,说明特异性扩增良好。扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序后将得到的受试菌基因序列经校对和拼接后在NCBI上比对发现与紫色红曲菌MonascuspurpureusJCM 6934的同源性达99%以上,构建系统进化树(图4)。结合形态学观察,基本可以将此红曲菌种鉴定为紫色红曲菌(Monascuspurpureus)。该菌种是在食品中使用最广泛的红曲固态发酵菌种。
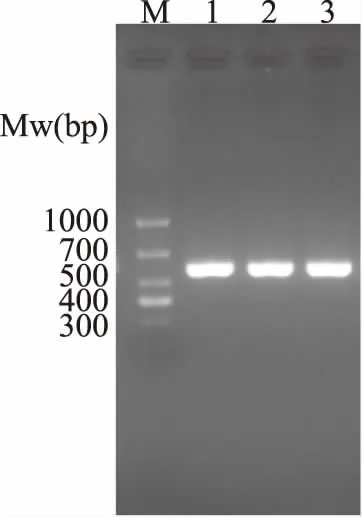
图3 红曲菌株H8-2的rDNA-ITS PCR产物电泳图
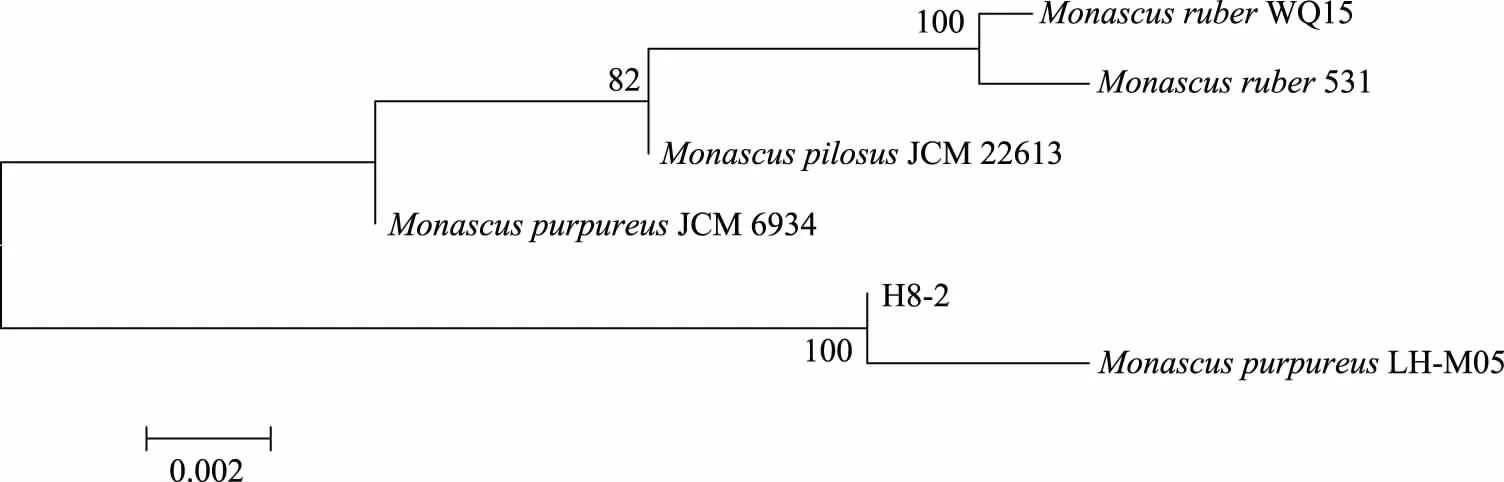
图4 红曲菌H8-2的ITS系统进化树
2.2 不同菌株与红曲菌共酵培养对洛伐他汀产量及色价的影响
在我国传统发酵食品的生产中常采用多菌种混合体系进行发酵,发酵过程中菌种之间的相互作用对食品的风味和功能性物质的含量具有直接影响。因此在本研究中,将红曲菌H8-2与食品中筛选得到的酵母、枯草芽孢杆菌、霉菌、乳酸菌进行共酵,发酵结束后检测红曲中洛伐他汀和色素含量。
由图5a可知,相比较红曲菌H8-2纯种制曲的对照组,除枯草芽孢杆菌4-LCW外,其他菌种的共酵都使洛伐他汀的产量有不同程度的提高,其中酵母菌SY及米曲霉P7显著提高了红曲中的洛伐他汀含量,发酵结束后洛伐他汀含量分别达到12.37和12.10 mg/g。图5b在检测不同菌种共酵后红曲的色素含量后发现,酵母SY共酵后色价达到2014.49 μ/g,是所有共酵菌种中红曲色价含量最高的菌种。因此,综合不同菌种共酵对红曲洛伐他汀和色素含量的影响后,确定以酵母作为红曲的共酵菌种进行进一步的优化。
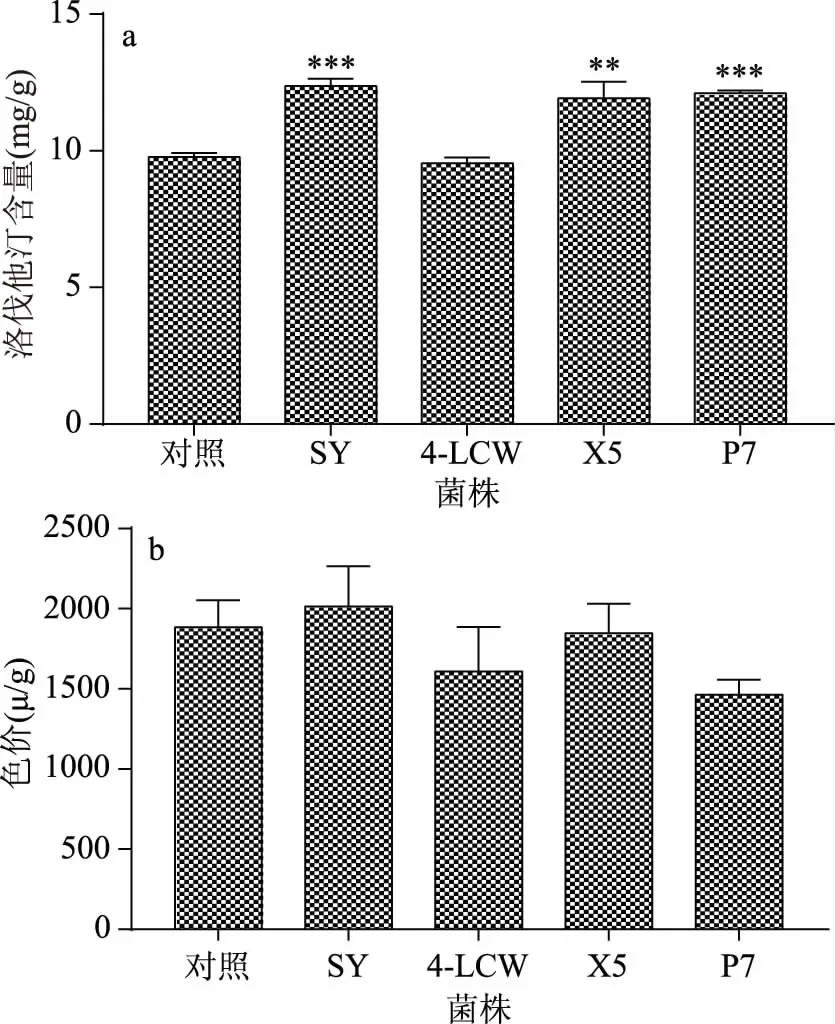
图5 不同菌种对红曲洛伐他汀产量(a)和色价(b)的影响
2.3 不同种类酵母菌与红曲菌共酵对洛伐他汀产量及色价的影响
基于2.2实验结果,发现酵母菌更适合与红曲菌共酵制曲,并对洛伐他汀产量有显著影响。因此选择实验室保藏的不同种类的7株食品来源酵母菌,与红曲菌H8-2共酵制曲,考察不同酵母对固态发酵红曲质量的影响,并筛选出优良的共酵菌株。由图6a可知,两种酿酒酵母2.2084与SY对洛伐他汀产量有显著性提高,其中酿酒酵母2.2084使洛伐他汀产量极显著提高(p<0.0001),达12.93 mg/g,产量相比H8-2纯种制曲的对照组提高了34.5%。图6b共酵对红曲色价的影响,发现酿酒酵母2.2084也能使色价有小幅提高,但不同酵母与红曲菌共酵对红曲色价的影响都不显著(p>0.05),说明共酵可能对红曲色价的影响不大。因此综合考虑选择酿酒酵母2.2084为与红曲菌H8-2共同发酵制曲的优良共酵菌株,拟用此菌株进行后续研究。
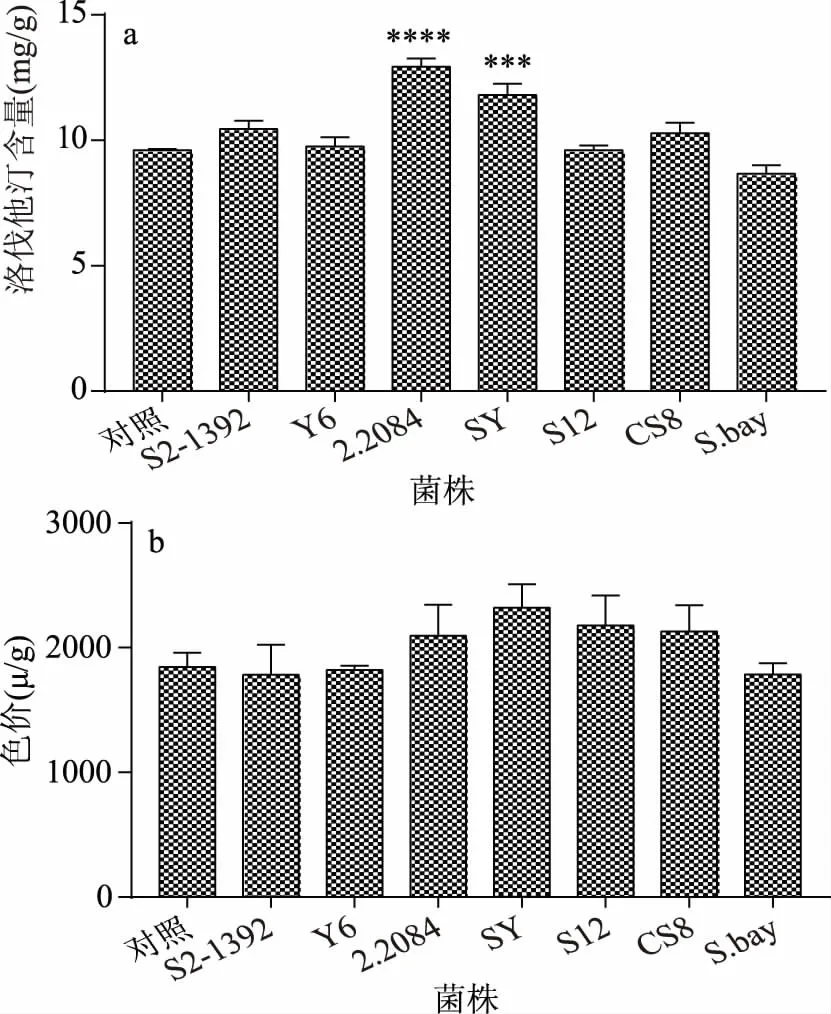
图6 不同酵母菌种对红曲中洛伐他汀产量和色价的影响
2.4 不同酵母诱导剂对红曲固态发酵中洛伐他汀及色价的影响
为初步探究共酵使洛伐他汀产量提升的机理,选择2.3中最优共酵菌种酿酒酵母2.2084制备不同诱导剂,分别添加酿酒酵母菌液、酵母发酵液、高温灭菌液和酵母破壁液到红曲菌固态发酵培养基中与红曲菌H8-2进行共酵,经过14 d的固态发酵后,发现不同酵母诱导剂都对洛伐他汀的产量有较明显的提高,如图7a所示,其中酵母菌液的提高作用最为显著(p<0.001)。推测活的酵母菌液对固态发酵产洛伐他汀更为有益,可能由于酵母在固态发酵过程中与红曲菌共酵,持续生长,从而释放更多对洛伐他汀产量提高有益的诱导因子,使产量显著提高。而高温灭菌液、酵母破壁液也能使红曲固态发酵中洛伐他汀的产量显著提高(p<0.01),产量分别为11.96和12.24 mg/g,分别比H8-2纯种制曲的对照组提高了24.8%和27.8%。由图7b观察酵母诱导剂对红曲色价的影响,发现4种酵母诱导剂均能使色价有所提高,对色价有较好影响,因此酵母对色价无不良影响。赵树欣等[23]在红曲菌液态发酵中也做过类似研究,发现在红曲菌发酵初始添加酵母破壁液2.7%(v/v),洛伐他汀的产量可达61.93 mg/L。分析可能因为固态发酵与液态发酵的状态对共发酵制曲的影响不同。因此酵母共酵提高红曲菌洛伐他汀含量的关键物质存在于胞内,且关键物质在热处理后仍保持洛伐他汀促进作用,表明关键物质对热不敏感。对于酵母中关键物质的进一步确认和探索其诱导机制,仍需要要进一步研究。
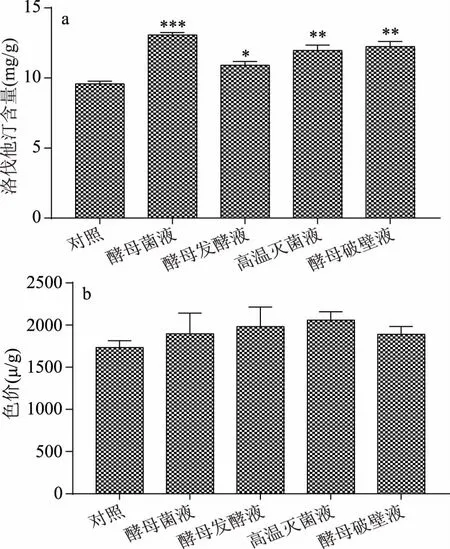
图7 不同酵母诱导剂对红曲洛伐他汀产量和色价的影响
3 结论
本实验从市售红曲中筛选得到一株高产洛伐他汀的紫色红曲菌(Monascuspurpureus)H8-2,并通过与食品来源菌株共酵的方式进一步优化红曲制曲方法。研究表明,红曲菌与酿酒酵母共酵使洛伐他汀产量由未共酵的9.79 mg/g提高到12.93 mg/g,洛伐他汀含量提高了34.5%,对色价无不良影响,可得到质量较高的功能性红曲。相比市售红曲中洛伐他汀产量在1.8~3.5 mg/g范围内,本研究筛选的菌株纯种制曲产洛伐他汀含量远高于市售红曲,并成功建立一种共酵提高红曲洛伐他汀的方法。在对酿酒酵母共酵提高红曲洛伐他汀含量的机理进行初步探究后,发现促进红曲霉产洛伐他汀的关键物质可能存在于酵母胞内,且热处理对关键物质的促进没有负面影响,此结果为后续进一步探索关键物质的种类及其促进机制提供了研究基础。

