牛樟芝醇提物体外抗炎活性研究
李木霞,苏冀彦,李 丹,林 吉,谢意珍2,,李运容
(1.广州中医药大学,广东广州 510006;2.广东粤微食用菌技术有限公司,广东广州 510530;3.广东省微生物研究所省部共建华南应用微生物重点实验室,广东广州 510070;4.广西国际壮医医院,广西南宁 530021)
牛樟芝(Antrodiacinnamomea,AC)又称樟芝、牛樟菇、樟菰、樟内菇、红樟等,是一种独特而珍贵的台湾地道药食两用真菌,属于真菌界(Kingdom Fungi)担子菌门(Basidiomycota)、非褶菌目(Aphyllophorales)、多孔菌科(Polyporaceae)、薄孔菌属(Antrodia)的多年生蕈菌类[1-3]。野生牛樟芝生长于台湾独有的珍贵树种牛樟树的心材内壁或枯死伏地的牛樟树表面,有“森林中的红宝石”之称。牛樟芝醇提物(Antrodiacinnamomeaethanol extract,AC-E)主含萜类,多为三萜,且野生牛樟芝中萜类的含量比培养的牛樟芝中高出10~30倍[4]。现有研究表明,其三萜类化合物具有抗肿瘤[5-6]、抗病毒[7-8]、抗炎[9-10]和保肝[11-12]等药理作用,可预防和治疗癌症、肝炎等多种疾病。本实验建立体外炎症模型,旨在研究牛樟芝抗炎活性的主要机制,为牛樟芝在新药的应用开发奠定实验基础。
脾是机体内最大的免疫器官,内含大量的免疫细胞,在体液免疫和细胞免疫的地位极其重要。研究中药及其有效成分对机体免疫系统的作用是研究中医药免疫调节作用的一个重要方面[13],淋巴细胞增殖反应是非常重要的免疫指标,其中T淋巴细胞增殖反应是反映T细胞功能和机体细胞免疫的主要指标之一[14]。外源性化学物(如药物和环境污染物等)对T淋巴细胞分化、成熟、增殖和信号转导的影响一直是免疫毒理学研究的难点和热点。T淋巴细胞(CD3+)接受抗原刺激可分化成不同亚型,其中包括T细胞亚群辅助性T细胞(Helper T cell、Th、CD3+CD4+)与细胞毒性T细胞(Cytotoxic T cell,Tc,CD3+CD8+),机体维持正常免疫功能有赖于各种免疫细胞特别是T细胞亚群之间的相互协作和制约,进而产生适度的免疫应答,使之既可以清除异物抗原,又可以不损伤正常组织。刀豆蛋白(Concanavalin A,ConA)是从巴西橡胶刀豆(Canavaliabrasiliensis)中提取的植物凝集素,是一种多克隆非特异性T细胞的有丝分裂原,是T淋巴细胞增殖反应常用的刺激剂。
动物预实验中发现AC-E有明显的抗炎作用,但作用机制尚未明确。有研究[15-17]发现,从牛樟芝中分离的马来酰亚胺衍生物、糖蛋白可以有效降低脂多糖引起的RAW264.7 巨噬细胞免疫应答,显示牛樟芝具有抗炎作用。研究表明[18],牛樟芝菌丝体中的methyl antcinate K 可以增强树突细胞活性,促进Th2 细胞分化,增强免疫应答,具有一定的免疫调节作用。Th细胞通过合成和分泌细胞因子,促进B细胞、T细胞和其它免疫细胞的增殖与分化,协调免疫细胞间的相互作用;Tc细胞具有细胞毒性,能特异性杀死异常靶细胞。正常情况下,T淋巴细胞群中的Th细胞、Tc细胞的比值维持动态平衡,它们相互协作或相互制约,以产生适度的免疫应答,如果其平衡被破坏,发生免疫紊乱,就会产生一系列病理改变及疾病[19]。本实验采用ConA刺激脾淋巴细胞增殖模拟机体炎症状态,观察牛樟芝提取物对上述体外模型中T细胞的影响,以探讨牛樟芝潜在的抗炎作用。
1 材料和方法
1.1 材料与仪器
雄性BALB/c小鼠(SCXK(粤)2013-0002,SPF级,体重18~22 g) 购于广东省医学实验动物中心,饲养于广东省微生物研究所实验动物中心(室温20~24 ℃,相对湿度40%~70%,自由饮水摄食);牛樟芝(采摘后迅速低温干燥,避光保存) 台湾;RPMI-1640基础培养基、青链霉素双抗(10000 units/mL青霉素,10000 μg/mL链霉素) Corning公司(美国);胰酶细胞消化液 Hyclone公司(美国);胎牛血清(Fetal Bovine Serum,FBS) 依科赛生物(中国);磷酸盐缓冲液(Phosphate Buffered Saline,PBS) Gibco公司(美国);牛血清白蛋白(Albumin BovineⅤ,BSA) Solarbio公司(美国);MTS粉末(Cell Titer 96® AQueous MTS Reagent Powder) Promega公司(美国);刀豆蛋白A(Concanavalin A,ConA) Sigma公司(美国);Annexin-FITC/PI凋亡检测试剂盒(80090352) 联科生物(中国);二甲基亚砜(DMSO,AR) 天津市富宇精细化工有限公司(中国);流式细胞检测抗体FITC anti-mouse CD3(4320569)、PE-Cyanine 7 anti-mouse CD4(4280800)、APC-CyTM7 anti-mouse CD8(7025872) eBioscience公司(美国);TNF-αELISA试剂盒(AD20180710)、IFN-γELISA试剂盒(AD20180710) Andy gene 公司(美国)。
BSC-1800IIA2型超净工作台 北京东联哈尔仪器有限公司(中国);Gabaxy 170S+型CO2培养箱 Eppendorf公司(德国);Thermo MK3型酶标仪 Thermo公司(美国);IX71型显微镜 Olympus公司(日本);IC1000型自动细胞计数仪 Countstar公司(中国);AUY220型电子天平 岛津公司(日本);RE6000A型旋转蒸发仪 上海亚荣生化仪器厂(中国);FACSCanToⅡ流式细胞分析仪 Becton Dickinson公司(美国);DFY-500型500 g摇摆式高速中药粉碎机 浙江大德药业集团有限公司(中国);GB6003-85型药典检验筛 浙江上虞市华丰五金仪器有限公司(中国)。
1.2 实验方法
1.2.1 试剂配制
1.2.1.1 牛樟芝醇提物(AC-E)的制备 将牛樟芝子实体经除杂、清洗、晾晒至干后,置于烘箱,60 ℃干燥4 h至水分含量8%以下[20]。取烘干后的子实体经摇摆式高速中药粉碎机中打粉(25000 r/min,每5 s间隔一次,粉碎3次),使用孔径为4目(65 μm)~50目(355 μm)药典检验筛进行筛选,收集子实体颗粒[21]。称取上述颗粒20 g,装入圆底烧瓶,加入86%乙醇200 mL,室温浸泡4 h后,再加入86%乙醇600 mL,80 ℃加热回流1.5 h,过滤,收集滤液,滤渣重复上述加热回流提取操作1次[21],将所得2次滤液合并,减压浓缩至无醇味,冻干即得。
1.2.1.2 RPMI-1640完全培养基配制 10%灭活FBS+1%青链霉素双抗+89% RPMI-1640基础培养基
1.2.1.3 AC-E配制 称取100 mg AC-E,加DMSO使AC-E的浓度为100 mg/ml,溶解完全后用0.22 μm微孔滤膜滤过;滤液分别用RPMI-1640完全培养基配制成孔内终浓度为50、25、12.5 μg/mL三个浓度。
1.2.1.4 ConA溶液配制 用RPMI-1640完全培养基将ConA配制成孔内终浓度为3 μg/mL。
1.2.1.5 红细胞裂解液配制 精确称取氯化铵(9290 mg)、碳酸氢钾(1000 mg)、EDTA(37 mg),溶于1 L双蒸水中,调节pH为7.21~7.23,过0.22 μm微孔滤膜。
1.2.2 脾细胞制备 小鼠脱臼处死[17],浸泡在75%乙醇中消毒,转移至超净台内,剖取脾脏,用PBS清洗。另在超净台内准备好6 cm培养皿,倒入少量PBS,覆盖一张200目灭菌滤布,将脾脏置于滤布上,稍微剪碎后,用玻璃注射器活塞研磨脾脏至无明显块状。移除滤布,转移培养皿滤液至离心管,离心(300×g,5 min)去上清;加入1 mL自制ACK裂解液(室温)重悬细胞,室温静置5 min,加入7 mL预冷PBS,离心(300×g,5 min),去上清;再分别用5 mL预冷PBS离心洗涤2次后,用400 μL RPMI-1640完全培养基重悬细胞,进行细胞计数,调节细胞浓度为3×106个/mL。
1.2.3 AC-E对小鼠脾淋巴细胞活力的影响 取两块96孔板,命名为板1、板2,其中板1设正常组、AC-E组(50、25、12.5 μg/mL);板2设正常组、模型组、AC-E组(50、25、12.5 μg/mL)。
板1给药如下:
正常组:完全培养基+含0.1% DMSO RPMI-1640完全培养基+细胞悬液;
AC-E组:不同浓度AC-E+含0.1% DMSO RPMI-1640完全培养基+细胞悬液。
板2给药如下:
正常组:RPMI-1640完全培养基+含0.1% DMSO RPMI-1640完全培养基+细胞悬液;
模型组:ConA溶液+含0.1% DMSO RPMI-1640完全培养基+细胞悬液;
AC-E组:ConA溶液+不同浓度AC-E+细胞悬液。
每组设3个复孔,置于37 ℃、5% CO2培养箱中连续培养72 h。培养结束前4 h在每孔加入MTS液20 μL,继续培养4 h,于酶联免疫检测仪490 nm处检测光密度 OD值,作为淋巴细胞增殖的指标,调零孔仅加200 μL RPMI-1640完全培养基。相对细胞活力计算公式如下。
相对细胞活力(%)=(OD药物组-OD调零孔/OD正常组-OD调零孔)×100
1.2.4 AC-E对小鼠脾淋巴细胞凋亡的影响 分组及给药与1.2.3板2一致,每组设3个复孔,置于37 ℃、5% CO2培养箱中连续培养72 h后,在96孔板中将细胞吹打均匀,收集细胞悬液,使用FCM检测AC-E对小鼠脾淋巴细胞凋亡的影响。分为单阳性对照管和实验管,分别加入2 mL预冷PBS离心(300×g,5 min)洗涤两次,弃上清。
单阳性对照管加入500 μL Apoptosis Positive Control Solution重悬,置冰上孵育30 min,用预冷PBS离心(300×g,5 min),洗涤弃上清,加入适量预冷1×Binding Buffer重悬,并加入数量相同且未经处理的活细胞与之混合,加预冷1×Binding Buffer补充至1.5 mL,等分成三管,其中一管为空白对照管、两管为单阳性对照管。单阳性对照管分别加入5 μL Annexin V-FITC、10 μL PI,室温避光孵育5 min,即可上机调试。
实验管分别加入500 μL 1×Binding Buffer重悬细胞,分别加入5 μL Annexin V-FITC和10 μL PI,轻柔涡旋混匀后,室温避光孵育5 min,即可上机检测。
细胞凋亡率(%)=凋亡早期细胞比例(%)+凋亡晚期细胞比例(%)
1.2.5 AC-E对小鼠脾淋巴细胞T细胞比例及T细胞亚群的影响 分组及给药与1.2.3板2一致,每组设3个复孔,置于37 ℃、5% CO2培养箱中连续培养72 h后,在96孔板中将细胞吹打均匀,收集细胞悬液,使用流式细胞术检测AC-E对脾淋巴细胞中T细胞、Th细胞、Tc细胞的比例及活化程度。
单阳性对照和空白对照:取5管,分别加入FITC anti-mouse CD3(0.125 μg/test)、PE-Cyanine 7 anti-mouse CD4(0.0625 μg/test),APC-CyTM7 anti-mouse CD8(0.1 μg/test)的0.5% BSA/PBS缓冲液,作为单阳性对照;同时设一个无抗体空白对照,作为阴性对照,轻柔涡旋混匀后,室温避光孵育30 min。加入600 μL 0.5% BSA/PBS缓冲液洗涤2次。最后用0.5% BSA/PBS缓冲液200 μL重悬细胞,即可上机调试。
样品:各样品管,每管加入60 μL含FITC anti-mouse CD3(0.125 μg/test)、PE-Cyanine 7 anti-mouse CD4(0.0625 μg/test)、APC-CyTM7 anti-mouse CD8(0.1 μg/test)的0.5% BSA/PBS缓冲液;轻柔涡旋混匀后,室温避光孵育30 min,加入600 μL 0.5% BSA/PBS缓冲液洗涤2次,最后用0.5% BSA/PBS缓冲液200 μL重悬细胞,即可上机检测。
1.2.6 AC-E对小鼠脾淋巴细胞的细胞因子TNF-α、IFN-γ表达的影响 分组及给药与1.4板2一致,每组设3个复孔,置于37 ℃、5%CO2培养箱中连续培养72 h后,在96孔板中将细胞吹打均匀,收集细胞悬液,3000 r/min离心(20 min),收集细胞上清液,操作步骤按照ELISA 检测试剂盒说明书进行。
1.3 数据处理

2 结果与讨论
2.1 AC-E对小鼠脾淋巴细胞活力的影响
由图1A可知,AC-E对小鼠脾淋巴细胞无明显细胞毒作用,图1B中,模型组细胞增殖相对细胞活力(177.40%±8.686%)与正常组相比差异极显著(p<0.01);AC-E干预72 h后,低剂量组的相对细胞活力(173.80%±4.075%)与模型组相比无显著变化;中高剂量则极显著低于模型组(128.90%±8.499%、82.49%±3.528%),说明AC-E对ConA诱导的淋巴细胞增殖有极显著的抑制作用(p<0.01),AC-E对该炎症模型同样具有抗炎作用。

图1 AC-E对小鼠脾淋巴相对细胞活力的影响
2.2 AC-E对小鼠脾淋巴细胞凋亡的影响
图2A是FCM检测正常组、模型组、给药组对脾淋巴细胞凋亡影响的代表性图谱,图2B是给予ConA及AC-E干预,小鼠脾淋巴细胞连续培养72 h后的凋亡率。
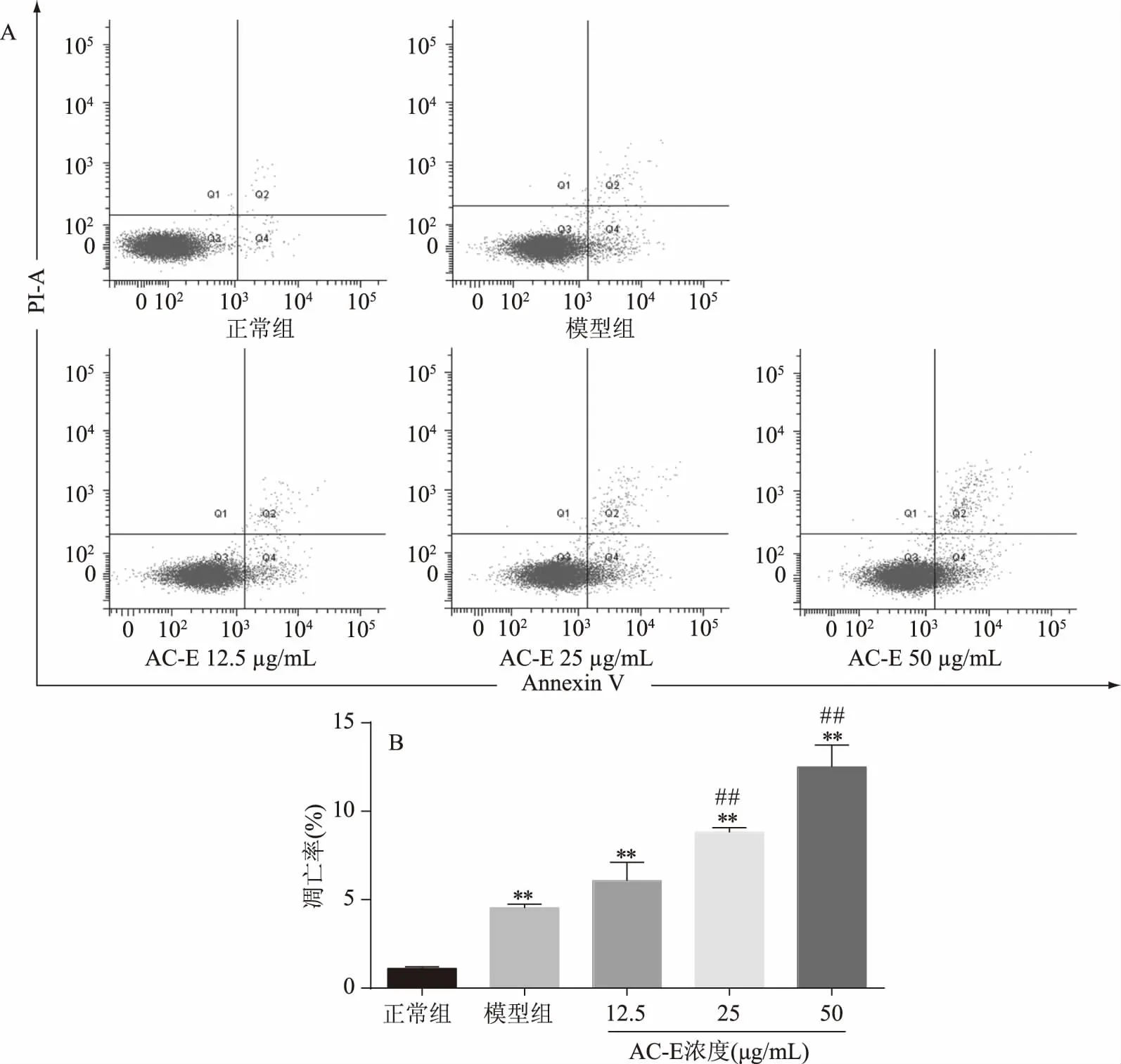
图2 AC-E对小鼠脾淋巴细胞凋亡的影响
由图2A得,正常组的细胞几乎无凋亡现象,而模型组及三个给药组的细胞均出现了明显的凋亡。由图2B可知,小鼠脾淋巴细胞连续培养72 h后,未经ConA刺激的正常组凋亡不明显(1.100%±0.100%),加入ConA刺激的模型组(4.533%±0.208%)出现极显著凋亡(p<0.01),加入ConA刺激后给予AC-E干预,低中高剂量组(6.067%±1.041%、8.800%±0.265%、12.500%±1.249%)的细胞凋亡率极显著升高(p<0.01)。且较于模型组,中高浓度给药组的细胞极显著凋亡(p<0.01)。而ConA特异性刺激T淋巴细胞增殖,给予AC-E干预后细胞出现明显凋亡,因此可以推测AC-E是否诱导了T细胞凋亡。
2.3 AC-E对小鼠脾淋巴细胞T细胞比例的影响
图3A是FCM检测正常组、模型组、给药组(低、中、高剂量)T细胞比例的代表性图谱,图3B是给予ConA及AC-E干预,小鼠脾淋巴细胞连续培养72 h后T细胞的比例变化。

图3 AC-E对小鼠脾淋巴细胞T细胞比例的影响
由图3A得,模型组的T细胞比正常组明显增加,给药组的T细胞出现了不同程度的减少。T细胞在许多免疫性疾病的发病中起重要作用[22-24],它所启动的免疫可有效保护机体免受感染的侵害或者抑制肿瘤发生[21,25]。然而,若被激活及过度增殖的T细胞所启动的免疫反应不受控制,或者原有的免疫平衡被打破,则可诱发多种严重的免疫性疾病。由图3B可知,ConA刺激的小鼠脾淋巴细胞T细胞虽有增殖(模型组78.170%±1.139%),但给予AC-E干预后,与正常组(70.530%±2.554%)相比,低剂量组(70.100%±1.419%)的T细胞比例无显著差异,中、高剂量组(60.630%±2.803%、51.670%±2.074%)的T细胞比例分别显著(p<0.05)、极显著(p<0.01)降低,说明低剂量的AC-E使受ConA刺激增殖的T细胞控制在正常免疫水平。
2.4 AC-E对小鼠脾淋巴细胞T细胞亚群的影响
图4A是FCM检测正常组、模型组、给药组(低、中、高剂量)的T 细胞亚群比例的代表性图谱,图4B是给予ConA及AC-E干预,小鼠脾淋巴细胞连续培养72 h后T细胞亚群的比例变化。
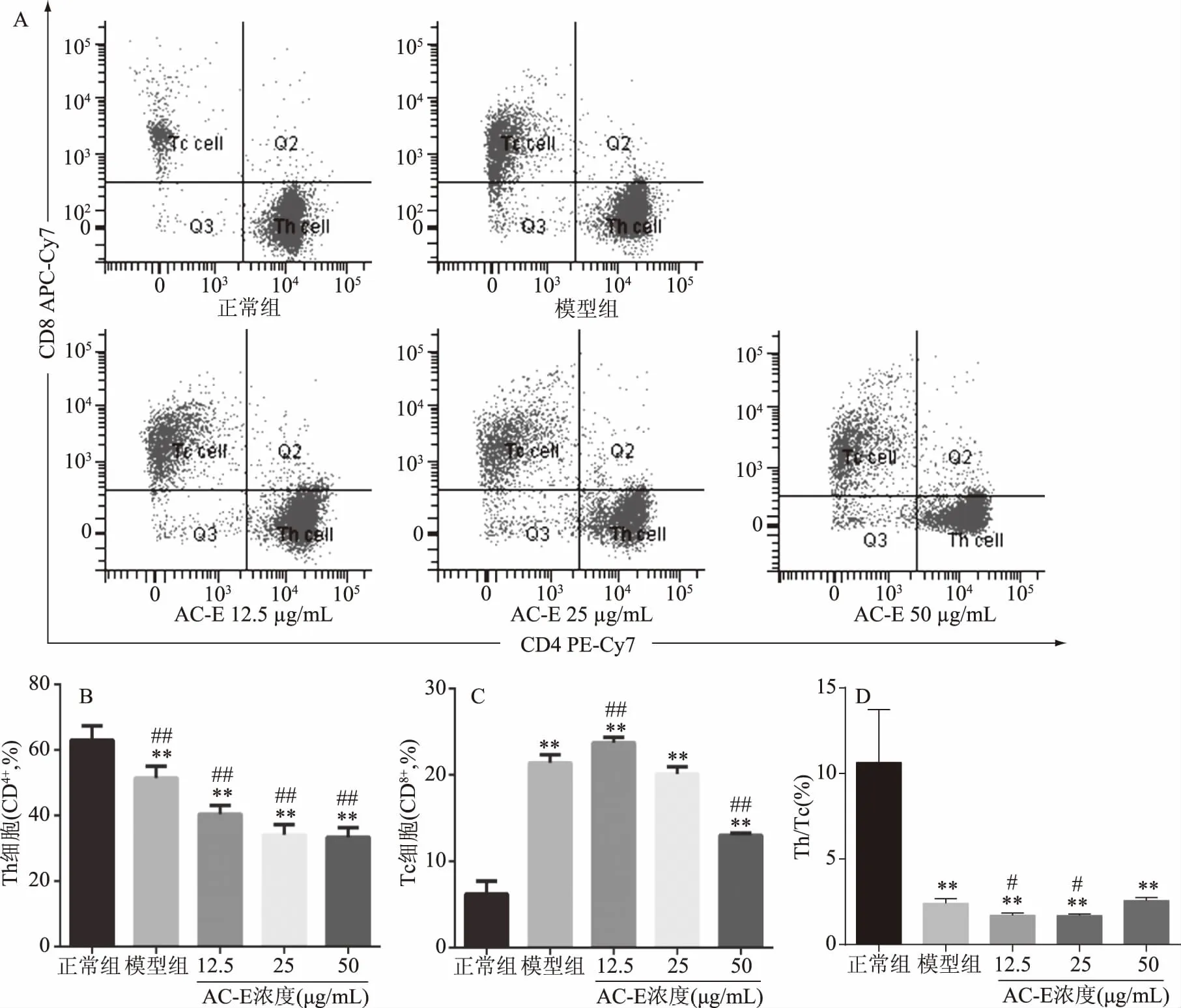
图4 AC-E对小鼠脾淋巴细胞T细胞亚群的影响
如图4A造模及给药后,Th细胞减少,而Tc细胞明显增多。图4B中,小鼠脾淋巴细胞刺激给药后,低、中、高剂量组(40.410%±1.542%、34.090%±1.799%、33.370%±1.694%)的Th细胞比例极显著低于正常组(62.980%±2.534%,p<0.01),模型组(51.440%±2.059%)亦有极显著降低(p<0.01),但图4C中模型组(21.390%±0.551%)极显著高于正常组(6.205%±0.872%,p<0.01),图4D中模型组(2.412%±0.154%)Th细胞和Tc细胞的比例仍然极显著少于正常组(10.640%±1.793%,p<0.01),说明ConA刺激T细胞增殖后更多地转化为Tc细胞。而对于Tc细胞来说,低、中、高剂量组(23.740%±0.357%、20.110%±0.480%、13.010%±0.150%)均极显著高于正常组(6.205±0.872%,p<0.01),低剂量组的Tc细胞比例极显著高于模型组(p<0.01),可能是因为低剂量的AC-E作为外源物质对脾淋巴细胞也有刺激作用,激活T细胞向Tc细胞转化,见图4C。由图4D中可知,各组Th/Tc细胞的比例均极显著低于正常组(p<0.01),结合图3,说明T细胞在ConA刺激及给予AC-E干预,T细胞出现明显凋亡是由于体系内Th/Tc需维持动态平衡而出现的Th细胞及Tc细胞凋亡所致。
2.5 AC-E对小鼠脾淋巴细胞的细胞因子TNF-α、IFN-γ表达的影响
图5A是小鼠脾淋巴细胞TNF-α的表达,图5B是AC-E对小鼠脾淋巴细胞IFN-γ表达的影响。
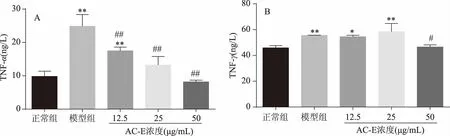
图5 AC-E对小鼠脾淋巴细胞的细胞因子TNF-α、IFN-γ分泌的影响
牛樟芝的抗炎作用与降低人外周血单核细胞中TNF-α、IL-6 及中介物NO、PGE2 水平,抑制巨噬细胞中IL-1β、IL-18 分泌及NLRP3 炎性体,激活MAPK、NF-κB信号通路有关[26-27]。模型组(24.860±2.007 ng/L)的TNF-α浓度与正常组(9.084±0.915 ng/L)相比,极显著升高(p<0.01),低、中、高剂量组(17.490±0.638、13.240±1.472、8.196±0.289 ng/L)的TNF-α浓度相比于模型组极显著下降(p<0.01),见图5A。模型组(55.550±0.089 ng/L)的IFN-γ浓度极显著高于正常组(45.880±0.957 ng/L,p<0.01),高剂量组(46.580±0.957 ng/L)的IFN-γ浓度与正常组无显著性差异,相对于模型组显著下降(p<0.05),见图5B。说明AC-E的抗炎作用可通过抑制脾淋巴细胞分泌的TNF-α及IFN-γ发挥作用。
3 结论
本实验采用ConA刺激小鼠脾淋巴细胞增殖的体外炎症模型,实验结果表明,ConA刺激及给予AC-E干预后,AC-E组的小鼠脾淋巴细胞的相对活力及分泌的TNF-α、IFN-γ与正常组相近,说明AC-E对该模型具有抗炎作用,具有良好的免疫调节活性。

