超高压与重组果胶甲酯酶抑制剂联合应用对鲜榨橙汁果胶甲酯酶活性及品质的影响
王晓丽,郭 藏,梅晓宏,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业部农业转基因生物安全评价(食用)重点实验室,北京 100083;3.北京联合大学,北京 100023)
橙汁混浊态是橙汁重要的感官特征之一,混浊态赋予橙汁独特的口感与质构,混浊态属于热力学不稳定体系,在橙汁加工与贮存过程中,混浊态易出现消失现象,造成橙汁感官品质降低[1]。橙汁混浊态消失主要是由于橙汁中内源性果胶甲酯酶(pectin methylesterase,PME)对果胶的脱甲酯化作用,低甲酯化的果胶与钙离子结合生成难溶性的果胶酸盐,从而导致橙汁分层、混浊态消失[2-3]。
橙汁加工企业通常采用热处理方法(如巴氏杀菌、高温瞬时杀菌)钝化PME,但是热处理会使橙汁产生蒸煮味,且品质变差。与传统热处理方法相比,超高压是一种新型的非热加工技术,它不但能有效对果汁进行杀菌、钝酶,同时能避免由于热处理引起的果汁营养成分损失、风味改变等不良反应[4]。将超高压技术应用到橙汁中的研究结果表明,由于橙汁中耐高压PME的存在,常规超高压处理(400~500 MPa)不能完全钝化橙汁PME[5],从而限制了超高压技术在橙汁产业中的广泛应用。1990年,Castaldo等[6]从猕猴桃果实中分离纯化出对PME活性有抑制作用的蛋白质,并将其命名为果胶甲酯酶抑制剂(pectin methylesterase inhibitor,PMEI),PMEI能够与植物中的PME形成1∶1非共价型可逆复合物,从而有效抑制植物PME活性,为提升果蔬汁的浑浊稳定性提供了新思路。然而,从植物体中直接提取PMEI相当困难,且提取量很低。梅晓宏等[7-8]利用基因重组技术构建了含有猕猴桃果胶甲酯酶抑制剂基因的重组毕赤酵母GS115菌株,其中该基因的C末端引入了编码六个组氨酸的标签,高效表达并纯化出重组果胶甲酯酶抑制剂(recombinant pectin methylesterase inhibitor,rPMEI)。本研究拟采用非热加工技术超高压与rPMEI联合处理橙汁,并对处理后的橙汁品质进行测定,具有一定创新性。
基于超高压钝化橙汁PME存在的问题,本研究将超高压与rPMEI联合作用于鲜榨橙汁中,初步探究二者联合作用对橙汁色泽、维生素C保留率及PME活性的影响及变化规律,并与热处理进行比较,以期为超高压与重组PMEI联合应用于鲜榨橙汁加工产业提供理论基础及技术支持。
1 材料与方法
1.1 材料与仪器
赣南脐橙 北京市美廉美超市(学清路店);含有猕猴桃果胶甲酯酶抑制剂基因的重组毕赤酵母GS115菌株(-80 ℃甘油中保存) 中国农业大学食品科学与营养工程学院转基因生物安全评价(食用)重点实验室;平板计数琼脂培养基、孟加拉红培养基 北京奥博星生物技术有限公司;0.1%溴麝香草酚兰水溶液 山东临沂永安化验室;果胶(来源为柑橘,70%酯化度)、维生素C标准品 美国Sigma公司;金属镍螯合琼脂糖凝胶(Ni Sepharose 6 Fast Flow) 美国GE Healthcare公司;BCA蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;丙烯酰胺、甲叉双丙烯酰胺、无氨基酵母氮源(YNB) 美国Amresco公司;生物素 北京畅华志诚科技有限公司;其他试剂均为国产分析纯。
HZQ-X160型全温振荡培养箱 江苏太仓市实验设备厂;HSW智能型恒温恒湿培养箱 宁波江南仪器厂;WJU-MS501J型榨汁机 惠而浦(中国)投资有限公司;CC-K6型水浴锅 德国HUBER有限公司;700-7L-6型超高压设备 包头科发高压科技有限公司;TGL-16M型医用离心机 湖南湘仪实验室仪器开发有限公司;全波长酶标仪 美国 Thermo公司;S210型pH计 瑞士梅特勒-托利多仪器有限公司;SC-80C全自动色差仪 北京康光仪器公司;DY24A型垂直板电泳槽、DYY-6C型电泳仪 北京六一仪器厂;GelDoc-ItTM Imaging System型UVP凝胶成像仪 美国UVP公司。
1.2 实验方法
1.2.1 rPMEI的诱导表达与纯化 rPMEI诱导表达参照李晓红等[9]实验方法。将实验室保存的kwPMEI-GS115在YPD平板上划线进行种子活化,30 ℃倒置培养2 d;挑取一个单菌落,接入25 mL BMGY液体培养基中(在500 mL三角瓶中进行),28 ℃、225 r/min培养至细胞浓度达到OD600=2~6;将上述培养基3000×g冷冻离心5 min,弃去上清液,收集菌体细胞,然后用20 mL BMMY培养基重悬细胞(在250 mL三角瓶中进行),30 ℃、250 r/min诱导表达96 h,注意每隔24 h补加1%甲醇;表达完成后,将发酵液置于离心管中,4 ℃、15000×g离心5 min,将上清液转移至新离心管,-20 ℃贮存。
rPMEI纯化参照Liu等[8]的实验方法。加入10 mL Ni Sepharose 6 Fast Flow凝胶于砂芯漏斗中抽滤,以除去凝胶中的乙醇;向砂芯漏斗中加入50 mL的结合液,用药勺搅拌一下,用于平衡凝胶,抽滤;将凝胶刮至容器中,加入10 mL表达上清液,4 ℃、175 r/min振荡15 min,抽滤;将凝胶再次刮至容器中,加入20 mL结合液,4 ℃、175 r/min振荡10 min,抽滤,去掉杂质;在刮下的凝胶中加入50 mL的洗脱液,4 ℃、175 r/min振荡10 min,抽滤,重复两次。合并两次滤液,4 ℃过夜透析去盐,使用截留分子量为10 kDa的超滤离心管超滤浓缩。纯化后rPMEI溶解于0.02 mol/L Tris-HCl(pH7.0),-80 ℃贮存备用。
按照Laemmli的方法进行蛋白质SDS-PAGE检测[10]。电泳的分离胶和浓缩胶的条件如下:分离胶浓度12.5%,浓缩胶浓度5%,将40 μL上清液和10 μL 5×上样缓冲液混合均匀后置于沸水浴中10 min,样品溶液上样量为30 μL,标准蛋白质Marker上样量为8 μL。电泳电压120 V,当染料前沿距橡胶框底边1 cm时,停止电泳。在固定液中固定30 min后,用考马斯亮蓝R250染色2 h后再进行脱色1 h。电泳胶用凝胶成像仪拍照。
1.2.2 蛋白质浓度测定 根据BCA蛋白质浓度测定试剂盒的方法,测定纯化后的rPMEI的浓度。
1.2.3 橙汁制备及处理 取新鲜赣南脐橙清洗、沥干水分、去皮,用榨汁机榨成汁,备用。
1.2.3.1 热处理 取榨好的橙汁50 mL放入100 mL耐热试管中,将试管放入90 ℃水浴中,用温度计置于中心测定温度,当橙汁中心温度达到90 ℃时,计时1 min。处理完毕立即放入冰浴中冷却,尽快进行相关指标的测定。
1.2.3.2 超高压处理 取榨好的橙汁20 mL分装于高温蒸煮袋中,此过程尽量减少进入气泡,分装完成后用真空封口机封口,尽量避免样品与热封机封口条接触。将分装好的样品放入高压反应釜中,浸没于传压介质(本实验为水)中,设定温度、压力和时间。按照向晨茜[14]的研究结果设置实验参数为:温度为20 ℃,压力分别为400、500、600 MPa,在每个压强下保压5 min。压力升高至设定压力开始计时,到达处理时间后设备自动泄压,超高压处理结束后,样品立即放入冰浴中冷却,尽快进行相关指标的测定。对照组为未经过超高压处理的橙汁样品。
1.2.3.3 超高压联合rPMEI处理 取榨好的橙汁20 mL,分别加入0、0.30、0.60、0.90、1.20 mg rPMEI(即浓度分别为0、0.015、0.030、0.045、0.060 mg/mL),按照1.2.3.2的方法进行500 MPa超高压处理5 min。处理完毕立即放入冰浴中冷却,尽快进行相关指标检测。
1.2.4 不同处理后鲜榨橙汁相关指标的测定
1.2.4.1 橙汁菌落总数、霉菌与酵母菌测定 橙汁菌落总数检测按照GB 4789.2.2016的方法进行,以无菌吸管吸取25 mL样品置盛有225 mL磷酸盐缓冲液的无菌锥形瓶中,充分混匀,制成1∶10的样品匀液,用1 mL微量移液器吸取1∶10样品匀液1 mL,沿管壁缓慢注于盛有9 mL稀释液的无菌试管中,充分混匀,制成1∶100的样品匀液;同理制备1∶1000的样品匀液。吸取1 mL样品匀液于无菌平皿内,每个稀释度做两个平皿。同时分别吸取1 mL空白稀释液,加入两个无菌平皿内作空白对照。及时将15~20 mL冷却至46 ℃的平板计数琼脂培养基(可放置于(46±1) ℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。待琼脂凝固后,将平板翻转,(36±1) ℃培养(48±2) h。用肉眼观察,记录稀释倍数和相应的菌落数量。
霉菌与酵母菌检测按照GB 4789.15-2016的方法进行。按照上述菌落总数检测方法制备样品梯度稀释液,及时将20~25 mL冷却至46 ℃的孟加拉红培养基(可放置于(46±1) ℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。待琼脂凝固后,置(36±1) ℃培养箱中培养,观察并记录培养至第5 d的结果。用肉眼观察,记录稀释倍数和相应的菌落数量。
1.2.4.2 橙汁PME活性测定 橙汁中PME活性测定参考Hagerman等[11]的方法,略作改动。将鲜榨橙汁与1 mol/L氯化钠溶液按照体积比1∶2混匀,于4 ℃、150 r/min恒温振荡1 h。于4 ℃、10610×g条件下离心10 min。收集上清液即为粗酶液,调pH为7.5。取5 mL预先配制好的1%果胶溶液于10 mL离心管中,加入100 μL 0.1%溴麝香草酚蓝水溶液指示剂,充分混匀;再加入上述1 mL粗酶液,充分混匀。取200 μL混合液于96孔板中,1 min内连续检测其OD620的变化,间隔时间0.3 s。
一个PME酶活单位定义为1 min引起OD620变化10-3所需的酶量。
1.2.4.3 橙汁色泽测定 参照Lozano等[12]的方法对橙汁色泽进行测定。色泽是反应橙汁优劣的重要依据,一般用色差值ΔE*=(ΔL*2+Δa*2+Δb*2)1/2表征样品色泽变化程度的高低,其中L*表示明亮值,a*表示红绿值,b*表示黄蓝值,ΔE*越大,表明色泽变化程度越高。
分别取待测的橙汁样品5 mL,利用全自动色差仪测定样品的L*、a*、b*值。
1.2.4.4 橙汁VC测定 参照GB 5009.86-2016中2,6-二氯靛酚滴定法进行测定。准确量取橙汁20 mL于烧杯中,用草酸溶液将样品转移至100 mL容量瓶,并稀释至刻度,摇匀,加8 g超细高岭土脱色后再过滤,并进行测定。
1.3 统计分析
所有数据均为三次平行实验的平均值,实验结果使用Excel和SPSS 19软件进行分析。
2 结果与分析
2.1 rPMEI的诱导表达与纯化
蛋白表达与纯化的电泳结果如图1所示。纯化前后均有一明显的分子量约为16 kDa蛋白质条带,该条带与之前报道的天然猕猴桃PMEI的分子量基本吻合[13]。本课题组前期对编码猕猴桃PMEI的基因进行了密码子优化,同时在该基因的碳末端引入了编码六个组氨酸的标签[8],所表达出来的目的蛋白可以特异性地与含有镍离子的凝胶结合,因此本研究已成功表达出rPMEI,同时经镍亲合层析纯化出该蛋白质,并且纯度很高,几乎不含其它杂质。同时表达上清液中杂蛋白质较少,目的蛋白质占表达产物的绝大多数,这也非常有利于重组蛋白质的纯化。通过BCA试剂盒测定纯化后洗脱液中的蛋白质浓度,结果为0.15 mg/mL。
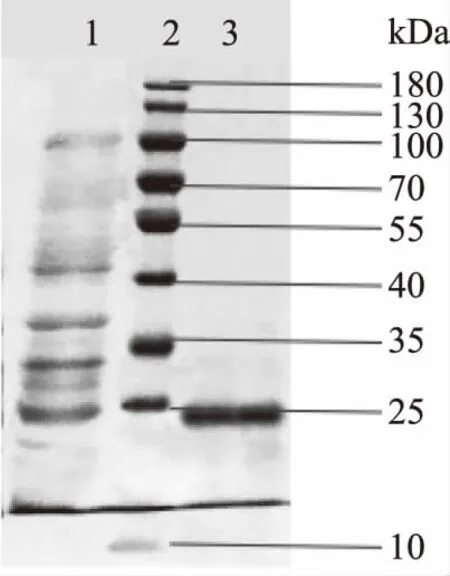
图1 纯化前后rPMEI的SDS-PAGE分析
2.2 超高压处理对鲜榨橙汁微生物的影响
超高压处理对鲜榨橙汁微生物的影响结果如表1所示,与未经过超高压处理的对照组橙汁相比,当超高压分别为400、500、600 MPa处理橙汁,同时保压时间为5 min时,橙汁中菌落总数随压力增加而显著下降(p<0.05)。当处理条件为500 MPa/5 min时,菌落总数对数值为1.98 lg(CFU/mL),符合我国农业行业标准:《NY/T 434-2016绿色食品、果蔬汁饮料》中规定的菌落总数(≤2 lg(CFU/mL))。而橙汁中的酵母菌、霉菌在压力为400 MPa以上均不能检出,满足《NY/T 434-2016绿色食品、果蔬汁饮料》所规定的霉菌、酵母菌数目(≤20 CFU/mL)。向晨茜研究了超高压对橙汁菌落总数的影响,发现当处理压力为400 MPa、处理时间为5 min时,菌落总数显著降低(p<0.05)[14]。Ogawa等证实了超高压300~400 MPa处理对细菌、霉菌、酵母菌的营养体有明显的杀灭效果[15]。以上结论与本实验结果基本符合。研究结果表明,超高压处理能够破坏微生物细胞壁的膜通透性,导致细胞内部的营养物质随着细胞质一起流失,因此改变微生物的生理功能,使其不能进行正常的新陈代谢,从而杀灭微生物[16]。综上所述,为了保证超高压联合rPMEI作用时,橙汁中的微生物指标满足《NY/T 434-2016绿色食品、果蔬汁饮料》所规定的要求,同时尽量减少较高压力所带来的生产成本的增加及对超高压设备的损耗,本研究在后续的实验中将超高压处理条件设置为500 MPa/5 min。
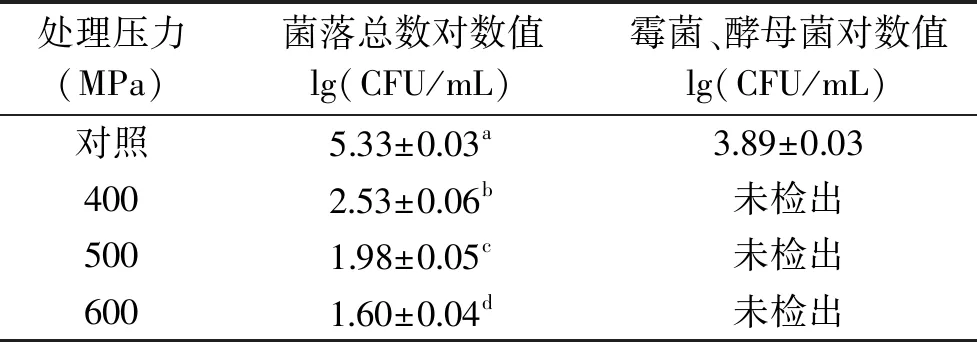
表1 超高压处理对鲜榨橙汁微生物的影响
2.3 rPMEI添加量对橙汁PME活性的抑制情况
在超高压500 MPa、处理时间为5 min条件下,rPMEI添加量对橙汁PME活性抑制情况的实验结果如表2所示。相比于未处理组,超高压处理能够有效降低橙汁PME活性,与未处理组存在显著性差异(p<0.05)。但单一的超高压处理不足以完全抑制PME活性,这与橙汁存在耐压的PME同工型有关[5]。当超高压联合rPMEI作用于橙汁中,若rPMEI添加浓度较低(如0.015、0.030 mg/mL),相比于超高压处理组,并不能显著降低橙汁PME活性(p>0.05)。当rPMEI添加浓度为0.045 mg/mL及以上时,超高压联合rPMEI处理相比于超高压处理,能够有效降低PME活性(p<0.05)。当rPMEI添加浓度为0.06 mg/mL及以上时,超高压联合rPMEI能够完全抑制橙汁中PME活性。此外对橙汁在90 ℃条件下热处理1 min后,能够完全钝化PME活性,这可能是由于橙汁PME对热比较敏感[17]。高效体积排阻色谱法和表面等离子共振技术的研究结果表明,PMEI与PME二者之间可形成1∶1非共价型可逆复合物,该复合物的形成可能阻止PME与果胶底物的结合,从而抑制PME的活性[18-20]。本课题组前期的实验结果表明,超高压处理对rPMEI的抑制活性影响较小[21]。因此将超高压与rPMEI联合应用于橙汁中,既可以发挥超高压对橙汁杀菌钝酶的效果,又可以运用rPMEI对PME活性的抑制作用。根据本实验结果在后续研究超高压联合rPMEI对橙汁品质影响时,rPMEI的添加量设置为0.06 mg/mL。

表2 rPMEI添加量对橙汁PME活性的抑制
2.4 热处理、超高压、超高压联合rPMEI对橙汁色泽的影响
热处理、超高压和超高压联合rPMEI对橙汁色泽影响的实验结果如表3所示,相比于对照组,上述三种处理方式均会显著升高橙汁的L*值、b*值(p<0.05),同时显著降低橙汁的a*值(p<0.05),也会显著改变ΔE*值(p<0.05),但超高压处理对橙汁的L*值、b*值、a*值、ΔE*值的影响程度显著小于热处理(p<0.05)。同时相比于超高压处理,超高压联合rPMEI并不会显著改变橙汁的L*值、b*值、a*值、ΔE*值(p>0.05),表明rPMEI加入到橙汁中并没有对其色泽产生影响,因此超高压联合rPMEI处理能较好地保护橙汁的色泽。研究结果表明,超高压能够钝化橙汁中一些不耐压的内源酶,且高压能促进呈色物质溶出,在一定程度上起到改善橙汁色泽的作用[22]。

表3 不同处理对橙汁色泽的影响
2.5 超高压联合rPMEI对橙汁VC的影响
超高压联合rPMEI对橙汁VC的影响结果如表4所示,超高压和热处理都会显著降低橙汁中的VC含量(p<0.05)。与超高压处理相比,热处理造成橙汁中VC损失更大,经热处理的橙汁VC保留率仅为8.3%,远小于超高压处理后橙汁VC保留率(87.6%),该结果与其他文献的实验结果基本相似[23-24]。同时rPMEI在橙汁中的加入并没有显著降低其VC的含量(p>0.05),表明超高压联合rPMEI能较好地保留橙汁中VC含量。橙汁中含有丰富的VC,但经传统热处理后,损失率高达95%,即使在加工过程中额外添加抗氧化剂或者螯合剂,损失率仍会50%以上[25]。热处理会激活VC氧化酶,破坏小分子中的共价键,而超高压处理不会破坏VC中的共价键[26],从而对VC具有很好的保持作用。
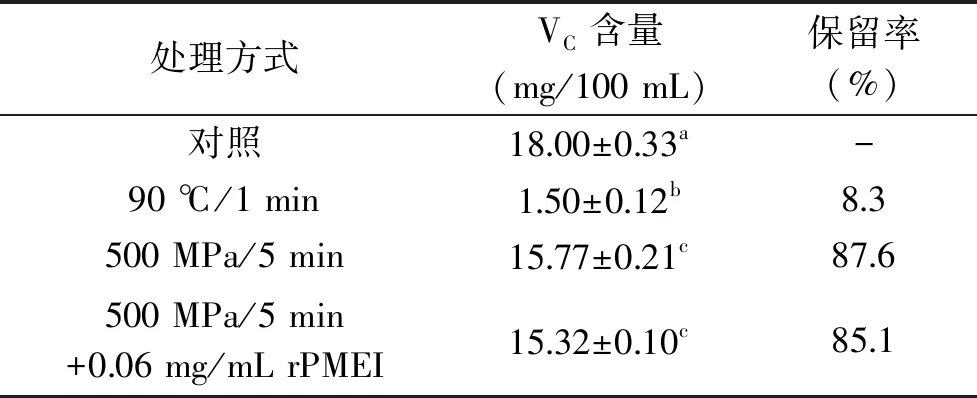
表4 不同处理条件对橙汁VC含量的影响
3 结论
对鲜榨橙汁进行500 MPa超高压处理5 min,菌落总数、霉菌与酵母菌数均在《NY/T 434-2016绿色食品、果蔬汁饮料》所规定的范围内。超高压(500 MPa/5 min)处理能够明显降低橙汁中PME活性,但不能完全钝化PME。向每毫升橙汁中添加0.06 mg及以上rPMEI,再进行超高压处理(500 MPa/5 min)能够完全钝化PME。超高压联合rPMEI对橙汁色泽的影响程度显著小于热处理组(p<0.05)。同时超高压联合rPMEI对橙汁VC保留率(85.1%)远高于热处理对橙汁VC保留率(8.3%)。综上所述,超高压(500 MPa/5 min)联合rPMEI(0.06 mg/mL)作用于橙汁不但能够达到商业无菌要求,同时能够完全抑制PME活性,并且能够显著改善橙汁的品质,从而从根本上解决了常规热处理及超高压处理所存在的问题。本研究所获得的实验结果有望解决当今果蔬汁加工产业所面临的关键问题。

