烤烟成熟期烟叶木质素合成关键酶基因的转录分析
高娅北,孙曙光,王胜雷,陈二龙,杨晓亮,孙占伟,宋朝鹏*
1 河南农业大学烟草学院,河南 郑州 450002;
2 湖北中烟工业有限责任公司,湖北 武汉 430040;
3 福建省烟草公司,福建 福州 350003;
4 河南中烟工业有限责任公司,河南 郑州 450016
木质素作为植物细胞壁的主要组成成分,与植物的抗倒伏能力、抗病性以及抗旱性等多种在生长发育过程中所形成的抗性特征密切相关[1-3],但在卷烟原料的生产上,过高的木质素含量会对卷烟产品燃吸时的感官质量以及安全性方面产生不利影响[4]。而成熟期是植物生长发育的关键时期,因此,探究成熟期烤烟木质素代谢机理可以合理调控烟叶的木质素含量,对促进优质烟叶的生产以及优质卷烟产品的生产具有重要意义。目前,国内外学者对于木质素的合成途径进行了大量研究,主要集中于2个方面,一是苯丙烷类代谢途径,即木质素与其他酚类物质合成所用的公共路径,主要包括PAL(苯丙氨酸解氨酶)、C4H(肉桂酸4-羟化酶)、4CL(4-香豆酰CoA连接酶)3种关键酶类,他们的基因表达量对木质素及其他酚类物质的生物合成及含量高低有重要影响[5-7];二是木质素单体合成的特异路径,主要包括上游的C3H(香豆酸3-羟化酶)、HCT(莽草酸羟基肉桂酰转移酶)、COMT(咖啡酸O-甲基转移酶)、CCoAOMT(咖啡酰CoA-O-甲基转移酶)和F5H(阿魏酸5-羟基化酶)以及下游的CCR(羟基肉桂酰CoA还原酶)、CAD(肉桂酸脱氢酶)和PAO(多胺氧化酶),这些合成酶基因表达量的高低不仅影响木质素含量的高低,还对其单体的组成有较大影响[8-11]。但关于烟草木质素合成路径的研究多集中于木质素与其他酚类物质合成的共用路径以及合成特异途径中的少数几个合成关键酶方面[12-14],缺乏对其的合成路径进行全面系统深入的研究,对于烤烟烟叶成熟过程中木质素合成积累的关键时期及合成关键酶基因尚不清楚。本研究以K326为材料,测定烟株成熟期烟叶生长发育过程的中部叶片硬度、叶片组织结构和木质素含量,应用qRT-PCR(荧光定量PCR)方法分析木质素合成路径上的12个相关合成酶基因PAL、C4H、4CL1、4CL2、C3H、F5H1、HCT1、CCR1、CCoAOMT5、COMT1、CAD2和PAO1的表达量,探究烤烟木质素在成熟期的合成规律、合成积累的关键点及其关键酶基因表达规律,旨在系统探究烟叶木质素合成的分子调控机制,为烤烟品种选育及优质烟叶生产提供理论依据。
1 材料与方法
1.1 试验设计
田间试验于2018年在河南省洛阳市洛宁县烟草科技示范基地(地处东经111°38',北纬34°26')进行。试验田植烟土壤为黄棕壤,肥力中等,0~20 cm土层含有机质13.54 g/kg、碱解氮75.16 mg/kg、速效磷9.16 mg/kg和速效钾164.38 mg/kg,土壤pH 7.26。
选用K326为试验品种。按照当地优质烟叶生产技术规范种植管理,行距110 cm,株距55 cm,单株留叶数18~20片,烟田施氮量为72 kg/hm2,使用烟草专用复合肥,N : P2O5: K2O=1 : 1 : 2。在打顶后当天、10 d、20 d、30 d、40 d和50 d进行取样(打顶后30天中部叶达到适熟状态),采集生长情况正常、叶片完整且朝向一致的烤烟中部叶(10~12叶位)20片,其中10片在采后立即去除主脉,混合第6至第7支脉叶肉样品10 g左右,用锡纸和纱布包裹后放入液氮中速冻,于-80 ℃超低温冰箱中进行保存,用于烟叶木质素含量和相关合成酶基因表达量的测定,其余鲜烟叶用于叶片硬度及组织结构测定。
1.2 测定指标与方法
1.2.1 叶片硬度和组织结构测定。
烟叶硬度测定参照蒋博文等[15]的方法,采用质构仪进行烟叶硬度测定;烟叶组织结构测定参照宋朝鹏等[16]的方法,利用8 mm打孔器分别在打顶后当天、30天和50天的叶片中部进行取样,采用常规石蜡包埋染色处理,制片,在Olympus光学显微镜下利用测微尺对叶片、上下表皮、海绵组织、栅栏组织厚度进行测量[17]。
1.2.2 木质素含量测定方法
将新鲜烟叶样品在80 ℃下烘干至恒重,将干燥后的样品磨碎过40目筛,称取5 mg于10 ml玻璃试管中,采用苏州科铭生物技术有限公司生产的木质素含量微量法试剂盒进行烟叶木质素含量测定。
1.2.3 木质素相关合成酶基因表达量分析
在NCBI的Gene数据库(NCBI; http://www.ncbi.nlm.nih.gov)检索烟草木质素合成相关酶的编码基因,分别获得普通烟草PAL、C4H、4CL1、4CL2、C3H、F5H、HCT、CCR、CCoAOMT、COMT、CAD和PAO蛋白的编码区序列(图1)。将获得的每个基因家族序列进行多序列比对,通过SMART(http://coot.embl-heidelberg.de/SMART)在线软件预测基因的保守区域,利用Primer 5.0在基因的5'保守区域设计特异qRT-PCR引物(表1)。
采用Trizol法提取烟草样品中总RNA,反转录合成cDNA[18]。利用QuantiFast SYBR Green PCR Kit试剂盒(Qiagen,Germany)在LightCycler 480Ⅱ型荧光定量PCR仪(Roche,Swiss)上进行qRT-PCR。选用烟草核糖体蛋白编码基因NtL25作为内参基因,反应程序为:95 ℃30 s,95 ℃30 s,60 ℃30 s,72 ℃ 30 s,95 ℃ 30 s,40 个循环。实验结果采用 2-ΔΔCt算法进行分析,确定各基因的相对表达量[19]。试验设置3次重复。
1.3 数据分析
运用Microsoft Excel 2010进行试验结果统计整理,运用Origin 2018进行图片绘制,运用SPSS 22进行方差分析及通径分析。

表1 烟草木质素合成相关酶基因qRT-PCR引物序列Tab.1 qRT-PCR primer sequence of lignin-related synthetase gene in tobacco leaves

续表1

图1 植物木质素生物合成路径(由文献[20-21]修改而成)Fig.1 Biosynthesis pathway of lignin in plants (modification based on[20-21])
2 结果
2.1 K326烟叶硬度和组织结构变化
由表2可见,烟叶硬度在打顶后的不同时期间差异显著,表现为打顶后先升高而后降低的变化趋势。烟叶在打顶后不同生长发育时期叶片厚度、上下表皮厚度、栅栏组织厚度以及海绵组织厚度之间存在着不同程度的差异,其中叶片厚度、栅栏组织厚度和叶片紧密度随烟叶打顶后天数的增加而显著减小,烟叶上表皮厚度和海绵组织厚度为打顶后30 d显著高于其他两时期,下表皮厚度则表现为打顶后30 d显著低于其他两时期;可见烟叶组织结构会随烟叶打顶后的生长发育发生明显的变化,各时期间差异明显。

表2 不同打顶时期烟叶硬度和组织结构的变化Tab.2 Changes in hardness and tissue structure of tobacco leaves at different topping stages
2.2 烟叶木质素含量变化
由图2可见,不同时期间烟叶木质素含量具有显著差异,在打顶后的成熟阶段,烟叶木质素含量呈现出先增加后降低的变化趋势,在成熟时(打顶后30天)含量达到最大值,而后随成熟度进一步增加含量略有降低,这也与烟叶硬度的变化表现出较为一致的规律。表明成熟期烟叶木质素含量变化较大,是其合成积累的重要时期。
2.3 木质素相关合成酶基因的qRT-PCR表达量
由图3可见,利用qRT-PCR技术对进入成熟期各发育阶段的烟叶中木质素合成上游、中游和下游各相关酶基因的相对表达量进行分析,结果表明各基因在烟叶组织中均有表达,但相对表达量各异。烟叶木质素相关合成酶基因表达量除局部波动外基本都呈现出先上调而后下调的变化趋势,在打顶后30 d其基因表达量最高,说明打顶后的烟叶成熟阶段是木质素合成积累的关键调控时期。
PAL、C4H、4CL1和4CL2基因为烟叶苯丙氨酸代谢途径中调控木质素和其他物质合成的共用相关酶基因[22],属于烟叶木质素合成途径上游的相关酶基因。在本研究中,PAL、C4H、4CL1基因在成熟过程中基因表达量前后差异较明显,且均在打顶后30 d基因表达量最高,而后迅速下调;PAL基因相对表达量呈先上调后下调的单峰曲线变化趋势;C4H在打顶后20 d略有下调而后迅速上调;4CL1在打顶后表达量呈逐渐下调的趋势,但前后差异不显著;而4CL2基因表达量在成熟过程中前后变化不明显;说明在木质素合成的苯丙氨酸代谢途径中,可能是PAL、C4H、4CL1基因所发挥的调控作用较大。
C3H、HCT1、COMT1、CCoAOMT5和F5H1是调控烟叶中木质素单体合成特异路径上游的相关酶基因。在本研究中CCoAOMT5、COMT1和F5H1基因的相对表达量在烟叶成熟过程中前后差异较大,且除个别时期外,其基因表达量均呈先上调后下调的单峰曲线变化趋势,在打顶后30 d其基因表达量最高;C3H和HCT1基因表达量在烟叶成熟过程中变化较小;说明在木质素单体合成的特异途径上游中,可能CCoAOMT5、COMT1和F5H1基因所发挥的调控作用较大。
CCR1、CAD2和PAO1基因是调控烟叶木质素单体合成特异路径下游的相关酶基因。在本研究中这些基因的表达量在烟叶成熟期均变化较大,且呈先增加,在打顶后30 d达到最大而后迅速下调的单峰变化趋势,说明这些调控木质素单体合成的下游相关酶基因可能对木质素的合成调控作用较大。
结合木质素合成的规律,发现PAL、C4H、4CL1、CCR1、CCoAOMT5、COMT1、CAD2、PAO1和F5H1基因表达规律与木质素合成规律较为一致,其中PAL、C4H、CCR1、CAD2和PAO1的表达量变化较大,我们推测这些基因可能在烟叶打顶后成熟期生长发育阶段的木质素代谢途径中发挥关键作用。
2.4 木质素含量与其合成相关酶基因表达量的相关性分析
由表3分析表明,木质素含量与PAL、C4H、CCR1、CAD2和PAO1基因表达量呈极显著正相关关系,与4CL1、CCoAOMT5、COMT1、F5H1基因表达量呈显著正相关关系,与4CL2、C3H和HCT1基因表达量相关性不显著;PAL、C4H、4CL1、F5H1、HCT1、CCoAOMT5、COMT1、CAD2、CCR1和PAO1基因的表达有明显的协同作用,相互之间的相关性达到显著或是极显著的关系,其表达量的变化趋势也较为相似。4CL2和C3H基因的表达量变化趋势与其他基因相差较大,其与木质素含量之间相关系数较小,且基因表达量与木质素含量之间为负相关关系。
2.5 木质素含量与其合成相关酶基因表达量的通径分析
由表4分析表明,烟叶木质素合成相关酶基因表达量对烟叶木质素含量的影响程度相差较大,除4CL2和C3H的基因表达量对烟叶木质素含量为负影响外,其他基因均为正影响。其中对木质素含量影响较大的的是PAL、C4H、PAO1、CAD2和CCR1,直接通径系数分别为0.24、0.19、0.19、0.17和0.16,且PAL、C4H和PAO1的间接通径系数也较大,表明其他基因通过PAL、C4H和PAO1对木质素含量均有较大的间接影响;虽然4CL1的间接通径系数较小,表明其他基因通过4CL1对烟叶木质素含量的间接影响略小,但4CL1基因表达量对木质素含量有相对较大的直接影响,直接通径系数为0.12;CCoAOMT5、COMT1和F5H1的基因表达量对木质素含量影响差别不大。HCT1和4CL2对木质素含量的影响较小,其中影响最小的是4CL2的表达量,直接通径系数为-0.03。可知,影响木质素含量变化的主要因素为PAL、C4H、PAO1、CAD2和CCR1的基因表达量。
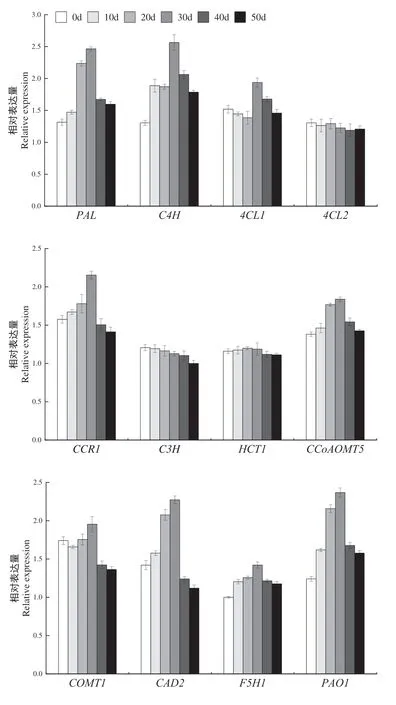
图3 烟叶成熟期木质素合成关键酶基因表达Fig.3 Gene expression of lignin biosynthesis in tobacco leaves at maturity stage

表3 木质素含量与合成相关酶基因表达量的相关性分析Tab.3 Correlation analysis between lignin content and expression quantity of lignin synthase-related genes

表4 木质素含量与合成相关酶基因表达量的通径分析Tab.4 Path analysis of lignin content and expression quantity of lignin synthase-related genes
3 讨论
木质素作为植物的细胞壁物质,其与纤维素结合后可使植物细胞壁具有一定的硬度和强度,其含量变化可改变植物组织硬度,影响组织结构的发育,从而使植物具有一定的抗倒伏及抗病能力[23-24]。成熟期是木质素代谢的关键时期,本研究表明各品种烟叶木质素含量随打顶天数的增加呈先增加后降低的变化趋势,打顶后30天达到峰值,随后烟叶衰老程度增加木质素含量降低,这也与玉米等作物叶片成熟过程中木质素含量的变化规律相一致[25-26],也可能与随着烟叶的衰老烟叶细胞壁物质逐渐降解有关[27];从烟叶在打顶后的硬度变化和组织结构发育情况来看,烟叶硬度先增加后降低,这可能与在生长发育过程中的木质素含量变化有关,这也与李玉菲[28]认为的木质素合成旺盛是造成烟叶偏硬的研究结果相一致;闫克玉等[29]研究认为烟叶木质素含量随烟叶厚度的增加而减少,本研究呈现相似的研究结果,打顶30d后烟叶厚度减小可能是由于随烟叶衰老,烟叶海绵组织以及栅栏组织逐渐萎缩引起的。
研究表明PAL、C4H、4CL1、4CL2、F5H1、HCT1、C3H、CCoAOMT5、COMT1、CAD2、CCR1和PAO1基因在木质素的合成过程中发挥有重要的调控作用[30],其表达量的大小与植物木质素合成量的多少密切相关[31-33]。本研究结果发现,PAL、C4H、4CL1、HCT1、CCoAOMT5、COMT1、CAD2、F5H1、CCR1和PAO1基因表达量基本呈单峰变化趋势,随成熟度的增加基因表达呈上调趋势,在打顶后30天及适熟时达到最大值,而后随叶片衰老表达量降低,这与黄杰恒等[34]的研究结果相一致,说明成熟期是烟叶木质素合成的关键时期;4CL2基因表达量在成熟期变化规律不明显,前后波动较大,与4CL1表达量变化趋势差别较大,这表明4CL1基因对木质素合成的调控作用较大,4CL2基因对木质素合成的调控作用不大;C3H基因表达量在打顶后初期呈下调趋势,可能受打顶后植物体内生理生化反应发生变化所影响,随后变化不明显,说明C3H表达量可能对烤烟叶片木质素含量影响不明显,这也与胡丹等[35]的研究结果一致。
相关分析及通径分析表明,PAL、C4H、4CL1、HCT1、CCoAOMT5、F5H1和PAO1基因在与烟叶木质素含量的相关系数及直接通径系数较大,表明他们的相对表达量对烟叶木质素的含量变化影响较大;C3H的基因表达量对木质素合成会产生负向影响,但直接通径系数较小,为-0.10,说明它们对烤烟叶片木质素的合成具有负调控作用,如果在一定范围内降低其表达量,对木质素的含量变化可能不会造成影响,但对于抑制其表达对烤烟烟叶木质素合成的影响还需进一步研究。4CL1与4CL2为植物4CL家族基因,在本研究中,4CL2对烟叶木质素的合成呈负向影响且直接通径系数较小,这也与HU等[36]的研究结果一致,是由于二者的差异表达从而调控不同苯丙氨酸代谢途径代谢产物的生物合成,4CL1主要参与木质素的生物合成而4CL2主要参与类黄酮等物质的生物合成所引起的。
4 结论
在烤烟中部叶打顶后进入成熟阶段,烟叶木质素含量呈先增加后降低的变化规律,打顶后0-30天是其合成积累的关键时期,在叶片成熟时(打顶后30天)其含量最高;研究其基因表达模式发现,PAL、C4H、CCR1、CAD2和PAO1基因对烟叶木质素合成积累量的影响较大(p<0.01,r=0.93,0.90,0.91,0.90,0.89;P=0.24,0.19,0.16,0.17,0.19),是烤烟中部叶木质素合成积累过程中的关键调控基因。本研究从分子生物学角度探究了不同品种烤烟中部叶成熟期叶片木质素合成及关键合成酶基因表达的规律,为烤烟木质素代谢的分子作用机理提供了理论基础。

