大白菜黄化突变基因Bra024218表达模式分析
李 想,黄胜楠,刘志勇,冯 辉
(沈阳农业大学 园艺学院,沈阳 110161)
叶片是植物光合作用的主要场所,是光合色素等多种有机物的形成场所[1]。 叶色突变通过影响光合作用,进而影响植株的生长发育。AWAN 等[2]将叶色突变划分为白化、黄化、淡绿、绿白、白翠、黄绿、绿黄和条纹。其中黄绿叶色突变最为普遍,主要表现在叶绿素缺乏,植株矮小,生长迟缓,导致减产甚至是植株死亡等方面[3-4]。 叶色突变不仅能为探究植株叶绿体发育及叶绿素生物合成提供材料,而且在苗期还能作为杂种优势利用的显著标记性状。 在胚胎形成过程中,叶绿体首次分化发生在由球形期至心形期转化的过程中,此后,在心形期胚胎开始积累叶绿素[5-6]。 在绿色胚胎中叶绿体的功能是光合作用为胚胎提供营养,并且合成许多重要的物质[5,7]。 种子存储的物质和能量,能够提供新陈代谢前体及化学能来保障幼苗生长直到它能够自己从太阳汲取能量[8-9]。在拟南芥中,大约30%的胚胎缺陷突变是由编码定位于叶绿体蛋白的基因突变导致的[10-11]。 许多EMB 蛋白参与植物特异进程,支持叶绿体翻译或者与其他叶绿体蛋白互作。叶绿体发育与胚胎发育紧密相关。阻碍叶绿体发育的突变,通常表现为胚胎发育缺陷[12-17],如有些参与叶绿体膜质生物合成的基因突变导致胚胎致死[18-19]。 然而,一些黄化或色素缺失的突变体,还是可以形成正常种子的[20]。 大部分涉及光合作用的基因突变,例如VAR2,PsbP 和CHL27 不会导致胚胎致死,而是产生白绿,黄色或杂色的幼苗[21-23]。 某些参与叶绿素生物合成的基因突变也不会导致胚胎致死[24-26]。 在被子植物生活史中种子占有重要地位,而胚胎是种子的主要组成部分。因此对胚胎发育的研究意义重大。近年来对于大白菜中胚胎发育的研究相对较少[27-28]。但在十字花科模式植物拟南芥中,胚胎发育的研究就相对较为系统,全面。 热休克蛋白(Hsp90C)参与胞质蛋白进入叶绿体前的正确折叠,杂合体hsp90c 植株角果约有25%白化胚珠,最终不能形成正常种子[29]。 对磷酸甘油酸盐脱氢酶突变体(pgdh1)的分析发现胚胎致死表型,纯合体胚形态异常,种子白化透明[30]。 拟南芥核糖核酸酶J(RNJ)可以保证叶绿体基因的正常翻译,其缺失会引起胚胎细胞中叶绿体结构缺陷,导致胚胎发育紊乱[31]。 这些研究表明叶绿体蛋白在胚胎发育中发挥着重要的作用。 启动子是调控基因表达的重要顺式作用元件,决定着特定基因的定时、定量、定位表达。 启动子能活化RNA 聚合酶,使之与模板DNA 准确的结合,在转录环节调控基因表达[32-33]。启动子中有很多顺式作用元件参与基因转录,最主要的就是TATA 框及CAAT 框,其中CAAT 框功能与RNA聚合酶结合相关。有些叶色突变是由突变基因的启动子区域发生变化而导致的[34-35]。本研究报道大白菜黄化突变体pem 候选突变基因Bra024218 的表达模式分析结果。Bra024218只在叶绿体中表达;突变体pem 在该基因的启动子上30bp 的片段缺失,导致了基因表达上的显著差异,并使得启动子活性下降。
1 材料与方法
1.1 材料
大白菜黄化突变体pem,是本课题组利用大白菜DH(Doubled Haploid)系FT 为试材,花蕾用60Co-γ射线辐射诱变处理后进行小孢子培养,获得的1 个整株黄化的突变体[36]。本研究以大白菜黄化突变体pem 及其野生型FT 为试材,种植于沈阳农业大学蔬菜育种试验基地,取样进行基因表达特性分析。
1.2 方法
1.2.1 突变体pem 农艺性状及光合色素分析 当植株第3 片真叶出现时, 随机选取黄化突变体pem 和野生型FT 各5 株,对于叶长,叶宽,株幅,干重及鲜重进行测定。 当叶球成熟后,在田间随机选取黄化突变体pem 和野生型FT 各10 株,去掉根部,称取植株重量。 外叶去掉后,对于叶球的净重,横径及纵径进行测量。 结果用SPSS软件进行差异显著性分析。
在苗期,从植株第6 片真叶上,称取0.1g 叶片组织。 配制80%的丙酮乙醇(v/v=4:1)溶液浸泡叶片,以提取叶片中的叶绿素及类胡萝卜素,至叶片脱色至白色,利用DU800 型紫外分光光度计(Beckman Coulter,美国),测定丙酮乙醇溶液在663,645 和470nm 波长下的吸光值,试验设3 次生物学重复。 参照ARNON[37]的方法计算总叶绿素,叶绿素a,叶绿素b 及类胡萝卜素的含量。
1.2.2 突变基因Bra024218 序列分析 在芸薹属植物数据库(http://brassicadb.org/brad/)中获得突变基因Bra024218 的氨基酸序列, 其余物种中同源基因的氨基酸序列于National Center for Biotechnology Information(https://www.ncbi.nlm.nih.gov/)中获得。 根据氨基酸序列相似性,利用MEGA6 软件构建系统进化树。
1.2.3 RNA 提取,cDNA 合成以及RT-PCR 利用RNA 快速提取试剂盒(Aidlab,北京),分别提取突变体pem及野生型FT 的总RNA。根据叶片不同时期分为子叶、第1 片真叶、第3 片真叶、第6 片真叶、莲座叶、球型期叶及休眠期叶进行取样。 根据植株不同部位分为根、茎、叶、花蕾、花及种荚。 利用反转录试剂盒(Vazyme,南京)将RNA 反转录为cDNA 单链,以此为模板进行聚合酶链式反应(RT-PCR)。利用Actin 基因作为内参基因[38]。突变基因及内参基因的扩增引物序列见表1。 10μL 的RT-PCR 反应体系中包括1μL cDNA 模板,各0.5μL 上、下游引物,1μL 10×PCR buffer(含 Mg2+),0.8μL dNTPs,0.2 μL Taq DNA 聚合酶及 6 μL 无菌水。反应程序为 95℃预变性5min,35 个循环包括 95℃ 变性 30 s,58℃退火 30s 及 72℃延伸 1min,最终 72℃延伸5min。
1.2.4 GUS 载体构建及GUS 分析 通过对突变基因Bra024218 启动子的序列分析及核心区域预测, 分别将野生型FT 中Bra024218 启动子JDN 及突变体pem 中Bra024218 启动子JDM,进行PCR 扩增(引物序列见表1)。将PCR 产物通过胶回收试剂盒纯化后,将其与pCAMBIA1301S 载体采用Hind Ⅲ/BgI Ⅱ双酶切线性化后,通过胶回收获得目的片段与载体片段。 将回收纯化好的目的片段和载体片段,进行连接,采用热激法转化入感受态菌株TOP10 中,卡那霉素抗性筛选单菌落。 挑选单菌落用PCR 扩增筛选阳性克隆,提取质粒测序验证。
利用农杆菌介导的蘸花法将构建好的GUS 载体转入拟南芥野生型Col-0中,待植株结荚收种子,在头孢及潮霉素抗性培养基上筛选。 抗性植株长大后,取植株叶片提取DNA 进行PCR 检测。 选取有目的片段条带的植株进行GUS 染色。 利用GUS 染色试剂盒(中科瑞泰,北京)对各品种转基因植株的根、茎、叶、花器官及种荚进行染色。 在37℃下暗培养24h 至材料出现蓝色,将材料转入无水乙醇中脱色2~3 次,至阴性对照材料为白色,最终用体视显微镜(Nikon,日本)进行观察。
选取有GUS 信号的拟南芥植株,用GUS 提取液提取GUS 酶,用蛋白质定量试剂盒(TaKaRa,大连)测定GUS 提取液蛋白含量。 之后进行GUS 荧光测定,先制作4-MU 标准曲线,之后吸取200μL GUS 提取液加入至450μL 37℃预热的 2mmol·L-1MUG,迅速充分混合,取出 100μL 加入 900μL 的反应终止液 Na2CO3作为酶促反应 0 点,在 37℃下进行酶促反应,分别在 10,30,60,100min 时取出 100μL 加入 900μL 的反应终止液。最终在激发光365nm,发射光455nm 的条件下测定样品的荧光强度。
1.2.5 亚细胞定位 将突变基因Bra024218 的全长编码区序列用PCR 扩增 (引物序列见表1), 利用BsaI/E-co31I 对载体pBWA(V)HS-Bra024218-GLosgfp 进行酶切反应,利用BsmBI/Esp3I 对cDNA 进行酶切反应,将载体酶切物和回收片段酶切产物用纯化试剂盒纯化,用T4-ligase 进行连接反应。 将5~10μL 连接产物转化大肠杆菌TOP10 感受态,转化涂(卡那霉素)抗性平皿,37℃培养12h,进行菌斑PCR 鉴定。 目标条带为1000bp 左右的片段。 选1~3 个阳性条带对应的菌液,取100μL 送样测序,其余400μL 菌液接种到含有5~10mL(卡那霉素)抗性LB 中,试管摇菌,待测序结果出来后,对应测序正确的取一管提取质粒。 将提取的质粒用EcorV 酶切,进行酶切验证。
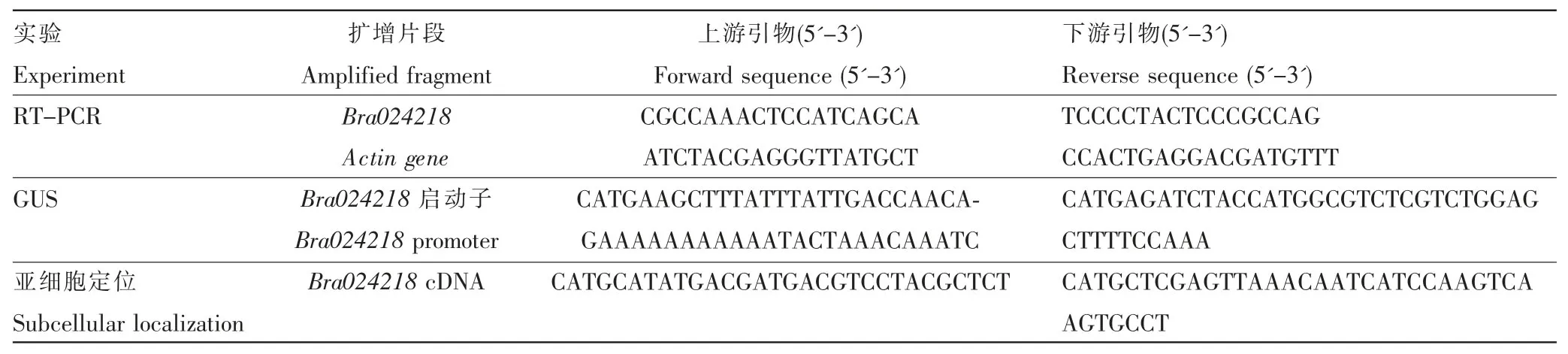
表1 引物序列Table 1 Primer sequences
选取生长20~30d 的野生型拟南芥,从中提取原生质体[39]。将原生质体与构建好的载体融合,过夜培养之后用激光共聚焦显微镜(Leica,德国)进行观察。
选取生长约40d 的烟草,使用农杆菌注射的方法,进行烟草瞬时表达[40],最后用激光共聚焦显微镜进行观察。
2 结果与分析
2.1 突变体pem形态特征
与野生型FT 相比,突变体pem 从苗期就表现为叶片黄化,生长发育缓慢,叶长、叶宽、株幅、干重及鲜重均显著降低。这种趋势一直持续到结球期,虽然田间株幅差异不大,但测量结果表明野生型FT 整株产量为(0.86±0.02)kg,黄化突变体 pem 整株产量为(0.53±0.01)kg,突变体产量显著降低(p=0.05)。 最终形成的叶球也较小,净重、横径及纵径也显著降低(图1)。 与野生型FT 相比,黄化突变体pem 的叶绿素a、叶绿素b、总叶绿素及类胡萝卜素含量均显著降低。
2.2 突变基因Bra024218系统进化树构建
根据对突变基因Bra024218 氨基酸序列分析,利用NCBI BLAST 找到与之相似性较高的氨基酸序列(图2)。结果表明,拟南芥的氨基酸序列与突变基因Bra024218 的氨基酸序列同源性较高。 在相似性较高的蛋白质中,大部分为无功能描述的蛋白及假定蛋白,而在拟南芥中,该蛋白的功能为EMB1923(embryo defective 1923),为胚胎缺陷蛋白。 另外在山黄麻属中,与突变基因同源性较高的蛋白质功能也是胚胎缺陷。

图1 野生型FT 及突变体pem 形态特征比较(左.突变体pem;右.野生型 FT)Figure 1 Morphological characteristics of FT and pem(Left.pem;Right.FT)

图2 突变基因Bra024218 系统进化树Figure 2 Phylogenetic tree of Bra024218
2.3 突变基因Bra024218的表达分析
利用RT-PCR 对于突变体pem 及野生型FT 植株的不同部位及叶片不同时期进行表达量的分析 (图3)。 在野生型 FT 中,根、茎、叶、花蕾、花及种荚均有表达, 而在突变体pem 中各部位表达强度均有下降,其中根和花蕾的表达量显著减弱。 针对叶片进行了不同时期的表达量分析,在野生型FT 中,子叶、第1 片真叶、第3 片真叶、第6 片真叶、莲座期叶、球型期叶及休眠期叶均有表达,在突变体pem 中第1 片真叶和第3 片真叶的表达量显著下降。
2.4 候选基因Bra024218启动子活性分析
利用启动子在线分析软件PlantCARE 对Bra024218 基因启动子序列进行了元件分析预测,结果表明启动子序列中含有多种典型的启动子通用顺式作用元件, 具体分为启动子核心元件TATA 框、CAAT 框、光响应元件、发育响应元件、激素响应元件和胁迫响应元件等。 Bra024218 基因启动子序列中作用元件如图4 所示。 其中野生型FT 和黄化突变体pem 有差异的序列上含有一个启动子核心元件CAAT 框。 对野生型FT 中候选基因Bra024218 启动子核心区域进行预测。 结果表明启动子上有两个区域可能为核心区域,其中第2 个区域为野生型FT 与突变体pem 有差异的区域。
选取PCR 检测有条带的拟南芥植株,取根、茎、叶、花器官及种荚的不同部位进行GUS 染色。 结果表明在显微镜观察下与JDN 相比,JDM 各部位表达均相对减弱(图5)。进一步定量地进行GUS 酶活性测定。结果表明野生型启动子JDN 中每分钟每毫克GUS 酶生成(2.92±0.27)nmol 4-MU,而突变体启动子JDM 中每分钟每毫克 GUS 酶则生成(1.94±0.05) nmol 4-MU,与野生型相比GUS 酶活性显著下降。 由此推测突变体pem 中突变基因Bra024218 的启动子片段缺失影响了启动子活性。
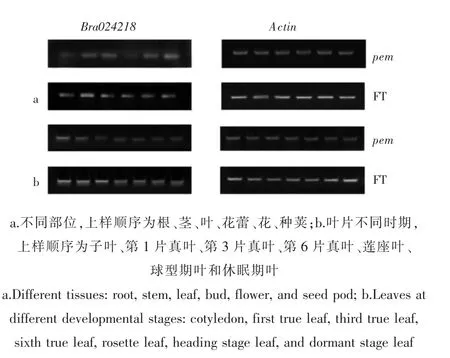
图3 突变基因Bra024218 的表达分析Figure 3 Expression analysis of Bra024218 using RT-PCR
2.5 突变基因Bra024218亚细胞定位
利用观察拟南芥原生质体及烟草叶片, 进行突变基因Bra024218 的亚细胞定位分析。 结果表明,在拟南芥原生质体中明场下可以清楚观察到其结构,绿光下突变基因Bra024218 上添加的GFP 标签有表达,红光下叶绿体自发荧光也有表达,合成之下绿光和红光表达部位可以重叠(图6a)。 烟草叶片上明场下可以观察到保卫细胞结构, 保卫细胞的外圈分布着叶绿体, 同样绿光和红光表达部位可以重叠 (图6b)。 两种观察结果表明突变基因Bra024218 在叶绿体上进行表达。
3 讨论与结论
在高等植物中, 胚胎发生是植物生命周期中的重要发育阶段。 在拟南芥中对于胚胎缺陷突变体有系统的分析[41]。 BRYANT 等[42]报道 119 个核编码的叶绿体蛋白,其中大约30%的EMB 基因对于拟南芥的胚胎发生至关重要。 这表明胚胎发生过程中叶绿体的重要性。 YE 等[43]报道突变体emb2738 的超微结构结果表明质体严重受损,没有观察到膜结构。 这是由于拟南芥胚胎细胞在叶绿体分化过程中受阻, 导致emb2738 胚胎转绿之前受到损伤, 进而破坏了多种叶绿体代谢进程。 这可能影响拟南芥的胚胎发育过程中程序化的细胞分化。
已有研究表明, 质体生物合成与胚胎发育紧密相关,假定的原因是质体合成许多重要产物(碳水化合物,脂肪酸,氨基酸等)为其余细胞所用。 除了为胚胎发育提供营养, 假定叶绿体发育中也会产生一种调控核基因表达的信号, 从而影响胚胎发育[13,32]。LIANG 等[44]报道emb1211 突变与之前报道过的一些突变相同[11-12],叶绿体发育均有缺失,组织培养也不能挽救胚胎致死, 表明质体与细胞核之间存在一种与发育相关的联系。
顺式作用元件是启动子中的特定基序, 能够与转录因子结合,调控下游基因的表达,因此启动子在基因表达调控中发挥重要作用[45]。 根据PlantCARE数据库分析结果,Bra024218 基因启动子中除了含有基本的 TATA 框和 CAAT 框, 还有 Skn-1-motif,GAG-motif,TCT-motif 及 O2-site 等多个应答胁迫的顺式作用元件。 而野生型FT 与突变体pem 中Bra024218基因启动子的差异序列上就存在一个CAAT 框,研究表明CAAT 框有助于增强基因转录,调控转录起始频率[46]。将野生型FT 与突变体pem 中Bra024218 基因启动子转化至拟南芥植株后,GUS 信号及GUS 酶活测定均说明与野生型相比,突变体中Bra024218 启动子的活性相对减弱,可能是由于缺失的CAAT 框导致的。

图4 基因Bra024218 启动子序列中作用元件Figure 4 The elements on the promoter sequence of Bra024218

图5 不同部位GUS 强度分析 (根、茎、叶、花器官、种荚)Figure 5 GUS analysis of different tissues (root, stem,leaf, flower and seed pod)
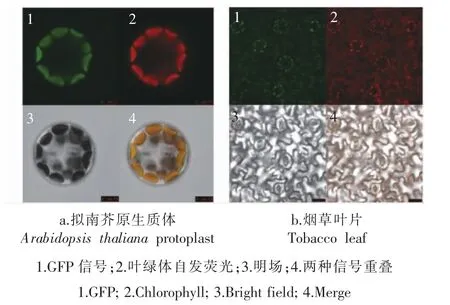
图6 突变基因Bra024218 的亚细胞定位Figure 6 Subcellular localization of Bra024218
尽管Bra024218 的生化机制并不明确, 但有证据表明对于正常的植株生长及叶绿体发育Bra024218 是必需的。RT-PCR 及GUS 分析表明Bra024218 几乎在所有组织及时期都是表达的,但突变体中表达相对减弱。在拟南芥原生质体及烟草叶片中Bra024218-GFP 的亚细胞定位结果表明Bra024218 只在叶绿体中表达。 因此,Bra024218 的功能可能为叶绿体发育所需。
本研究对于导致黄化突变体pem 的候选基因Bra024218 进行了表达模式的分析, 为今后对于Bra024218 生化特性的研究奠定了基础,进一步深入研究将会为其在叶绿体发育及胚胎形成过程中的功能提供更多线索。

