辽宁西瓜和甜瓜细菌性果斑病的病原鉴定
于海博,毕馨月,夏 博,安梦楠,夏子豪,吴元华
(沈阳农业大学 植物保护学院,沈阳110161)
瓜类细菌性果斑病(Bacterial fruit blotch)是一种典型的种传细菌性病害,严重危害葫芦科作物,其病原菌为西瓜噬酸菌(Acidovorax citrulli)[1-2],已被列入中华人民共和国进境植物有害性生物名录中,目前我国已有14个省份报道了细菌性果斑病在甜瓜、西瓜等作物上的发生[3-4]。 辽宁省西瓜、甜瓜产业历史悠久,是我国重要产区和优势产区。2013年,辽宁省曾报道了细菌性果斑病的发生,但并未对病原菌进行系统鉴定及序列分型等研究[5]。近几年,辽宁省西瓜、甜瓜种植基地果实和叶片上经常发生疑似瓜类细菌性果斑病,病情严重,已造成较大损失。2017年,锦州凌海市右卫镇西瓜产区在果实成熟期暴发疑似细菌性果斑病,发病面积34hm2,发病率高达80%,西瓜几近绝产;2018年,锦州凌海市多处甜瓜冷棚内又暴发疑似细菌性果斑病,造成甜瓜病果上出现水渍状墨绿色稍凹陷病斑,果肉组织褐腐或木栓化,不能食用。 为了综合防控措施的有效实施,本研究对该疑似病害的致病菌以及其亚群类型进行了深入研究。
1 材料与方法
1.1 材料
供试西瓜果实采自辽宁省锦州市凌海市右卫镇; 供试甜瓜果实采自辽宁省锦州市凌海市三台子镇和翠岩镇。 供试对照菌株AAC00-1 和pslbtw8 由中国农业科学院植物保护研究所赵廷昌研究员馈赠。
供试抗血清购自北京中检葆泰生物技术有限公司经销的美国Agdia 公司产品;2×Premix 购自TaKaRa 生物工程有限公司。
1.2 方法
1.2.1 病害症状观察 2017年7月对病害发生区辽宁省锦州市凌海市右卫镇西瓜种植区进行田间调查,2018年5月对辽宁省锦州市凌海市三台子镇和翠岩镇甜瓜种植棚开展了系统调查,调查发病情况并记载病害症状。
1.2.2 病原菌的分离、纯化 分别取凌海市右卫镇发病西瓜果实、三台子镇发病甜瓜果实、翠岩镇发病甜瓜果实,采用常规的组织分离法对病原菌进行分离;用灭菌解剖刀切取病健交界部位组织,75%酒精浸泡3~5min,无菌水冲洗3 次,每次2min。 取出组织加800μL 无菌水捣碎,浸泡30min 后,用接种环蘸取组织浸出液在KB培养基上划线,28℃恒温培养48h。 长出单菌落后再连续3 次划线培养,使菌株纯化。
1.2.3 病原菌致病性测定 根据柯赫氏法则进行致病性研究,将纯化后的菌株在KB 平板上培养48h 后,挑取单菌落接种于KB 液体培养基28℃过夜培养, 配制成1×108CFU·mL-1菌悬液。 采用针刺法和喷雾法接种到西瓜、甜瓜幼苗上,以接种菌株AAC00-1 为阳性对照,以接种清水为阴性对照,每个处理重复3 次,28℃保湿48h后观察发病情况。 出现症状后,从病斑上再分离病菌,与原接种菌株进行比较。
1.2.4 病原菌培养性状观察 按一般细菌学常规方法进行病原菌培养性状观察, 将纯化后的菌株接种于KB平板上,28℃下培养48h 后观察菌落形态。
1.2.5 病原菌生理生化特性测定 将3 个菌株分别接种于KB 培养基上,以西瓜噬酸菌标准菌株AAC00-1 为阳性对照,28℃培养48h 后,参照SCHAAD 的方法[6]进行病原菌生理生化性状测定,每个处理重复3 遍。
1.2.6 病原菌DAS-ELISA 血清学鉴定将3 个菌株分别接种于KB 培养基上,28℃培养48h 后,挑取单菌落,加入装有300μL 样品提取缓冲液的离心管中,搅拌混匀,根据西瓜噬酸菌(Aac)检测试剂盒说明书进行DASELISA 检测,每个处理3 个重复。
1.2.7 病原菌PCR 检测 根据ITS 区两端的保守序列,利用Primer Premier 6.0 软件设计特异性引物YH1/YH2,扩增菌株的16S-23S rDNA ITS 序列;正向引物YH1 的序列为5′-TGTACACACCGCCCGTCACAC-3′;反向引物YH2 的序列为5′-CCATTCAGAAATCTCCGGATC-3′,扩增的目的片段长度为850 bp。将供试菌株接种于KB 培养基上,28℃培养 48h 后, 挑取单菌落用作 PCR 模板。 PCR 扩增体系 (20μL):2×Premix10μL,YH1 和 YH2 各0.5μL(10mol·L-1),dd H2O 9μL,引物由上海生工生物工程有限公司合成。 PCR 反应条件为:95℃预变性 4min,94℃变性 20s、55℃退火 20s、72℃延伸 1min,35 次循环后,72℃延伸 7min。 PCR 产物纯化后,送至上海生工生物工程有限公司测序,测序结果通过BLAST 与GenBank 中的核酸序列进行比对分析。
1.2.8 病原菌的亚群鉴定 将供试菌株JZ17,JZX2,JZT8,对照菌株pslbtw8(亚群I)和对照菌株AAC00-1(亚群II)28℃培养48h 后,挑取单菌落用作PCR 模板,采用ZHONG 等[7]根据pilL 基因设计的特异性引物PL1/PL2 扩增目的片段,已知该引物对在亚群I 的菌株中不能扩增出目的条带,在亚群II 的菌株中可扩增出大小为332bp 的特异性条带;引物序列 PL1 为 5′-GTCCGAGCGTACGTTGAG-3′;PL2 为 5′-ACGGCACCTGACCCGTTG-3′。PCR 反应条件为:94℃预变性 3min,94℃变性 30s、58℃退火 30s、72℃延伸 30s,25 次循环后,72℃延伸 10min。
1.2.9 病原菌的16S rDNA 序列分析 采用16S rDNA 通用引物27F/1492R[8]对菌株JZ17、JZX2、JZT8 的16S rDNA序列进行扩增,引物序列 27F 为 5′-AGAGTTTGATCCTGGCTCAG-3′;1492R 为 5′-GGTTACCTTGTTACGACTT-3′,扩增目的片段长度为 1400bp。 PCR 反应条件为:95℃预变性 4min,94℃变性 20s、55℃退火 20s、72℃延伸1min30s,35 次循环后,72℃延伸7min。将扩增产物送至上海生工生物工程有限公司测序,测序结果通过BLAST与GenBank 中的核酸序列进行比对分析。 选取与该菌序列同源性较高的菌株和噬酸菌属的其他4 个亚种,以Xanthomonas campestris 和Pseudomonas syringae 为外群,用MEGA 6.05 的Neighbor-Joining 法构建系统发育进化树。
2 结果与分析
2.1 病害症状
在锦州凌海市右卫镇的田间调查中发现, 感病西瓜果实初期出现水渍状病斑, 后渐变为暗绿色至褐色大斑,病斑进入果肉,造成孔洞状伤害,后期果皮龟裂,表面溢出粘稠、透明的琥珀色菌脓,随着病原菌深入果肉,并因杂菌感染,最后引起全果腐烂,失去食用价值(图1A 和B);叶片受害初期为水渍状病斑,后渐变成多角形或不规则褐色坏死病斑,病斑周围黄色晕圈明显,后期病斑有菌脓溢出,干后形成白色发亮的菌痂(图1C);在锦州凌海市三台子镇和翠岩镇甜瓜种植区的调查中分别发现品种京蜜甜王和久红瑞甜瓜果实上感染初期有水浸状病斑,圆形或卵圆形,稍凹陷,呈绿褐色,随后扩大为不规则的褐色水渍状大斑,病菌侵入果肉组织造成水浸状、褐腐或木栓化(图1D、图1E、图1F 和图1G)。
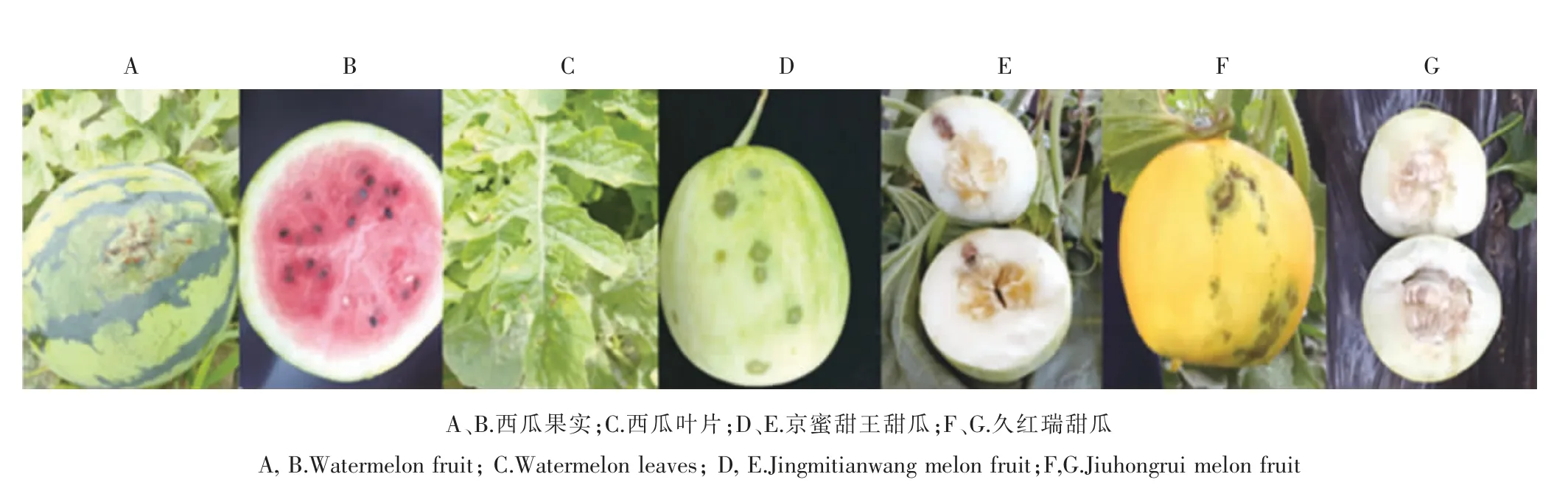
图1 西瓜、甜瓜果实和叶片病害田间症状Figure 1 The symptoms of diseased fruits and leaves of watermelon and melon in field
2.2 病原菌的致病性
本研究分别从凌海市右卫镇发病西瓜果实上、三台子镇发病甜瓜果实上和翠岩镇发病甜瓜果实上,分离纯化得到了11 个菌株、7 个菌株和9 个菌株,这些菌株在验证接种的第2 天,西瓜和甜瓜叶片上均开始发病,病斑初期为水渍状,后渐变成多角形或不规则褐色坏死病斑,病斑周围有黄色晕圈。 从发病部位经组织分离后再次得到了病原菌, 其培养的菌落性状和初分离时一致, 表明分离的原接种菌株为致病菌。 从上述若干菌株中,选取右卫镇西瓜果实上的菌株JZ17、三台子镇甜瓜果实上的菌株JZX2 和翠岩镇甜瓜果实上的JZT8,分别代表从西瓜和甜瓜上分离纯化出的病原菌进行后续试验。
2.3 病原菌的培养性状
3 个菌株在KB 平板上生长48h 后,均形成乳白色圆形菌落,菌落光滑、不透明、无黏性、中间稍突起,边缘整齐,菌落直径为1~2mm,41℃能够生长。
2.4 病原菌的生理生化特性
3 个菌株与对照菌株测试结果一致,都不能在KBA 培养基产生荧光,不产生果聚糖,不能产生吲哚,不能水解淀粉,甲基红试验阴性,能使硝酸盐还原,明胶液化,氧化酶和过氧化氢酶试验呈阳性,V.P 试验阳性,可水解吐温-80。
2.5 病原菌DAS-ELISA 血清学鉴定
利用DAS-ELISA 对供试菌株进行检测, 紫外可见分光光度计检测结果表明, 菌株JZ17,JZX2 和JZT8 的A405值与阴性对照A405值的比值分别为26.2,14.7,16.0,均大于2.0,结果呈阳性,判断供试菌株为瓜类细菌性果斑病菌。
2.6 病原菌PCR 检测
利用特异性引物YH1/YH2,对3 个菌株的16S-23S rDNA ITS 序列进行扩增,均获得了850bp 的目的片段(图2)。将3 个菌株扩增得到的序列用BLAST 在GenBank 中进行同源性比对,结果表明,菌株JZ17,JZX2,JZT8与西瓜噬酸菌(Acidovorax citrulli)各菌株ITS 序列相似性均高达99%以上。
2.7 病原菌亚群鉴定
采用已报道的特异性引物PL1/PL2 鉴定3 个菌株的亚群地位, 结果表明, 供试菌株JZ17 和对照菌株AAC00-1(亚群II)均可扩增出大小为332bp 的特异性目的条带,而菌株JZX2,JZT8 和对照菌株pslbtw8(亚群I)不能扩增出条带(图3),因此可将菌株JZ17 鉴定为西瓜噬酸菌亚群II 型菌株,菌株JZX2 和JZT8 为亚群I 型菌株。
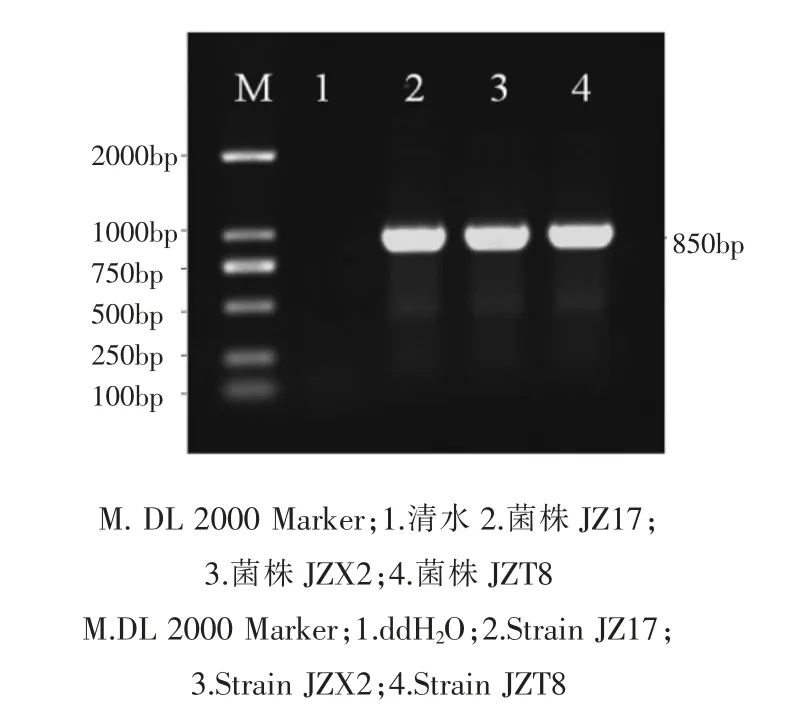
图2 不同菌株ITS 区PCR 电泳图谱Figure 2 PCR amplification of sequence in ITS region of different strains

图3 PL1/PL2 引物扩增不同菌株的PCR 电泳图Figure 3 PCR amplification of different strains amplified by PL1/PL2 primers
2.8 病原菌16S rDNA序列分析
采用16S rDNA 通用引物27F/1492R 对3 个菌株16S rDNA 序列进行扩增,均获得了1400bp 的目的片段,GenBank 登录号分别为 MH753658,MH753671 和 MH753672。 将 3 个菌株的 16S rDNA 序列用 BLAST 在 Gen-Bank 中进行同源性比对,结果发现,菌株 JZ17,JZX2,JZT8 与 Acidovorax citrulli 各菌株 16S rDNA 的相似性均达99%以上。 使用 MEGA 6.05 软件,基于Neighbor-Joining 法构建系统发育进化树(图 4),菌株JZ17,JZX2,JZT8 与 Acidovorax citrulli 各菌株聚为一类,菌株 JZ17 与 JXZS6 处于同一分支,菌株 JZX2,JZT8 与 XJ-6,pslb-25处于同一分支。

图4 菌株JZ17,JZX2,JZT8 及相关菌株的系统发育进化树Figure 4 Phylogenetic tree of strain JZ17, JZX2, JZT8 and relevant strains
3 讨论与结论
噬酸菌属(Acidovorax)共有 5 个种,即 A. citrulli,A. avenae,A. cattleyae,A. konjaci 和 A. facilis,阚玉敏等[9]、回广文等[10]根据16S~23S rDNA 的ITS 区序列设计的引物SEQID4m/SEQID5 和HuiF/HuiR 可将西瓜噬酸菌(A.citrulli)与噬酸菌属的其他4 个种区分开,表明西瓜噬酸菌ITS 序列与噬酸菌属其他4 个种存在明显差异。 因此, 本研究亦根据ITS 区两端的保守序列, 设计特异性引物YH1/YH2 扩增16S~23S rDNA ITS 序列, 获得了850bp 的目的片段,序列测定分析表明,3 个菌株与A. citrulli 各菌株ITS 区序列的同源性均高达99%以上。 结合柯赫氏法则和DAS-ELISA 阳性反应结果,可将辽宁省锦州市凌海市西瓜和甜瓜果实上分别分离到的3 个菌株JZ17,JZX2 和JZT8 鉴定为西瓜噬酸菌(Acidovorax citrulli)。辽宁省西、甜瓜生产历史悠久,是我国西、甜瓜生产的重要产区和优势区域,种植面积在6.7 万hm2。 本研究对发生在西瓜和甜瓜果实上的斑点腐烂病害进行了病原鉴定,并诊断为检疫性病害——瓜类细菌性果斑病,对于阻止该病害的进一步蔓延和制订有效防控措施具有重要意义。
瓜类细菌性果斑病菌遗传多样性丰富,通过多位点序列分型(MLST)、脉冲场凝胶电泳(PFGE)、基因外重复回文序列PCR(REP-PCR)等方法,可将病原菌分为两个亚群,即亚群I(主要分离自甜瓜、南瓜等)和亚群II(主要分离自西瓜)[11-13];但亚群I 和亚群II 致病力有差异,亚群I 的菌株对各个寄主的侵染力比较平均,亚群II 的菌株对西瓜幼苗的侵染力强于甜瓜和南瓜等[14]。为了区分西瓜噬酸菌的两个亚群,ZHONG 等[7]通过研究设计出基于pilL 基因的特异性引物PL1/PL2,实现了快速准确地对西瓜噬酸菌两个亚群的区分,并对145 个不同地区、不同寄主的菌株进行PCR 检测,实现了对特异性引物PL1/PL2 准确性的验证。 本研究借鉴该研究成果,采用特异性引物PL1/PL2 区分获得菌株的亚群类型,研究表明菌株JZ17 和对照菌株AAC00-1(亚群II)均可扩增出目的片段, 而菌株JZX2,JZT8 和对照菌株pslbtw8 (亚群I) 则不能扩增出目的条带, 因此将分离自西瓜的菌株JZ17 鉴定为西瓜噬酸菌亚群II 型,将分离自甜瓜的菌株JZX2 和JZT8 鉴定为亚群I 型。
细菌16S rDNA 的分子鉴定方法已广泛应用于细菌性果斑病的检测及鉴定[15-19]。 为了对3 个菌株进行差异分析,比较3 个菌株的亲缘关系,采用16S rDNA 通用引物27F/1492R 对3 个菌株16S rDNA 序列进行扩增,将3 个菌株的16S rDNA 序列用BLAST 在GenBank 中进行同源性比对,菌株JZ17,JZX2 和JZT8 与西瓜噬酸菌各菌株16S rDNA 的相似性均达99%以上。 基于Neighbor-Joining 法构建的系统发育进化树表明菌株JZ17 与JXZS6 处于同一分支,菌株 JZX2,JZT8 与 XJ-6,pslb-25 亲缘关系较近。

