一株产酯酶窖泥细菌的筛选、鉴定及酶学性质研究
韩 丽,李 磊,曾 毅,杨源源,储镇江,何培新,2
(1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450002;2.郑州轻工业大学 食品生产与安全协同创新中心,河南 郑州 450002)
酯酶(esterase)是指能够催化水解羧酸酯的所有酶的总称,是目前较常见的生物催化剂之一[1],其广泛存在于动植物和微生物中,尤其在微生物中种类最多[2-3]。微生物酯酶在细菌中分布最多,其广泛存在于包括金黄葡萄球菌(Staphylococcus aureus)、链球菌(Streptococcus)、芽孢杆菌(Bacillus)和结核杆菌(Mycobacterium tuberculosis)等多种细菌中。
酯酶作为重要的生物催化剂,其催化的反应具有较高的底物专一性、区域选择性和对应选择性[4],广泛应用于医药、食品、化工、环保等领域,尤其在白酒酿造业。随着工业的发展,人们对酯酶的要求越来越高,因此,选育性质特殊、催化活性高的酯酶成为近年来研究的热点[5-8]。目前,研究学者主要从土壤、海洋样品中筛选产酯酶细菌,为了获得催化性能优良、耐极寒或酷热的酯酶,研究学者多在高山、极地、深海或者火山口进行取样,筛选产酯酶细菌[9]。郑鸿飞等[10]从青岛前海和胶州湾地区分离出一株酶活力和稳定性较高的菌株EB-1,被鉴定为枯草芽孢杆菌(Bacillus subtilis)的亚种;王文文等[11]从自然发酵的黄皮果汁中分离出一株细菌C10,其产生的酯酶最适pH值为9.0、最适温度为60℃;盛小禹等[12]从温泉中分离得到一株的栖热菌(Thermurs sp.)FD3041,其产酯酶FD2TAP的最适温度为70℃,且在95℃处理60 min后仍然有75%的活性;ZAPPA S等[13]从火山中分离到一株异养古细菌Pyrococcusabyssi,其培养温度为100℃,从中分离得到的胞内碱性磷酸酯酶最适温度为70℃。
现有的报道中多从富含油脂的土壤中筛选能够产酯酶的真菌或细菌[14-16],而鲜有从窖泥中筛选产酯酶菌株的报道。本研究从白酒窖泥中筛选出一株高产酯酶的菌株,对其进行形态观察和分子生物学鉴定,并对其产生的酯酶进行纯化和酶学性质分析,以期对窖泥的改良与优化提供一定的参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
窖泥:采集于河南周口宋河酒厂。
1.1.2 试剂
酵母粉、胰蛋白胨、葡萄糖、琼脂粉(均为生化试剂):北京索莱宝科技有限公司;氯化钠、聚乙烯醇、三丁酸甘油酯、罗丹明B(均为分析纯)、细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNA聚合酶、2000Maker:上海生工生物工程有限公司;硫酸铵、硝酸铵、磷酸氢二钾、氯化钠、七水硫酸镁、七水硫酸亚铁(均为分析纯):天津市永达化学试剂有限公司;丁酸酯、己酸酯、辛酸酯、癸酸酯、十二烷酸酯、十四烷酸酯、十六烷酸酯(均为分析纯):上海麦克林生化科技有限公司。
1.1.3 培养基
三丁酸甘油酯乳化液:称取3 g聚乙烯醇于80 mL蒸馏水中,沸水浴加热、搅拌,直至全部溶解,冷却后用蒸馏水定容至100 mL。采用3.0%的聚乙烯醇溶液制备含100 g/L三丁酸甘油酯的乳液,超声波处理(功率40%,破碎5 s停3 s,总时间15 min),得到的乳化液为乳白色黏稠状液体。
LB液体培养基:胰蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L,pH 7.0。121℃高压灭菌20 min。固体培养基中加入琼脂粉20 g/L。
种子培养基:牛肉膏3 g/L、蛋白胨5 g/L、葡萄糖5 g/L、NaCl 5 g/L、pH 7.0。121℃高压灭菌20 min。
发酵培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L、pH 7.0。121℃高压灭菌20 min。
富集培养基:三丁酸甘油酯乳化液12 mL、酵母粉0.2 g/L、磷酸氢二钠3.5 g/L、磷酸氢二钾1.5 g/L、微量金属离子,pH 7.5。121℃高压灭菌20 min。
三丁酸甘油酯固体培养基:硫酸铵0.5 g/L、硝酸铵0.1 g/L、磷酸氢二钾1 g/L、氯化钠1 g/L、七水硫酸镁0.5 g/L、七水硫酸亚铁0.1 g/L、酵母粉3 g/L、蛋白胨3 g/L,三丁酸甘油酯乳化液12 mL、琼脂粉20 g,pH 7.0。121℃高压灭菌25 min。
筛选培养基:于三丁酸甘油酯固体培养基中加入2 mL 0.5%罗丹明B溶液,蒸馏水定容至1 L,于121℃高压灭菌25 min。
1.2 仪器与设备
DH-600A电热恒温培养箱:北京中兴伟业仪器有限公司;SW-CJ-2D双人超净工作台:苏州净化设备有限公司;DMEX30生物显微镜:宁波舜宇仪器有限公司;FORMA-86C超低温冰箱:郑州金友宁仪器有限公司;ZWY-100H摇床:上海智诚分析仪器制造有限公司;AE224分析天平:北京赛多利斯天平有限公司;TGL-16G离心机:上海安亭科学仪器厂;SC-15恒温水浴锅、SCIENTZ-10N真空冷冻干燥机:宁波新芝生物科技有限公司;DYCZ-24KF四板垂直电泳仪:北京六一生物科技有限公司;C1000聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐公司。
1.3 方法
1.3.1 产酯酶菌株的初筛
称取5 g窖泥样品于100 mL无菌生理盐水中,充分混匀后按1%(V/V)的接种量接种于富集培养基中,30℃、180 r/min培养2 d。将富集液进行梯度稀释(10-1~10-6),每个梯度涂布于两个三丁酸甘油酯平板,每块平板涂布200μL,30℃倒置培养2 d至长出单菌落。挑取产生透明圈的单菌落点样于筛选培养基平板上,30℃培养2 d,观察透明圈,以菌落直径和水解圈直径的比值作为初筛依据,筛选比值较大的菌落于LB固体培养基上分离纯化。将得到的产酯酶细菌接种于5 mL LB液体培养基中,30℃、180 r/min培养24 h后,保存于甘油中。
1.3.2 产酯酶细菌的复筛
将初筛得到的菌株接种于种子培养基中,30℃、180 r/min培养24 h。按1%的接种量将种子液接种于发酵培养基中,30℃、180 r/min培养48 h。取发酵液1 mL,8 000 r/min、4℃条件下离心10 min,即为粗酶液,通过测定酯酶酶活对菌株进行复筛。
酯酶酶活的测定[17]:采用棕榈酸对硝基苯酯(p-nitrophenylpalmitate,pPNP)法测定酯酶活力。反应体系中加入粗酶液15μL、pPNP(10 mmol/L)35μL、Tris-HCl(0.1 mol/L,pH=8.0)200μL,40℃水浴10 min,在波长410 nm处测定吸光度值。酯酶活力单位定义:在pH=8.0、40℃条件下,每分钟水解产生1μmol的pNP所需的酶量定义为一个酶活力单位(U)。
1.3.3 产酯酶细菌的鉴定
形态观察:将目标菌株划线于LB固体平板,30℃倒置培养24 h,观察菌株的菌落形态;参考国标GB 4789.28—2013《食品微生物学检验培养基和试剂的质量要求》对目标菌株进行革兰氏染色并镜检。
分子生物学鉴定:采用细菌基因组DNA提取试剂盒提取目的菌株的基因组DNA,以其作为模板,使用引物27F(5′-AGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系:DNA模板2 μL,10×PCR buffer(MgCl2)4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)mix 3.2μL,上、下游引物(10μmol/L)各0.8μL,pfu DNA聚合酶(2.5 U/mL)0.8μL,双蒸水(ddH2O)补足至40μL。PCR扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,回收PCR扩增产物并送至苏州金唯智生物科技有限公司进行测序。测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行Blast同源性比对。选取同源性较高的模式菌株的16S rDNA序列,采用Mega 5.0软件中的邻接(neighbor joining,NJ)法构建系统发育。
1.3.4 酯酶的纯化
将目标细菌划线于LB固体培养基,30℃培养24 h。挑取单菌落接种于50 mL种子培养基中,30℃、180 r/min条件下培养48 h。按照1%的接种量将种子液接种于1 L发酵培养基中,30℃、180 r/min培养48 h,8 000 r/min、4℃条件下离心20 min,取上清液备用。
由分级沉淀得到纯化酯酶的最佳硫酸铵饱和度为60%。向上清液中缓慢加入硫酸铵沉淀,使其饱和浓度达到60%,4℃过夜,5 000 r/min、4℃离心10 min,即可得到蛋白沉淀。将得到的蛋白沉淀溶于Tris-HCl(0.1 mol/L,pH=8.0)中,移入透析袋(截留分子质量:8 000~14 000 Da)中,透析液为Tris-HCl(0.1 mol/L,pH=8.0)。每隔4 h换一次透析液,直至硫酸铵沉淀完全去除。取一定量的透析液,加入高浓度的硫酸钡溶液,如无白色沉淀生成表明硫酸铵已透析完全。透析液5 000 r/min、4℃离心10 min,去除未溶沉淀,然后用液氮速冻,冷冻干燥机过夜[18]。将冻干的酶粉溶解于Tris-HCl(0.1 mol/L,pH=8.0)中,即可得到粗纯化的酶液。酶液经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测。
1.3.5 酯酶酶学性质研究
最适温度及温度稳定性:将纯化的酶液分别在不同温度(20℃、30℃、40℃、50℃、60℃、70℃、80℃)条件下孵育10 min,测定酶活,确定酯酶的最适温度。在pH=8.0的条件下,纯化的酶液在不同温度(20℃、30℃、40℃、50℃、60℃、70℃、80℃)条件下孵育30 min,测定残余的酶活力来分析酯酶的温度稳定性。
最适pH及pH稳定性:将反应体系的pH调整至5.0~10.0,测定酯酶在不同pH值(5.0、6.0、7.0、8.0、9.0、10.0)条件下的酶活,确定酯酶的最适pH。酶液在不同pH(5.0、6.0、7.0、8.0、9.0、10.0)的缓冲溶液中40℃孵育30 min,测定残余的酶活力来分析酯酶的pH稳定性。
底物链长的选择性:反应体系中添加不同碳链长的对硝基苯酚脂肪酸酯乙醇溶液(10 mmol/L),包括对丁酸酯、己酸酯、辛酸酯、癸酸酯、十二烷酸酯、十四烷酸酯、十六烷酸酯。在相同的体系下测定酯酶对不同底物的水解酶活。
2 结果与分析
2.1 产酯酶菌株的筛选结果
经过初筛与复筛从宋河酒厂窖泥中共筛选出20株产酯酶的细菌,将其编号为SH-1~SH-20。20株细菌在三丁酸甘油酯平板上形成的透明圈直径如表1所示,酯酶酶活如表2所示。
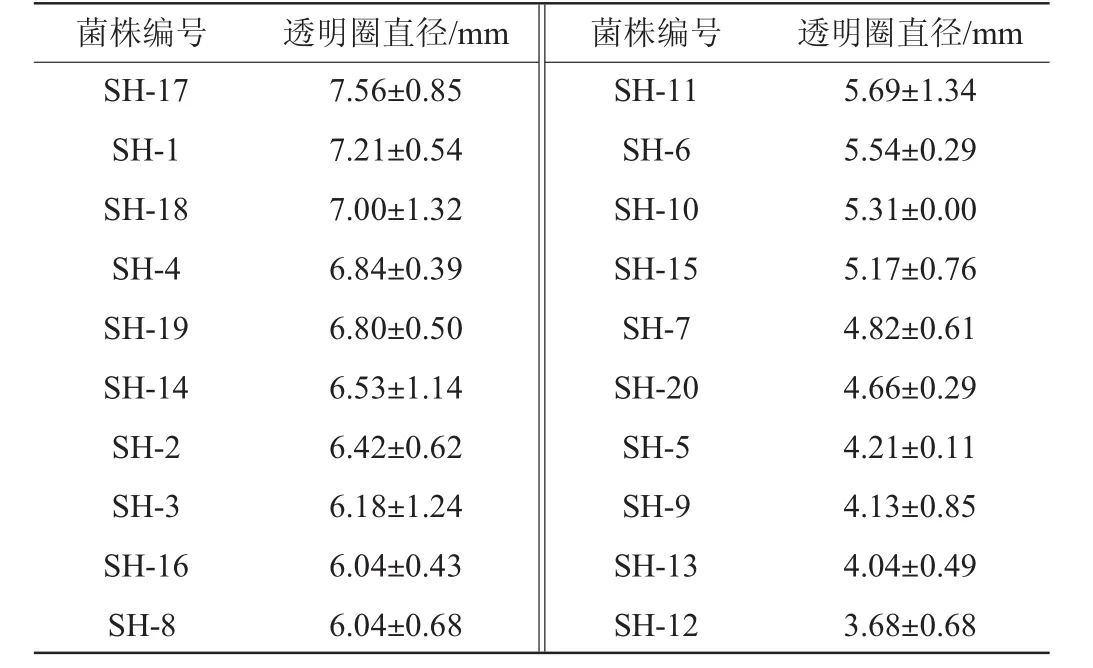
表1 20株产酯酶细菌在三丁酸甘油酯平板的透明圈直径Table 1 Transparent circle diameter of 20 esterase-producing bacteria on tributyrin plates
由表1可知,从窖泥中分离出的20株菌株中,14株菌株在三丁酸甘油酯平板上产生的透明圈直径≥5 mm,占窖泥样品中分离菌株总数的70%;3株菌株(SH-17、SH-1和SH-18)的透明圈直径达>7 mm,其中菌株SH-17的透明圈直径最大,为7.56 mm。
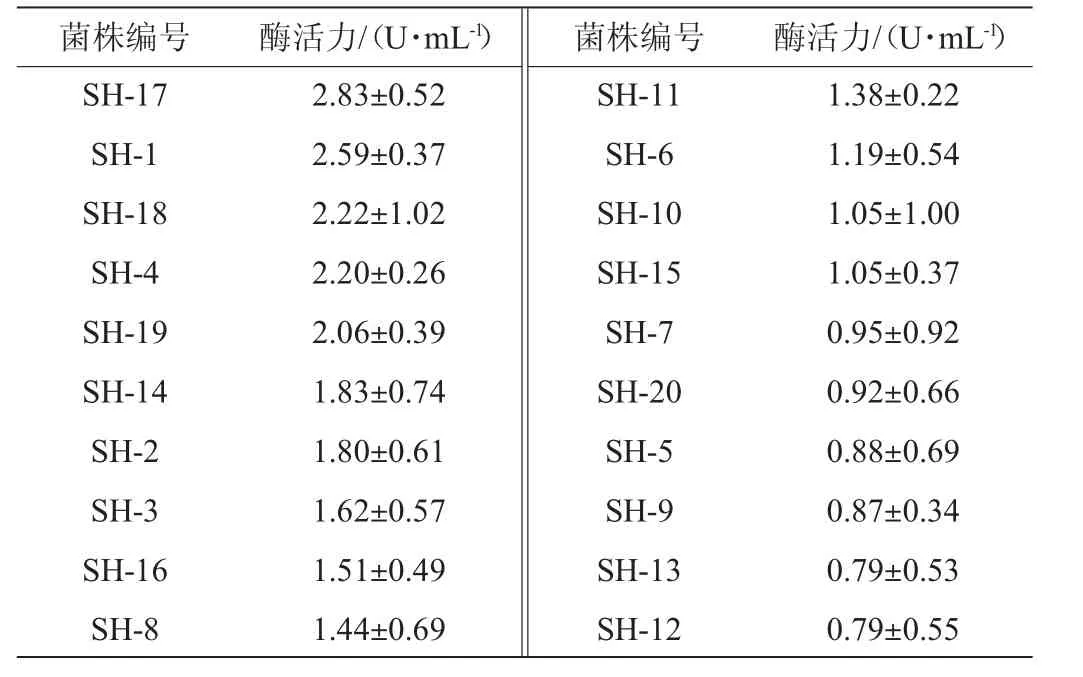
表2 20株产酯酶细菌的酯酶活力测定结果Table 2 Determination results of esterase activity of 20 esterase-producing bacteria
由表2可知,pPNP法测定酶活力复筛结果与三丁酸甘油酯平板法初筛结果一致。20株菌株中4株菌株的酶活力>2 U/mL,占筛选菌株的25%,其中菌株SH-17的酯酶活力最高,为2.83 U/mg。因次,选取菌株SH-17进行鉴定。
2.2 菌株SH-17的鉴定结果
菌株SH-17在LB固体平板上的菌落形态、革兰氏染色结果如图1所示。由图1可知,菌株SH-17的菌落呈淡黄色、光滑、圆润、圆形,为革兰氏阴性菌。
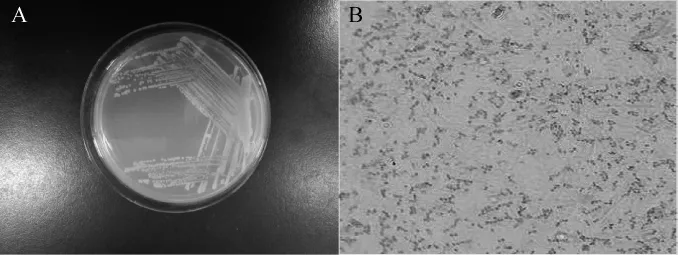
图1 菌株SH-17的菌落形态(A)和革兰氏染色结果(B)Fig.1 Colony morphology(A)and gram staining result(B)of strain SH-17
菌株SH-17的16S rDNA PCR扩增产物经1%琼脂糖凝胶电泳检测,结果如图2所示。由图2可知,菌株SH-17的16S rDNA序列碱基长度在1 450 bp左右,与预期结果相符,进行测序。将菌株SH-17的16S rDNA测序结果进行Blast比对,采用Mega5.0软件的NJ法构建系统发育树,如图3所示。
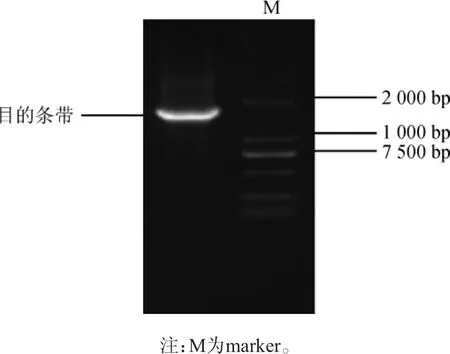
图2 菌株SH-17的16S rDNA PCR扩增产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of 16S rDNA PCR amplification product of strain SH-17

图3 基于16S rDNA序列菌株SH-17的系统发育树Fig.3 Phylogenetic tree of strain SH-17 based on 16S rDNA sequences
由图3可知,菌株SH-17与约氏不动杆菌(Acinetobacter johnsonii)有最高相似度,同源性达到98.57%。结合形态学特征及革兰氏染色结果,鉴定菌株SH-17为约氏不动杆菌(Acinetobacter johnsonii)。
2.3 酯酶的纯化结果
采用饱和度60%的硫酸铵对酯酶进行纯化后,蛋白回收率为(42.19±0.36)%,酶活力回收率为(78.29±0.59)%,纯化倍数为(1.68±0.11)倍。将经过硫酸铵沉淀和冷冻干燥后的酶粉溶于Tris-HCl(0.1 mol/L,pH=8.0)中,进行SDS-PAGE分析,结果如图4所示。由图4可知,纯化的蛋白条带单一且较清晰,其分子质量约为42 kDa。

图4 纯化蛋白聚丙烯酰胺凝胶电泳结果Fig.4 Polyacrylamide gel electrophoresis results of purified protein
2.4 酯酶酶学性质的研究
2.4.1 酯酶的最适温度及温度稳定性
在20~80℃的温度范围内,酯酶活力随温度的变化情况如图5所示。由图5可知,菌株SH-17所产酯酶在20~80℃的温度范围内均有活性,且随着温度的升高酶活性呈先升高后降低的趋势。当温度为40℃时,酶活力最高,因此,该酯酶的最适反应温度为40℃。
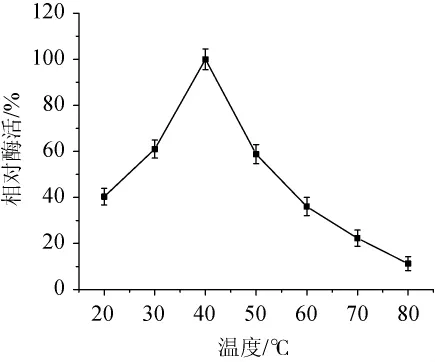
图5 温度对酯酶酶活的影响Fig.5 Effect of temperature on esterase activity
酯酶经不同温度(20~80℃)热处理30 min后,酯酶活力变化结果如6所示。由图6可知,酯酶经20~40℃处理30 min仍有90%以上的酶活力,而温度高于40℃之后处理30 min后,酶活不断降低,当温度高于60℃之后,相对酶活仅为10%,此时的酯酶已丧失大部分活性,说明该酯酶耐高温性能较差。

图6 酯酶的温度稳定性测定结果Fig.6 Determination results of temperature stability of esterase
2.4.2 酯酶的最适pH值及pH稳定性
40℃条件下菌株SH-17所产酯酶在pH值为5~10条件下酶活力变化如图7所示。由图7可知,菌株SH-17所产酯酶在pH值为5和6时基本无催化活性,当pH>6之后,酶的催化活性随pH值增加而升高,当pH=8时,达到最高催化活性,随后酯酶的催化活性不断降低,但在pH=10时该酶仍有20%的催化活性,说明该酶是一种弱碱性酯酶,其最适反应pH值为8。
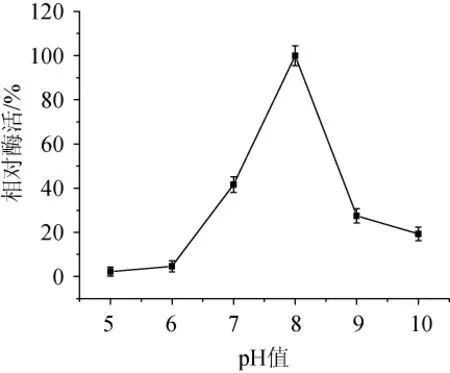
图7 pH值对酯酶酶活的影响Fig.7 Effect of pH on esterase activity
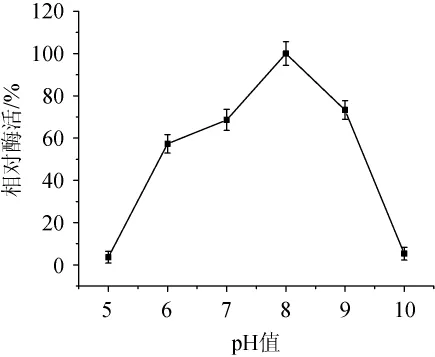
图8 酯酶的pH值稳定性测定结果Fig.8 Determination results of pH value stability of esterase
酯酶在40℃条件下经不同pH(5~10)处理30 min后,酯酶活力变化结果如8所示。由图8可知,酯酶经过不同pH处理30 min,在pH7.0~9.0的范围内,其活力保持在60%以上;而在pH<7.0或pH>9.0的条件下,其酶活稳定性变低。结果表明,该酯酶在中性偏碱的环境中相对稳定。
2.4.3 底物碳链长的选择性
以C4~C16相应的酯为底物测定菌株SH-17所产酯酶在40℃、pH=8.0条件下对不同底物的水解酶活,结果如图9所示。由图9可知,该酯酶对6个碳的底物催化活性最高,对于碳链长>12的底物催化活性较低。结果表明,该酯酶对链长较短的底物催化活性较高,最适反应底物碳链长为6。推测该酯酶作用于酯化反应时可能对乙酸、己酸等短链酸有较高的催化活性,在白酒发酵过程中可以增加白酒中乙酸乙酯、己酸乙酯等香味成分[19-20],对丰富白酒风味具有一定意义且对窖泥的评估和改良也有一定的参考价值。
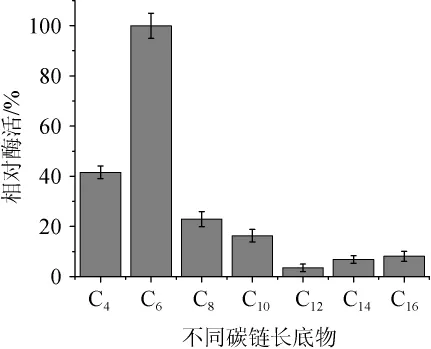
图9 酯酶对不同链长底物的水解活力Fig.9 Hydrolytic activity of esterase on substrates with different chain length
3 结论
本研究从白酒窖泥中共筛选出20株产酯酶菌株,其中菌株SH-17的酯酶活力最高,为2.83 U/mL。经形态观察和分子生物学技术鉴定其为约氏不动杆菌(Acinetobacter johnsonii)。经饱和度60%的硫酸铵盐析得到该酯酶分子质量约为42 kDa,最适反应温度为40℃、最适pH值为8.0,高温耐受性差,在中性偏碱的环境中相对稳定,且对碳链长较短的底物催化活性较高,最适反应底物碳链长为6。

