基于纳米银负载氧化石墨烯的新型聚乙烯复合材料
张峰, 张凯立, 周明明, 陈超, 蔡志威, 魏国辉, 姜兴茂,5, 张诚, 劳伦·鲁尔曼, 吕耀康
基于纳米银负载氧化石墨烯的新型聚乙烯复合材料
张峰1,2, 张凯立1, 周明明2, 陈超3, 蔡志威3, 魏国辉4, 姜兴茂4,5, 张诚1, 劳伦·鲁尔曼6, 吕耀康1
(1. 浙江工业大学 化学工程学院, 杭州 310014; 2. 浙江大学医学院附属儿童医院, 杭州 310052; 3. 浙江省食品药品检验研究院, 杭州 310052; 4. 常州英中纳米科技有限公司, 常州 213000; 5. 武汉工程大学 化工与制药学院, 武汉 430205; 6. 斯特拉斯堡大学 化学研究所, 斯特拉斯堡 67081)
通过超声波辅助液相法将纳米银(AgNPs)与氧化石墨烯(GO)结合制得了一种新的负载纳米银的氧化石墨烯材料AgNPs@GO。分析表明在该材料中AgNPs主要被锚接在GO片层的含氧基团和缺陷上, 部分Ag单质被氧化为Ag+离子并有部分GO被还原。AgNPs@GO能有效抑制铜绿假单胞菌生长, 其抑菌能力显著强于AgNPs和GO。将AgNPs@GO作为添加剂引入聚乙烯(PE)基体, 进一步制备了新型的AgNPs@GO掺杂PE复合材料0.48wt%-AgNPs@GO/PE, 相比PE和AgNPs掺杂PE复合材料, 0.48wt%-AgNPs@GO/PE具有更好的抑菌能力和更强的阻隔水蒸气性能, 并且在水和乙醇溶液中都具有较好的耐溶出性能。
纳米银; 氧化石墨烯; 铜绿假单胞菌; 聚乙烯; 抑菌; 阻隔水蒸气性能
随着经济高速发展以及人民生活质量的提高, 对口服药剂以及方便食品的需求量不断增加, 与之紧密相联的塑料包装材料也在向绿色、抗菌、高阻隔等方向发展[1-2]。聚乙烯(Polyethylene, PE)是目前最常用的包装材料之一, 但普通的PE材料对氧气、水蒸气的阻隔性能不佳, 易被细菌污染, 不利于食品和药品的保存[3]。
纳米银(Silver nanoparticles, AgNPs)是一种抗菌谱广、抗菌效能久、热稳定性好、生物安全性高的纳米抗菌材料[4-5]。AgNPs可以作为功能化添加剂对PE等包装材料进行改性, 制备抗菌包装材料, Sanchez- Valdes[6]将AgNPs沉积在线性低密度聚乙烯/环烯烃共聚物(LLDPE/COC)共混物挤出膜表面, 获得了对尼日尔曲霉属真菌有良好抑菌活性的包装膜。李振兴等[7]制备了AgNPs质量分数为1%和2%的抗菌活性PE薄膜, 可延长虾仁在冷藏过程中的保质期。但是AgNPs的表面作用能很强, 纳米粒子之间极易团聚, 导致制备的PE复合材料容易产生缺陷, 影响其阻隔水蒸气性能等物理化学性能。因此, 研究和开发AgNPs均匀分散的PE复合材料, 在不降低PE材料物理化学性能的前提下赋予PE复合材料高效的抗菌能力, 具有重要的意义。
氧化石墨烯(Graphene Oxide, GO)具有优异的杀菌活性及温和的细胞毒性, 也可以作为高效抗菌剂使用[8]; GO独特的平面结构使含GO的复合材料具有一定的阻隔小分子透过的能力, 而GO边缘丰富的亲水官能团, 使其能均匀地分散在水等极性溶液中, 并易于被其它基团修饰或负载[9-11], 最近的研究表明, 将金属纳米粒子与GO结合, 可能产生协同作用, 获得具备优异性能的新材料[12-14]。本研究通过超声波辅助液相复合法成功获得了纳米银负载氧化石墨烯材料AgNPs@GO, 实验发现该材料抑制铜绿假单胞菌的能力显著强于AgNPs和GO; 进一步将AgNPs@GO作为添加剂引入PE基体, 制备新型的AgNPs@GO掺杂聚乙烯复合薄片材料, 并研究了该复合材料的抗菌性能、耐溶出性能和阻隔水蒸气性能。
1 实验方法
1.1 AgNPs@GO 的制备
GO采用改良的Hummers法[15]制备(补充材料1), AgNPs的制备参照发明专利“制备单分散超细颗粒的方法”公开的制备方法[16], 由常州英中纳米科技有限公司提供(产品号YZN-Y400, AgNPs含量为0.4wt%), 本研究所用的其它试剂均为分析纯(补充材料2)。如图1所示, 将128 mg的GO粉末和100 mL AgNPs溶胶加入100 mL的乙醇中, 使用频率为 40 KHz的超声波发生器在40 ℃超声波振荡2 h, 得到澄清的AgNPs@GO溶胶, 在60 ℃真空环境干燥12 h, 得到AgNPs@GO固体粉末, 其中AgNPs : GO的质量比为3 : 1。
1.2 AgNPs@GO掺杂聚乙烯复合材料的制备
将AgNPs@GO复合材料与PE母粒按质量比AgNPs@GO : PE = 0.48 : 99.52进行搅拌共混, 在60 ℃真空环境干燥, 并置于双棍筒开炼机中, 在160 ℃下进行混炼, 再使用平板硫化仪在160 ℃的温度下制备得到厚度为1.0 mm的AgNPs@GO掺杂聚乙烯复合材料薄片, 该新材料被命名为0.48wt%-AgNPs@GO/PE。
将AgNPs和PE母粒分别按照质量比为AgNPs : PE = 0.48 : 99.52和2.88 : 97.12进行搅拌共混, 在60 ℃真空环境干燥, 采用上述相同制备方法得到不同AgNPs含量的复合材料薄片, 依次命名为0.48wt%-AgNPs/PE, 2.88wt%-AgNPs/PE, 并将它们与0.48wt%-AgNPs@GO/PE的性能进行比较。

图1 AgNPs@GO的制备流程图
1.3 结构和形貌的表征
透射电子显微镜(TEM)数据采集自FEI公司Tecnai G2 F30 S-Twin透射电镜; X射线光电子能谱(XPS)和俄歇电子能谱(AES)采用岛津AXIS Kratos Ultra DLD多功能光电子能谱仪测试(补充材料4); 红外光谱(IR)分析采用赛默飞公司的Nicolet 6700 spectrometer型傅里叶转换红外光谱仪补充材料5); 紫外-可见光谱(UV-Vis)分析采用岛津紫外-可见光光度计UV-2700; X射线粉末衍射(pXRD)分析采用Bruker D8衍射仪(补充材料6)。
1.4 抗菌性能研究
选用铜绿假单胞菌标准菌株(ATCC27853, 购自美国菌种收藏中心), 用纸片扩散法和直接接触实验测试AgNPs@GO、GO和AgNPs三种材料的抑菌性能; 用直接接触实验测试0.48wt%-AgNPs/PE、2.88wt%-AgNPs/PE和0.48wt%-AgNPs@GO/PE三种材料的抑菌性能。将–80 ℃冻存的ATCC27853菌株复苏, 在35 ℃培养24 h后接种于哥伦比亚血琼脂培养基上。
纸片扩散法实验步骤为: 挑取ATCC27853菌落, 用无菌生理盐水调制0.5 MCF左右的菌液5 mL。用无菌棉签蘸取上述0.5 MCF左右的菌液均匀涂布于MH培养基上, 之后将相同质量的AgNPs@GO、GO和AgNPs三种溶胶涂布在直径为12.0 mm的纸片上, 将纸片分别贴于培养基上, 然后将培养基放置于35 ℃培养箱中培养24 h后取出。观察抑菌圈大小, 抑菌圈大小为抑制细菌生长的抑菌圈直径用游标卡尺测量并记录。每个抑菌圈测量3次, 精确到0.01 mm, 取平均值。
AgNPs@GO、GO和AgNPs三种材料直接接触实验的步骤为 : 挑取ATCC27853菌落, 用无菌LB肉汤调制0.5 MCF左右的菌液4 mL。取4个无菌试管, 1个试管内加入1 mL菌液作为空白对照, 用上述菌液分别将AgNPs@GO、GO和AgNPs三种材料配成终浓度为0.024 mg/mL的溶液各1 mL, 振荡试管使材料分布均匀, 然后将试管放入35 ℃恒温箱培养。用生物梅里埃的比浊仪分别在0、1、3、6和24 h测量各试管中ATCC27853菌液的浊度, 每个试管测3次, 取其平均值; 分别在0、1、3、6和24 h时取菌液接种于营养琼脂平板上进行细菌培养及计数。
0.48wt%-AgNPs/PE、2.88wt%-AgNPs/PE和0.48wt%-AgNPs@GO/PE三种材料的直接接触实验的步骤为: 挑取ATCC27853菌落, 用无菌生理盐水调制0.5 MCF左右的菌液5 mL。取4个无菌试管, 每个试管内加入1 mL上述配制的0.5 MCF左右的ATCC27853菌液。分别将0.48wt%-AgNPs/PE、2.88wt%-AgNPs/PE和0.48wt%-AgNPs@GO/PE三种材料各50 mg置于3个试管内, 振荡试管使材料分布均匀, 另外1管不加任何材料作为阴性对照。然后将试管放入35 ℃恒温箱培养, 用生物梅里埃的比浊仪分别在1、3、6、24、48和72 h测量各试管中ATCC27853菌液的浊度, 每个试管测3次, 取其平均值。
1.5 耐溶出性能和阻隔水蒸气性能研究
溶出物实验参考《中华人民共和国药典》中对塑料包装样品的溶出物实验的测试方法(补充材料7和8); 水蒸气透过率数据采集自MOCON公司 MCON Pematran-W3/33水蒸气透过率测试仪。
2 结果与讨论
2.1 AgNPs@GO的结构与形貌
如图2所示, AgNPs@GO粉末呈棕黑色, 能够被超声分散在水中形成淡棕色透明的AgNPs@GO溶胶。如图S1所示, AgNPs溶胶的紫外吸收光谱在420 nm附近显示出Ag单质的特征吸收峰, 而AgNPs@GO溶胶的紫外吸收光谱(图S1)与GO溶胶相似, 在300 nm附近均出现了较强的吸收带, 这是由GO碳骨架双键所连−C=O上未成键的孤对电子的n→π*跃迁产生的R带[17]。AgNPs@GO溶胶在400~600 nm处的光吸收强度较相同浓度的GO溶胶强, 这一现象可以归因于AgNPs与GO的结合。
图3(a, b)是AgNPs@GO的TEM照片。由图可见, AgNPs与GO结合后主要负载在GO片层上, 并且基本没有团聚。从AgNPs@GO的高分辨TEM(HRTEM)照片中可以观察到AgNPs晶粒的晶格条纹间距为0.236 nm, 基本对应于立方Ag晶体的(111)晶面间距(图3(c))。如图3(d)所示, 采用粒度分析软件Nano Measurer1.2 对AgNPs的粒径分布进行统计分析, 分析结果表明AgNPs的粒径分布主要集中在20~30 nm之间。

图2 AgNPs@GO粉末(a)和其溶胶(b)的照片
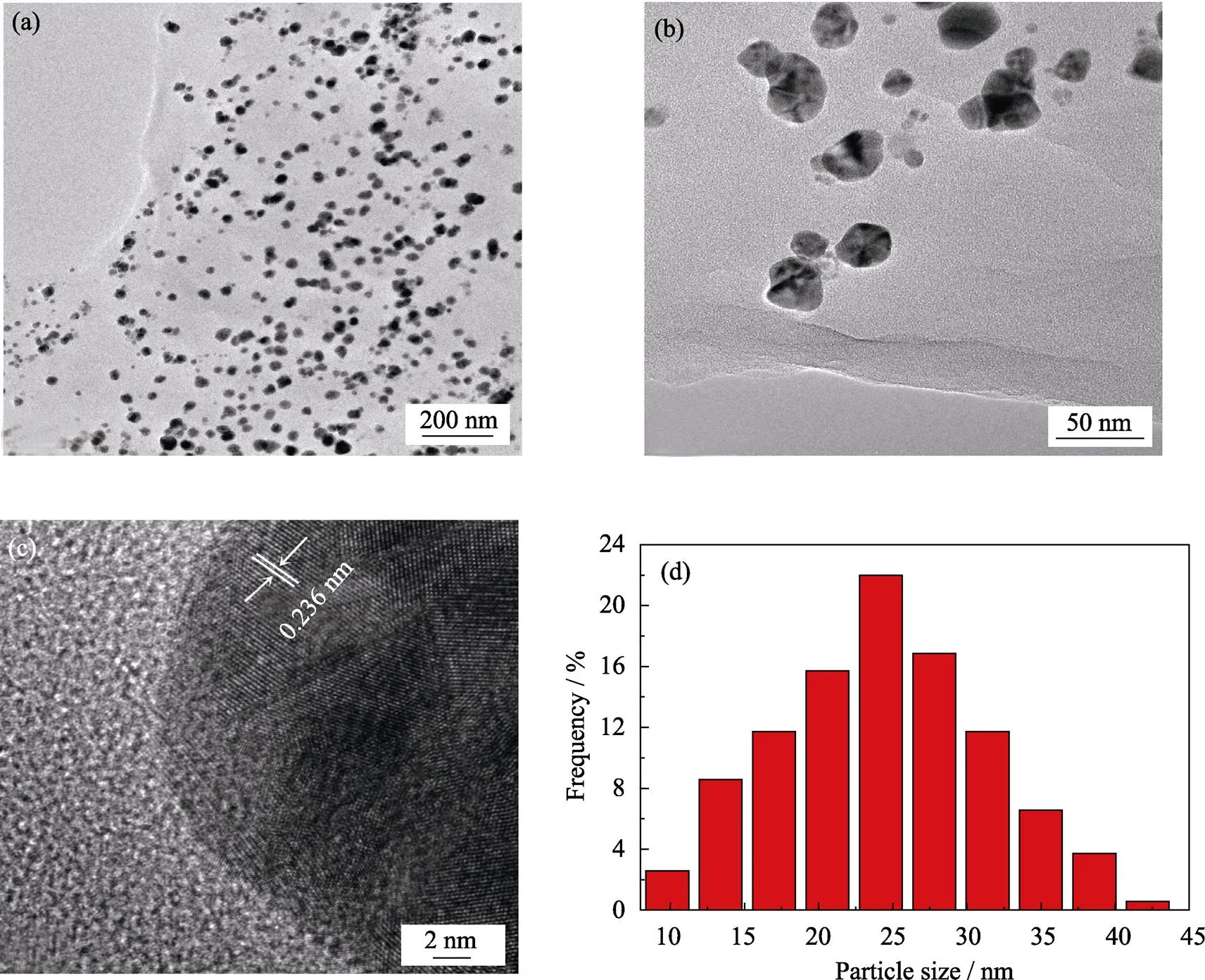
图3 AgNPs@GO的TEM(a,b)和HRTEM(c)照片以及AgNPs@GO上负载的AgNPs粒径分布的统计结果(d)
GO和AgNPs@GO的XRD图谱如图4(a)所示, GO在2约为10.3°附近有一个对应于其(001)晶面的强衍射峰, 而AgNPs@GO位于10.3°附近的衍射峰已基本消失, 同时其在23°附近对应于石墨烯(002)晶面的漫峰显著增强, 说明在AgNPs@GO中, GO已经被部分还原。此外, AgNPs@GO在2为38.1°、44.3°、64.4°和77.5°处的衍射峰分别对应于面心立方结构的金属单质Ag(JCPDS No.04-0783)的(111)、(200)、(220)、(311)晶面, 通过Debye-Scherrer公式计算(补充材料S4)推测AgNPs@GO中纳米银晶粒的平均粒径约为24 nm, 这与TEM照片分析的结果相一致。
图4(b)为在动能280~294 eV 区间, 对GO样品窄区域高分辨扫描采集C1s的XPS图谱和应用拟合软件XPSpeak 4.1对C1s谱峰进行分峰拟合的曲线。从拟合的结果判断, 在GO中碳元素的主要存在形式有5种, 分别为: C(sp2)、C(sp3)、C−O、C=O和O−C=O, 其对应的结合能分别为284、284.8、286.4、287.6和288.9 eV。而对AgNPs@GO样品的C1s峰的精细扫描及分峰拟合(图4(c))表明, C−O和C=O的结合能强度相对GO明显变小, 这一方面是由于AgNPs以GO的含氧官能团为结合点使其负载; 另一方面原因是AgNPs在与GO结合时, 部分GO被还原。图4(d)为在动能526~538 eV区间, 对AgNPs@GO样品的O1s峰的精细扫描及分峰拟合的曲线。从拟合的结果判断, AgNPs@GO中有大量含氧官能团存在, 氧的存在形式有4种: 与AgNPs连接的氧原子(530.2 eV)、羟基氧(531.4 eV)、羧基氧(532.4 eV)以及样品中结合水中的氧原子(533.8 eV)。AgNPs@GO样品的Ag 3d的XPS窄区扫描图谱(图4(e))在367.6和373.8 eV处分别出现了Ag 3d5/2和Ag 3d3/2的特征峰, 而从AgNPs@GO的AES能谱(图4(f))得出的最高峰的动能为351.8 eV。这一结果说明在AgNPs@GO中还存在+1价的Ag+离子[18]。
红外光谱分析也证实了上述结果(图S3)。
目前已报道的纳米银/石墨烯复合材料的制备方法大多是采用可溶性银盐为前驱体与石墨烯或氧化石墨烯复合, 并采用还原性的化学试剂还原Ag+离子制备复合材料[19-20]。本研究通过微波辅助气溶胶技术获得单分散AgNPs颗粒和溶胶, 并借助超声波辐射压强产生的空化效应和扰动效应增大GO和AgNPs溶胶粒子在溶剂中的运动频率和速度, 使GO和AgNPs充分接触和结合, 制备AgNPs@GO溶胶。与现有方法相比, 本方法更加简便和绿色。

图4 GO和AgNPs@GO的XRD图谱(a); GO的XPS C1s图谱(b); AgNPS@GO的C1s(c)、O1s(d)、Ag3d(e)的XPS图谱和Ag(f)的AES 能谱
2.2 AgNPs@GO的抗菌性能
如图5所示, AgNPs@GO纸片的抑菌圈直径(26.85±0.35) mm明显大于GO纸片(23.10±0.10) mm 和AgNPs纸片的(22.18±0.41) mm抑菌圈。从图5还可进一步发现AgNPs@GO抑菌圈周围梯度变化较AgNPs和GO都更为明显, AgNPs@GO周 围(17.30±0.09) mm范围内铜绿假单胞菌完全 抑制。
AgNPs@GO、GO和AgNPs与铜绿假单胞菌的直接接触实验结果如图6所示。1、3、6和24 h 时取菌液接种于营养琼脂平板上进行细菌培养 (图6(a))及计数结果(图6(c))表明, AgNPs@GO接触组在这4个时间点琼脂平板上未见明显的铜绿假单胞菌落, 而AgNPs和GO接触组在3 h之后均出现菌落生长, 可见AgNPs@GO抑制铜绿假单胞菌生长能力明显强于GO和AgNPs; 这一结果与比浊仪在相同时间段测量各试管中菌液的浊度结果一致(图6(b))。
铜绿假单胞菌是医院内引起感染的常见致病菌群之一, 对临床多种抗生素产生一定的耐药性[21]。该细菌在口腔颌面部手术后可引起伤口化脓性感染, 甚至导致败血症, 危及患者的生命[22]。以上实验结果均表明AgNPs@GO能有效抑制铜绿假单胞菌的生长进而有可能切断传播途径, 并且其抑菌能力明显优于AgNPs和GO。
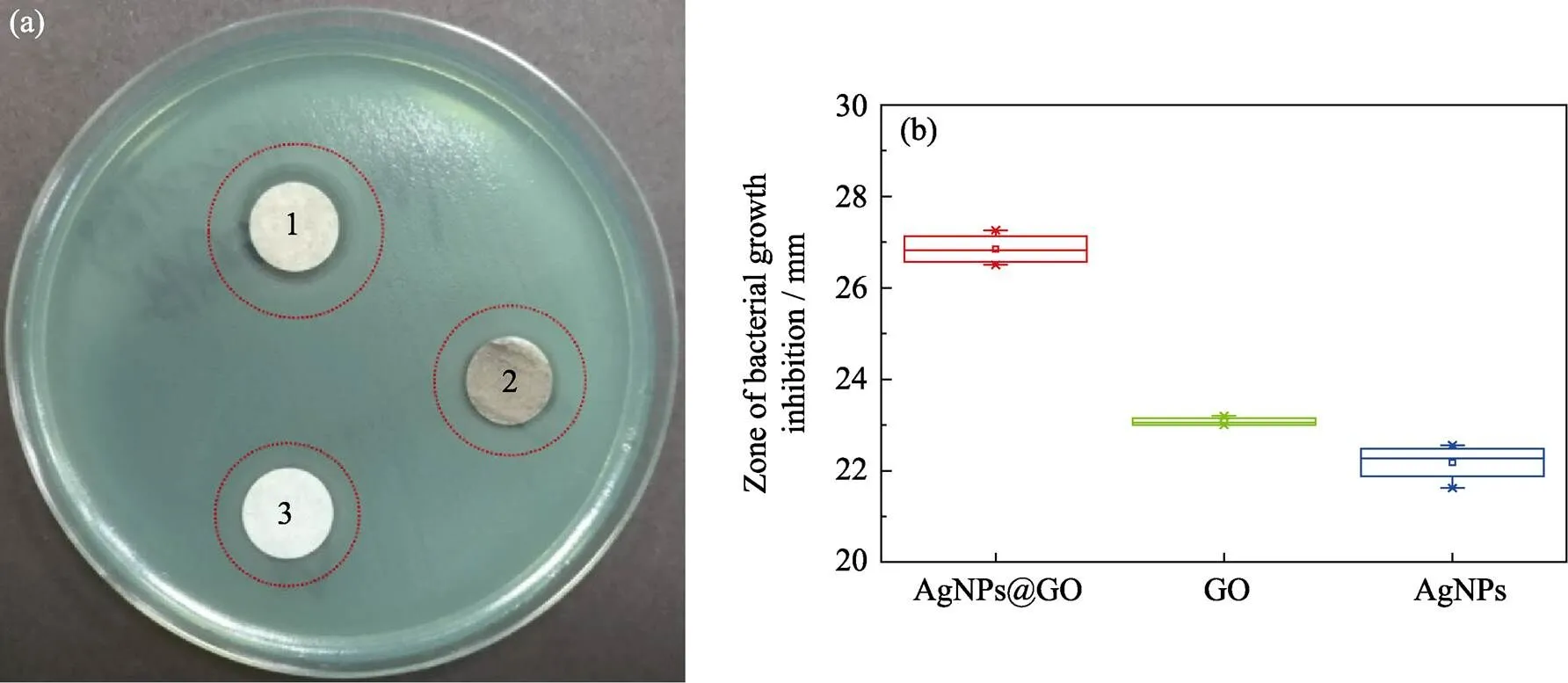
图5 AgNPs@GO、GO和AgNPs的铜绿假单胞菌的抑菌圈实验照片(a)((1)涂有AgNPs@GO的纸片, (2)涂有GO的纸片, (3)涂有AgNPs的纸片)和抑菌圈实验数据结果图(b)
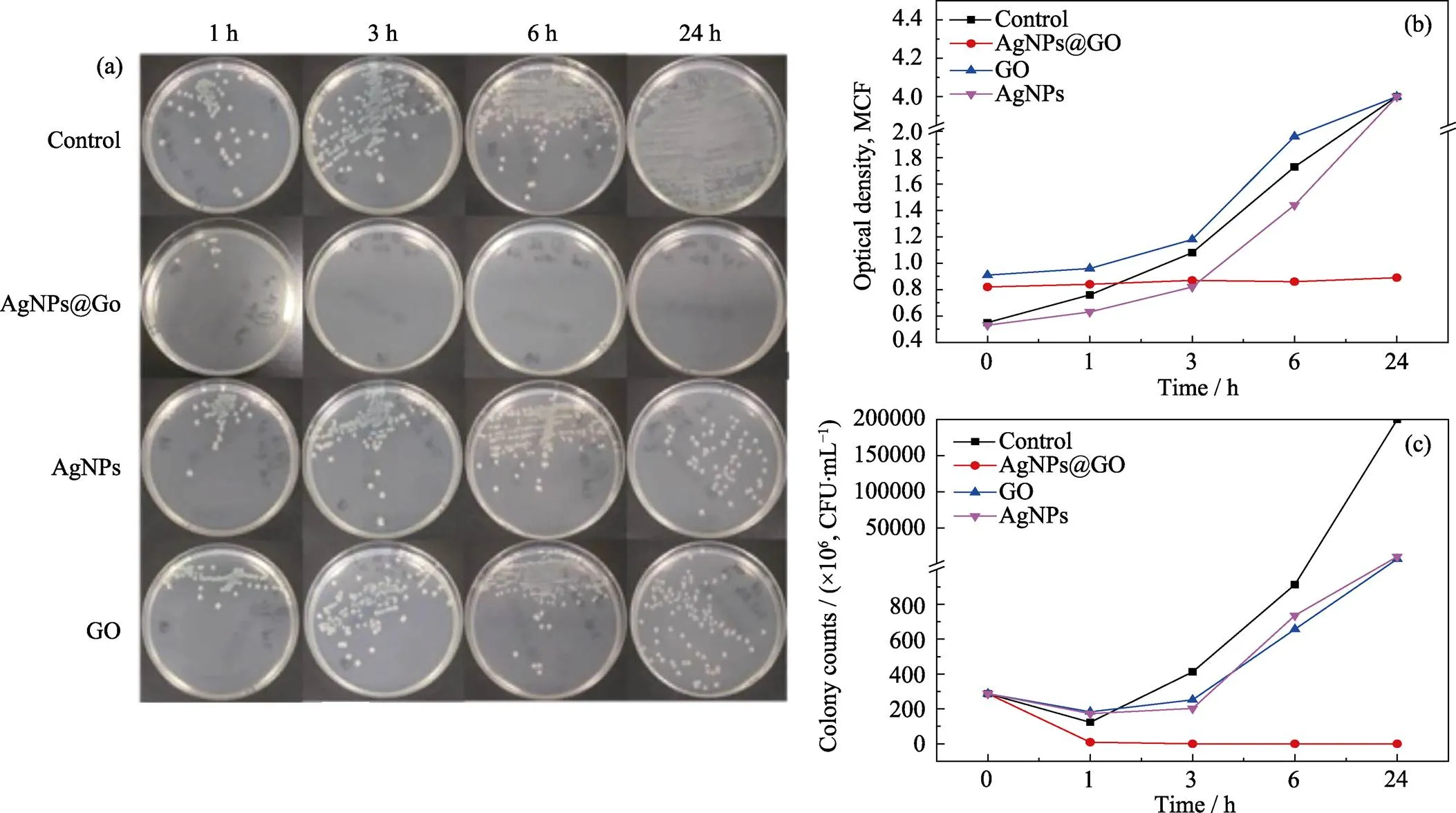
图6 不同时间取菌液接种于营养琼脂平板上进行的细菌培养照片(a)及其在不同时间的各试管中菌液的浊度(测量上限为4 MCF)(b) 和计数曲线(c)
2.3 0.48wt%-AgNPs@GO/PE的抗菌性能
如图7所示, 在1、3、6、48和72 h各个时间点抑菌能力强弱顺序为: 0.48wt%-AgNPs@GO/PE > 2.88wt%-AgNPs/PE > 0.48wt%-AgNPs/PE >空白对照组。其中掺杂低浓度(0.48wt%)的AgNPs@GO的材料0.48wt%-AgNPs@GO/PE显示了最强的抑菌能力, 掺杂高浓度(2.88wt%)AgNPs的材料2.88wt%- AgNPs/PE虽然比掺杂低浓度(0.48wt%)AgNPs的0.48wt%-AgNPs/PE材料的抗菌能力强, 但仍然弱于0.48wt%-AgNPs@GO/PE。
推测AgNPs@GO能把AgNPs[23-27]与GO[28]的抗菌能力叠加起来, 并且产生了协同效应, 使AgNPs@GO的抗菌能力大幅增强。另外, 由于GO表面大量的含氧基团能将AgNPs固定在片层结构上, GO对AgNPs起到了稳定和保护作用, 减少了AgNPs的溶出, 从而降低了纳米银的细胞毒性, 提高了AgNPs@GO以及0.48wt%-AgNPs@GO/PE的长效抗菌能力。
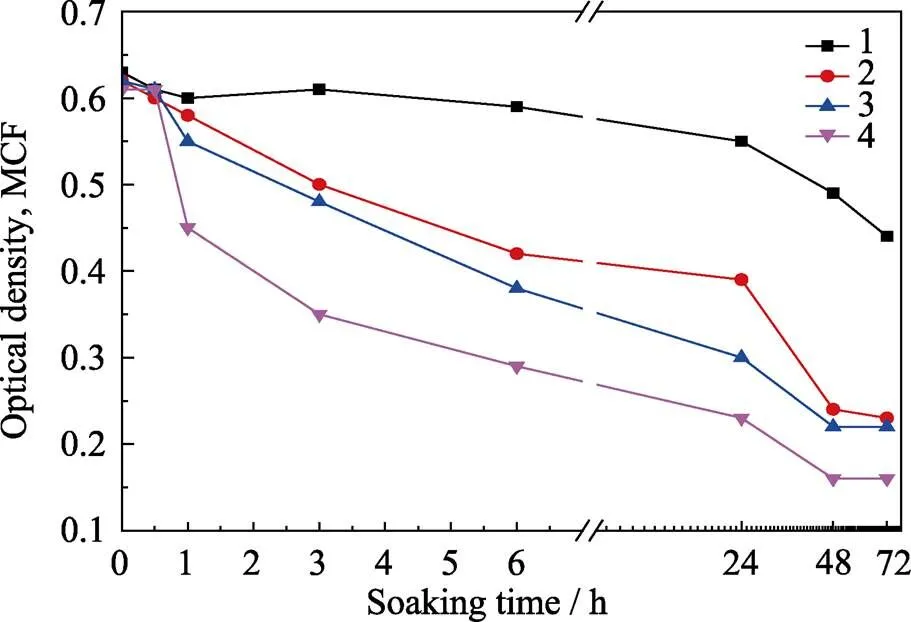
图7 抑制铜绿假单胞菌生长实验结果
Line 1: Blank control group; Line 2: 0.48wt%-AgNPs/PE; Line 3: 2.88wt%-AgNPs/PE; Line 4: 0.48wt%-AgNPs@GO/PE
2.4 0.48wt%-AgNPs@GO/PE的阻隔水蒸气性能
如图8所示, 在标准测试条件下0.48wt%- AgNPs/PE薄片(图S5)的水蒸气透过率为 0.07477 g/(m2∙d)高于PE薄片(图S4)的水蒸气透过率为0.03885 g/(m2∙d), 而2.88wt%-AgNPs/PE薄片(图S6)的水蒸气透过率更高, 为0.09484 g/(m2∙d), 这说明随着掺入的AgNPs的增加, 水蒸气透过率有上升趋势。然而0.48wt%-AgNPs@GO/PE薄片(图S7)的水蒸气透过率仅为0.02410 g/(m2∙d), 比PE薄片下降了38.5 %, 这说明AgNPs@GO的掺入能有效地提高PE基复合材料阻隔水蒸气的性能。这一现象一方面可能是由于AgNPs@GO上丰富的极性基团能在复合材料内部形成氢键, 减缓了水蒸气分子在复合材料内部的扩散速度, 另一方面也可归因于部分AgNPs@GO的二维片层结构取向与薄片平行, 能很好地阻隔水分子的扩散传递。
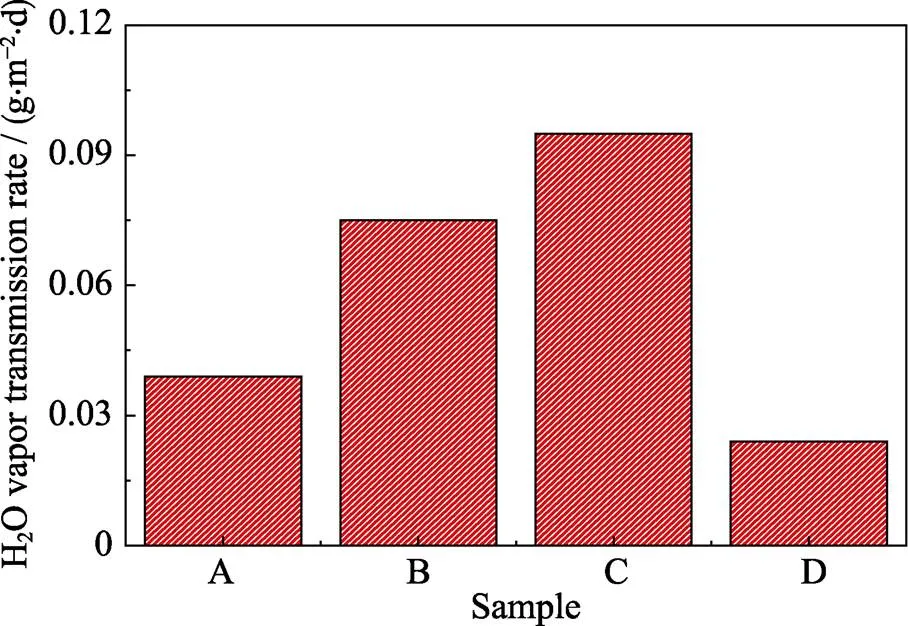
图8 水蒸气透过率实验结果
A: PE; B: 0.48wt%-AgNPs/PE; C: 2.88wt%-AgNPs/PE; D: 0.48wt%- AgNPs@GO/PE
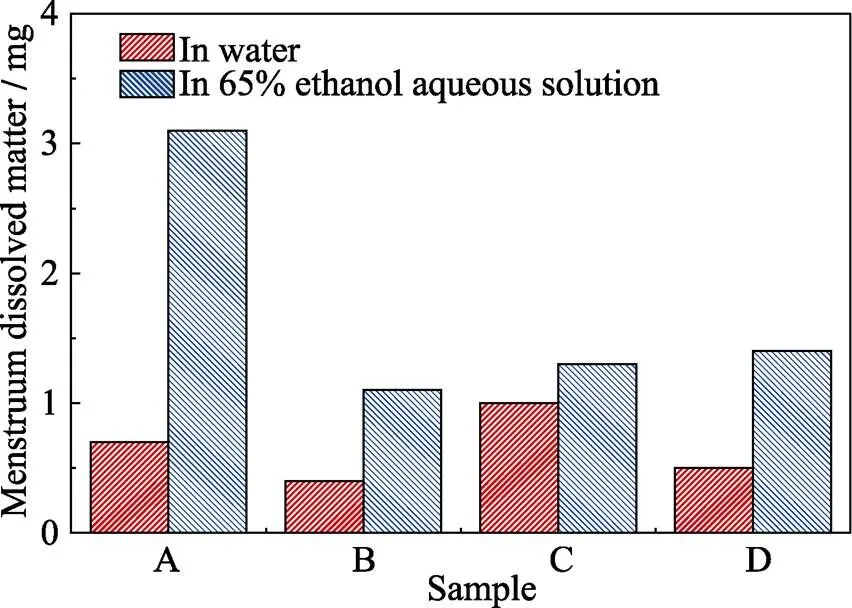
图9 溶出物实验结果
A: PE; B: 0.48wt%-AgNPs/PE; C: 2.88wt%-AgNPs/PE; D: 0.48wt%- AgNPs@GO/PE
2.5 0.48wt%-AgNPs@GO/PE的耐溶出性能
如图9所示, 0.48wt%-Ag@GO/PE薄片在121 ℃高压水浴30 min溶出的不挥发物质量为0.5 mg, 略小于相同条件下PE薄片的不挥发物溶出量0.7 mg, 但2.88wt%-AgNPs/PE在高压水浴中的不挥发物溶出量为1.0 mg明显高于PE薄片。此外, 0.48wt%- Ag@GO/PE薄片、0.48wt%-AgNPs/PE薄片和2.88wt%-AgNPs/PE薄片浸泡在58 ℃的65%乙醇溶液中30 min溶出的不挥发物量分别为1.4、1.1和1.3 mg, 均远小于相同条件下PE薄片不挥发物溶出量3.1 mg, 这说明0.48wt%-Ag@GO/PE在水和乙醇溶液中都具有较好的耐溶出性能。
3 结论
采用绿色简便的超声波辅助液相法制备了一种新的负载纳米银的氧化石墨烯材料AgNPs@GO, 该材料能有效抑制铜绿假单胞菌生长, 并且其抑菌性能优于AgNPs和GO材料。AgNPs@GO掺杂PE制备的新型复合材料0.48wt%-AgNPs@GO/PE具有更好的抑菌能力和更强的阻隔水蒸气性能, 并且在水和乙醇溶液中都显示出较好的耐溶出性能, 有望用于食品和药品的包装材料。
[1] ZAHRA S A, BUTT Y N, NASAR S,Food packaging in perspective of microbial activity: a review.., 2018, 6(2): 752–757.
[2] LIM M, KIM D, SEO J. Enhanced oxygen-barrier and water- resistance properties of poly(vinyl alcohol) blended with poly(acrylic acid) for packaging applications.., 2016, 65(4): 400–406.
[3] JJOKAR M, RAHMAN R A, IBRAHIM N A,Melt production and antimicrobial efficiency of low-density polyethylene (LDPE)-silver nanocomposite film..,2012, 5(2): 719–728.
[4] DAGLIA M. Polyphenols as antimicrobial agents.., 2012, 23(2): 174–181.
[5] KIM J S, KUK E, YU K N,Antimicrobial effects of silver nanoparticles.., 2007, 3(1): 95–101.
[6] SANCHEZ-VALDES S. Sonochemical deposition of silver nanoparticles on linear low density polyethylene/cyclo olefin copolymer blend films., 2014, 71(7): 1611–1624.
[7] LUO Chen, DONG Zheng, LI Zhen-xing,The effect of nano-silver antibacterial package on the quality of shrimp meat during cold storage., 2018, 39(7): 60–64.
[8] HE Y, QIAN L, LIU X,Graphene oxide as an antimicrobial agent can extend the vase life of cut flowers., 2018: 1–13.
[9] GEORGAKILAS V, TIWARI J N, KEMP K C,Noncovalent functionalization of graphene and graphene oxide for energy materials, biosensing, catalytic, and biomedical applications.., 2016, 116(9): 5464–5519.
[10] PHAM T A, KUMAR N A, JEONG Y T. Covalent functionalization of graphene oxide with polyglycerol and their use as templates for anchoring magnetic nanoparticles.., 2010, 160(17/18): 2028–2036.
[11] DU W, LÜ Y, LU H,Surface modification by graphene oxide: an efficient strategy to improve the performance of activated carbon based supercapacitors.., 2017, 28(12): 2285–2289.
[12] JI H, SUN H, QU X. Antibacterial applications of graphene-based nanomaterials: recent achievements and challenges.., 2016, 105: 176–189.
[13] THAVANATHAN J, HUANG N M, THONG K L. Colorimetric detection of DNA hybridization based on a dual platform of gold nanoparticles and graphene oxide..,2014, 55(10): 91–98.
[14] RODRIGUEZ-GONZÁLEZ C, VELAZQUEZ-VILLALBA P, SALAS P,Green synthesis of nanosilver-decorated graphene oxide sheets.., 2016, 10(5): 301–307.
[15] DU W, LÜ Y, CAI Z,. Flexible all-solid-state supercapacitor based on three-dimensional porous graphene/titanium-containing copolymer composite film.., 2017, 33(9): 1828–1837.
[16] 姜兴茂,闵建中,黎珊. 制备单分散超细颗粒的方法: 中国, CN104690295A. 2013. 12. 05.
[17] LU C, MAI Y W. Preparation, characterization and antibacterial properties of silver-modified graphene oxide.., 2011, 21(10): 3350–3352.
[18] MOULDER J F, STICKLE W F, SOBOL P E,. Handbook of X-ray Photoelectron Spectroscopy. Japan: ULVAC-PHI, Inc, 1992: 12–86.
[19] TANG J, CHEN Q, XU L,. Graphene oxide-silver nanocomposite as a highly effective antibacterial agent with species-specific mechanisms.,2013, 5(9): 3867–3874.
[20] DAS M R, SARMA R K, SAIKIA R,Synthesis of silver nanoparticles in an aqueous suspension of graphene oxide sheets and its antimicrobial activity., 2011, 83(1): 16–22.
[21] MESARO N, NORDMANN P, PLESIAT Presistance and therapeutic options at the turn of the new millennium.., 2007, 13(6): 560–578.
[22] POLLACK M, YOUNG L. Protective activity of antibodies to exotoxin A and lipopolysaccharide at the onset ofin man,., 1979, 63(2): 276–286.
[23] SONG H, KO K, OH I,Fabrication of silver nanoparticles and their antimicrobial mechanisms.., 2006, 11: 58.
[24] FENG Q L, WU J, CHEN G Q,A mechanistic study of the antibacterial effect of silver ions onand.,2000, 52(4): 662–668.
[25] SONDI I, SALOPEK-SONDI B. Silver nanoparticles as antimicrobial agent: a case study onas a model for Gram-negative bacteria.,2004, 275(1): 177–182.
[26] LIU Z, STOUT J E, BOLDIN M,Intermittent use of copper- silver ionization for Legionella control in water distribution systems: a potential option in buildings housing individuals at low risk of infection.., 1998, 26(1): 138–140.
[27] PARK H J, KIM J Y, KIM J,Silver-ion-mediated reactive oxygen species generation affecting bactericidal activity.., 2009, 43(4): 1027–1032.
[28] ZHENG H, MA R, GAO M,. Antibacterial applications of graphene oxides: structure-activity relationships, molecular initiating events and biosafety.., 2018, 63(2): 133–142.
A New Polyethylene Composite Material Based on Nano Silver Particels Loaded Graphene Oxide
ZHANG Feng1,2, ZHANG Kai-Li1, ZHOU Ming-Ming2, CHEN Chao3, CAI Zhi-Wei3, WEI Guo-Hui4, JIANG Xing-Mao4,5, ZHANG Cheng1, Laurent RUHLMANN6, LÜ Yao-Kang1
(1. School of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China; 2. The Children's Hospital, Zhejiang University School of Medicine, Hangzhou 310052, China; 3. Zhejiang Institute for Food and Drug Control, Hangzhou, 310052, China; 4. Changzhou Yingzhong Nano Technology Co., Ltd, Changzhou 213000, China; 5. School of Chemical Engineering & Pharmacy, Wuhan Institute of Technology, Wuhan 430205, China; 6. Institut de Chimie, Université de Strasbourg, Strasbourg 67081, France)
A new nano silver particels loaded graphene oxide (AgNPs@GO) was obtained through ultrasonic assisted liquid phase method. In AgNPs@GO, nano silver particels (AgNPs) are mainly anchored at oxygen containing groups and defects of graphene oxide (GO) sheets, part of GO sheets are reduced and some Ag(0) atoms have been oxidized to Ag+ions. AgNPs@GO exhibits significantly stronger ability for inhibitingthan that of AgNPs and GO. Therefore, AgNPs@GO was further introduced to polyethylene (PE) matrix as an additive to prepare a new composite material 0.48wt%-AgNPs@GO/PE. Compare with bare PE and AgNPs doped PE composites, 0.48wt%-AgNPs@GO/PE not only has a better antibacterial ability and stronger water vapor barrier property, but also dissolves out less nonvolatile substance than PE in water and ethanol solution.
nano silver particels; graphene oxide;; polyethylene; antibacterial ability; water vapor barrier property
O614
A
1000-324X(2019)06-0633-08
10.15541/jim20180372
2018-08-09;
2018-09-04
国家自然科学基金(21501148); 浙江省药品接触材料质量控制研究重点实验室开放基金; 浙江省自然科学基金(LY19B01000) National Natural Science Foundation of China (21501148); Open Funding from Zhejiang Provincial Key Laboratory for Quality Control of Drug Contact Materials; Zhejiang Provincial Natural Science Foundation (LY19B01000)
张峰(1980–), 男, 副主任医师. E-mail: zfwl@zju.edu.cn
吕耀康, 副研究员. E-mail: yaokanglv@zjut.edu.cn

