肠炎沙门菌iroB基因缺失株的构建及部分特性分析
吴同垒,陈 娟,于秀建,张志强,李佩国*,朱国强
(1.河北科技师范学院,河北秦皇岛066004;2.扬州大学,江苏扬州225009)
肠炎沙门菌(Salmonella entericaserovarEnteritidis)是沙门菌的重要成员,可以引起家禽短暂的全身性感染,表现为肠道感染的亚临床症状,而对于被感染的母鸡则表现为慢性长期带毒[1-2],污染鸡蛋、鸡肉,造成人类对沙门菌的感染[3-4]。因此,控制鸡群中肠炎沙门菌的流行,是控制人类对其感染的重要前提。
肠炎沙门菌为兼性胞内寄生菌,其毒力主要是协助其能够在细胞内存活并增殖。在这个过程中,沙门菌要面临多种不良环境,如胃肠道中的酸碱应激、细胞中的氧化应激和热应激等[5]。iroB 基因编码C-末端糖基转移酶,有研究表明在沙门菌感染细胞过程中iroB 基因高表达,因此推测其在沙门菌的胞内生存和抗应激能力中具有重要作用[6]。本研究利用λ- 同源重组技术对肠炎沙门菌iroB 基因进行敲除,并进行体外应激试验、药敏试验和胞内存活试验,验证IroB 在沙门菌致病机制中的作用。
1 材料与方法
1.1 主要实验材料 鼠源巨噬细胞Raw264.7 由吉林农业大学单晓枫教授惠赠。野生菌株C50336 (简称 WT)、肠炎沙门菌 c50336 感受态细胞、质粒pKD3、pKD46、pCP20、pBBR322 均由扬州大学朱国强教授惠赠。TaqDNA 聚合酶、dNTP、DNA Maker 均购自宝生物工程(大连)有限公司;T4 连接酶和限制性内切酶、蛋白Marker 均购自Fermentas公司;L- 阿拉伯糖购自 Sigma 公司;铁螯合剂-DAP (2-2'-联吡啶)购自Sigma 公司;ATB 生化自动鉴定系统及ID32E 生化鉴定试纸条购自法国Biomerieux 公司。
1.2 λ-Red 同源重组引物的设计与合成 根据NCBI 中登录的沙门菌基因组序列(CP028151.1),利用Primer Premier 5 设计引物。引物P1/P2 由两部分组成,前半部分(有下划线部分)与iroB 基因序列同源,后半部分与质粒pKD3 氯霉素抗性基因同源,该对引物用于扩增氯霉素基因(cat)。引物P3/P4 用于扩增iroB 基因开放阅读框,构建其回补菌株。引物P5/P6 位于iroB 基因开放阅读框外侧,用于缺失菌株的鉴定。引物由上海生工生物工程技术服务有限公司合成(表1)。
1.3iroB 基因缺失株及回补菌株的构建 以质粒pKD4 为模板,利用引物P1/P2 扩增cat打靶基因片段,将cat片段电转化至肠炎沙门菌c50336 (携带质粒pKD46)感受态细胞中,涂布氯霉素平板,培养24 h 后挑取单菌落利用引物P1/P2 进行PCR 鉴定。将PCR 阳性菌株42 ℃热激去除质粒pKD46,得到一次重组菌株c50336::cat,挑取c50336::cat 单菌落摇菌至对数期,离心弃上清,冰冷的去离子水洗涤3 次后制备电转化感受态细胞,将质粒pCP20 电转化入制备的感受态细胞中,以消除氯霉素抗性标记,PCR 鉴定阳性的菌株,再次42 ℃热激去除质粒 pCP20,得到二次重组菌株 c50336ΔiroB (简称KO)。同时将上述两次鉴定过程中的PCR 产物连接pMD18-T 载体,进行测序分析。

表1 引物信息Table 1 Primers designed for target genes
同时,以肠炎沙门菌基因组为模板,利用P3/P4引物扩增iroB基因片段,将其克隆至pBR322 质粒中,即为pBR322-iroB,电转化至重组菌株c50336 ΔiroB 中,构建回补菌株 c50336ΔiroB+iroB (RS)。
1.4 重组菌生化特性检测 挑取c50336、c50336 ΔiroB和 c50336ΔiroB+iroB 单菌落分别接种 LB 液体培养基中,37 ℃震荡培养,每隔2 h 测定一次各菌液OD600nm,绘制3 种菌的生长曲线。同时,采用ATB 生化自动鉴定系统对3 种菌进行理化特征鉴定。
1.5 重组菌的应激试验 挑取c50336、c50336 ΔiroB和c50336ΔiroB+iroB 单菌落培养至对数期,分别进行酸碱应激、热应激、氧化应激试验。酸碱应激使用pH3.5 和pH10.0 的灭菌生理盐水37℃ 孵育30 min;热应激条件为42 ℃,生理盐水中孵育10 min;氧化应激条件为含10 mmoL/L H2O2的生理盐水,37 ℃孵育10 min。同时倍比稀释后进行细菌计数。每项试验重复3 次。
1.6 重组菌的抗蛋清杀伤试验 将4~6 枚鸡蛋表面消毒后,无菌吸取蛋清。挑取c50336、c50336 ΔiroB 和 c50336ΔiroB+iroB 单菌落培养至对数期 ,PBS 重悬并稀释至1×104cfu/mL 后取菌液加入等体积蛋清中充分混匀,37 ℃孵育。在不同时间点细菌计数,计算3 种细菌存活率(不同时间点的活菌数与初始活菌数之比)。
1.7 重组菌的铁利用试验和溶菌酶耐受试验 将配制的M9 液体培养基加入终浓度为 10 mmol/L 的DAP 后,分别接种 c50336、c50336ΔiroB 和 c50336 ΔiroB+iroB,起始浓度均为1×104cfu/mL,37 ℃培养2 h、6 h 和24 h 时分别滴板计数。
同时,参照文献[7]方法,分别对菌株c50336、c50336ΔiroB 和 c50336ΔiroB+iroB 进行溶菌酶耐受试验。
1.8 重组菌胞内存活能力的测定 将c50336、c50336ΔiroB 和 c50336ΔiroB+iroB 单菌落培养至对数生长期,灭菌PBS 重悬3 次后细菌计数。按照MOI 10 加入生长良好的Raw264.7 巨噬细胞培养孔中,孵育1 h 后置换为含20 μg/mL 庆大霉素的DMEM继续培养,将不同感染时间点(2 h、6 h、10 h、24 h)细胞裂解后,细菌计数。试验重复3 次。
1.9 重组菌耐药试验 采用多粘菌素B 进行最小抑菌浓度(MIC)试验:向96 孔板第一孔中加入终浓度为1 000 μg/mL 多粘菌素B (LB 液体培养基配置,每孔100 μL),2 倍倍比稀释至12 孔;将对数生长期的浓度为 1×109cfu/mL c50336、c50336ΔiroB 和c50336ΔiroB+iroB 菌液,以 10 μL/ 孔分别加入 96 孔板,37 ℃培养48 h,观察细菌生长情况。同时设置不加药物的对照组。
2 结 果
2.1 c50336ΔiroB 重组菌株的构建 对一次重组菌株 c50336::cat 和二次重组菌株 c50336ΔiroB 经 PCR鉴定及测序分析,结果显示PCR 扩增到与预期相符片段,测序结果与预期一致,表明获得了一次重组菌株 c50336::cat 和二次重组菌株 c50336ΔiroB (图1)。利用质粒 pBBR322,构建回补菌株 c50336 ΔiroB+iroB,经 PCR 鉴定构建正确(图略)。

图1 肠炎沙门菌iroB 基因缺失株的PCR 鉴定Fig.1 Identification of iroB-deletion strain of S.enterica by PCR
2.2 3 种菌的生物学特性分析 检测菌株c50336、c50336ΔiroB 和 c50336ΔiroB+iroB 不同培养 时 间 的OD600nm,绘制生长曲线,结果显示,在LB 液体培养基中,37 ℃培养条件下,细菌生长速度无明显差异(图2)。表明iroB 基因缺失不影响沙门菌的生长。
利用ATB 全自动生化鉴定系统对各菌株生化反应谱进行测定,结果显示三者生化反应谱无区别,表明iroB 基因缺失并不影响肠炎沙门菌的生化特性。
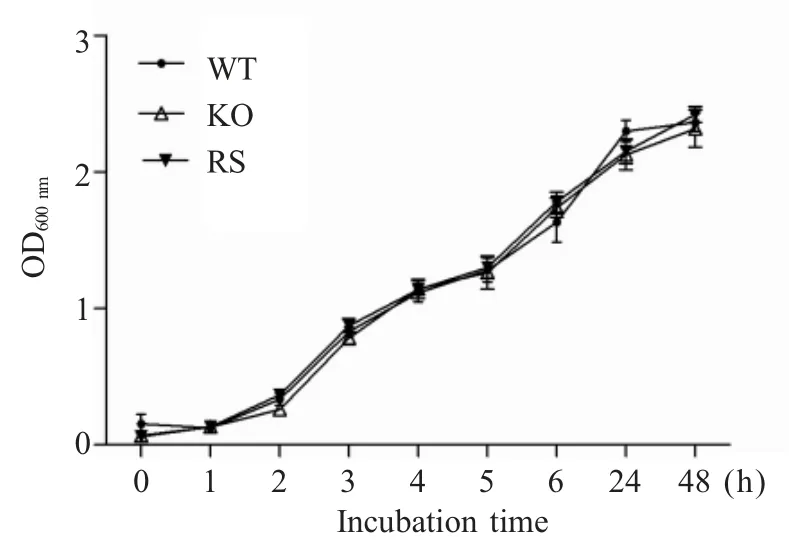
图2 不同菌株生长曲线测定Fig.2 Growth curve measurement
2.3iroB 基因缺失对肠炎沙门菌抗应激能力的影响体外应激试验检测菌株 c50336、c50336ΔiroB 和c50336ΔiroB+iroB 对酸、碱、热和氧化应激的抵抗能力。结果显示,iroB 基因缺失株在42 ℃热应激条件下的存活菌数低于野生型菌株,但在其它应激条件下与野生型相比无显著变化(图3)。表明IroB 参与沙门菌抵抗热应激。
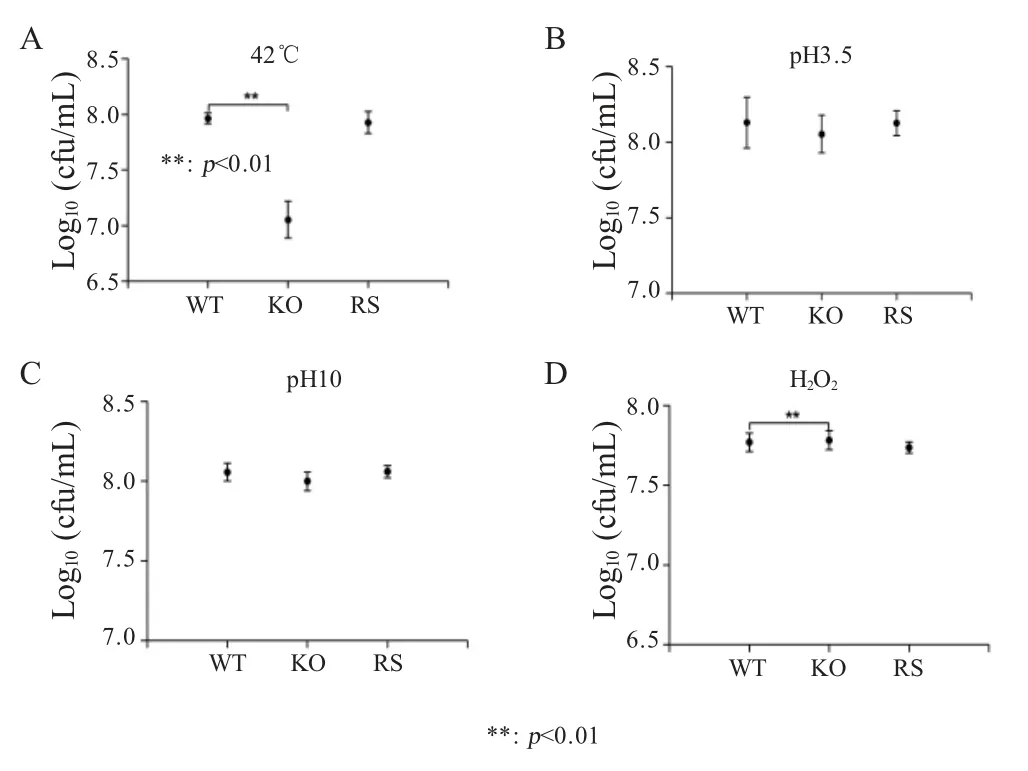
图3 环境应激对iroB 基因缺失株生长的影响Fig.3 Effects of environmental stress on the growth of iroB gene-knockout strains
2.4 重组菌的蛋清抑菌试验 将菌株c50336、c50336ΔiroB 和 c50336ΔiroB+iroB 与蛋清混合 孵 育后,通过活菌计数法计算细菌存活率。结果显示,菌株c50336ΔiroB 存活率极显著低于c50336 和回补菌株(p<0.01),表明IroB 参与肠炎沙门菌抵抗蛋清的杀伤作用(图4)。
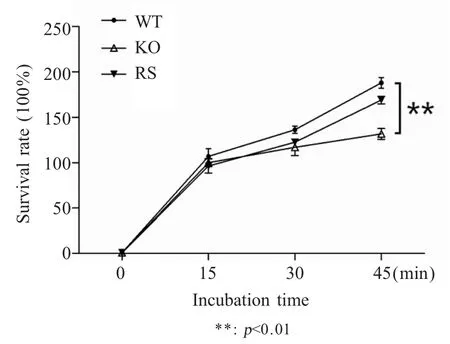
图4 重组菌在蛋清中存活试验Fig.4 Survival test of c50336 related strains in egg albumen
2.5 铁利用试验和溶菌酶耐受试验 利用DAP 进行铁利用试验,结果显示,在缺铁环境中,相比野生菌株和回补菌株,c50336ΔiroB 的生长速度明显降低(p<0.05) (图5A)。表明沙门菌IroB 的功能与其对蛋清中的铁利用相关。
对3 种菌株进行溶菌酶耐受试验,结果显示,相对于 c50336,c50336ΔiroB 存活率明显降低(p<0.05)(图5B),但回补菌株存活率与野生株趋于一致。表明IroB 有助于肠炎沙门菌抵御蛋清中溶菌酶的杀伤作用。
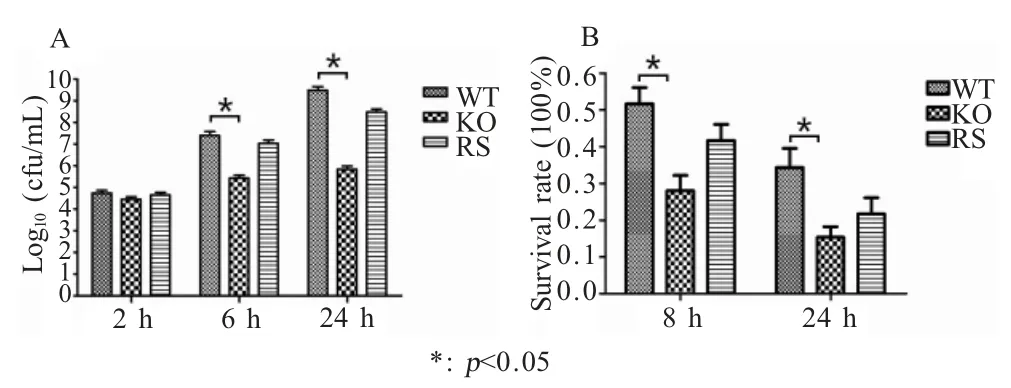
图5 重组菌的缺铁试验(A)和溶菌酶耐受试验(B)Fig.5 Survival test of c50336 related strains under iron-limited conditions (A) and in lysozyme (B)
2.6iroB 基因缺失对肠炎沙门菌胞内存活的影响将 c50336、c50336ΔiroB 和 c50336ΔiroB+iroB 菌液分别感染鼠源巨噬细胞系Raw264.7,测定不同菌株的胞内存活数。结果显示,在感染后的不同时间点,3 种菌株活菌数未出现明显差异(图6)。表明在体外培养条件下,IroB 对肠炎沙门菌的胞内存活能力无明显影响,即不影响其毒力。
2.7 重组菌的耐药性分析结果 通过多粘菌素B的MIC 试验,确定野生型菌株的MIC 值为15.625(1/26×103)μg/mL,缺失菌株 c50336ΔiroB 的 MIC 为7.813(1/27×103)μg/mL,耐药性极显著降低(p<0.01)。而回补株 MIV 恢复为 15.625 (1/26×103)μg/mL。表明IroB 参与了细菌对多粘菌素B 的耐药。
图6 重组菌的胞内存活试验Fig.6 Intracellular survival test
3 讨 论
沙门菌是一种典型的胞内寄生菌,其致病性的重要表现为在细胞内增殖的能力。沙门菌进入宿主细胞后,调整自身的基因表达,抵御多种多样的环境刺激和杀伤作用,并形成有利于保护自身的内噬体(Salmonella-containing vacuol,SCV),最终在SCV保护下实现细胞内增殖[8-10]。研究表明,相对于体外培养,沙门菌感染细胞后,IroB 表达量显著升高,推测其可能影响了沙门菌的环境适应能力和毒力等[6]。为了证明IroB 的重要作用,本研究利用λ-Red 重组技术构建了肠炎沙门菌iroB 基因缺失菌株,进行了相关试验,结果显示,IroB 参与了肠炎沙门菌对热应激和蛋清杀伤的抵抗能力,参与了其对抗菌肽类物质多粘菌素B 的耐药。但是利用鼠源巨噬细胞Raw264.7 进行体外细胞感染试验,结果显示iroB 基因缺失菌株并未表现出明显的毒力降低,即IroB 不影响细菌的毒力。这可能是因为简单的体外感染试验并不能模拟宿主体内复杂环境,从而未能表现出毒力降低。
肠炎沙门菌是一种重要的人兽共患菌,能够感染母鸡,通过垂直传播感染鸡胚,从而引起误食人群的感染。蛋清具有多种成分起到抑菌和杀菌作用,比如利用转铁蛋白限制细菌摄入自身所需要的铁离子,利用大量溶菌酶溶解外来细菌,以及利用核酸内切酶和外切酶,破坏细菌的DNA[3,11]。耐受蛋清杀伤的能力是肠炎沙门菌能够垂直传播乃至感染人类的重要原因[12-13]。本研究结果表明IroB 参与了肠炎沙门菌对蛋清的抵抗。由于蛋清中含有大量螯合铁离子的成分,且IroB 参与大肠杆菌对铁离子的吸收,并与其致病性密切相关[14],因此本研究通过铁利用试验进一步揭示IroB 的作用,表明IroB能够影响沙门菌在缺铁环境中的生存能力,提示其参与了细菌对铁离子的吸收。基于蛋清中含有大量的溶菌酶成分,因此本研究通过溶菌酶耐受试验表明IroB 缺失参与沙门菌对溶菌酶的耐受。上述结果进一步阐明了IroB 在沙门菌抗蛋清杀伤中的作用机制。
多粘菌素B 是一种抗菌肽类物质,常被用来抵御和杀伤病原微生物。其作用方式主要是在细菌细胞壁上打孔形成通道,使得细菌内容物释放出来,从而导致细菌死亡[15]。本研究利用MIC 试验,证明IroB 参与了肠炎沙门菌对多粘菌素B 的耐药。病原菌能够对抗抗菌肽类物质的杀伤,其作用机制通常为利用外排泵排出,分泌蛋白酶降解和合成吸附抗菌肽的分子等[16-17]。IroB 缺失后,肠炎沙门菌耐受抗菌肽能力下降,其具体机制有待研究。
总之,IroB 参与了肠炎沙门菌对某些环境应激和蛋清杀伤的抵抗,和对多粘菌素B 的耐药,但并未影响肠炎沙门菌的细胞内存活数。IroB 影响肠炎沙门菌抵御环境应激的能力和耐药性,其具体的作用机制需要深入研究。同时,IroB 是否在动物机体影响细菌的毒力也需要进一步证明。

