健康猪体内塞尼卡病毒的分离和鉴定
张 志,张丽丽,2,张美晶,刘 爽,张 峰,董雅琴,张 慧,崔 进,吴发兴,李晓成*
(1.中国动物卫生与流行病学中心,山东青岛266032;2.青岛农业大学,山东青岛266019)
塞尼卡病毒(Senecavirus A,SVA),曾用名为塞尼卡谷病毒(Seneca Vally virus,SVV),是最近发现的一种引起猪感染和发病的小核糖RNA 病毒。2014年,国际病毒分类委员会在小核糖RNA 病毒科(Picornaviridae)下新增一个塞尼卡病毒属(Senecavirus),SVA 是该属唯一的病毒[1]。作为单股正链不分节段的RNA 病毒,SVA 的直径约为27 nm,基因组大小约为7.3 kb。在结构上,SVA 与其它小RNA 病毒类似,基因组也由5' 端、3' 端和一个大的开放阅读框(ORF)组成,且ORF 编码一个由2181 aa 组成的多聚蛋白前体,多聚蛋白前体进一步可水解形成VP1~VP4 等 4 个结构蛋白和 7 个非结构蛋白[1]。SVA 最初发现于PER.C6 的细胞培养物中,但直到2012 年才发现SVA 可以引起猪的水泡样病变,感染猪的鼻吻部、蹄部冠状带等出现明显水泡[2],在临床上与口蹄疫、猪水泡性口炎、猪水疱病、猪水泡性疹等疾病的病变十分相似[3]。美国首先报道了SVA 引起的水疱病,其后,加拿大、巴西、中国、泰国、哥伦比亚等养猪业比较发达的国家陆续也从出现水泡病的猪病料中检测到SVA[4-8]。2015 年,我国首次报道广东某猪场发生塞尼卡病,不久之后,湖北、福建、河南、黑龙江等省的猪场先后检测到了SVA,这意味着SVA 在我国猪场的感染已经相当广泛[9-10]。
本实验室前期对我国健康猪群进行了SVA 的流行病学监测,发现部分屠宰场的外观健康猪群也存在SVA 感染,本研究在此基础上进行了SVA 病原的分离鉴定和分子流行特征分析,结果从这些SVA阳性样品中分离到了2 株SVA,为后续的疫苗研制等研究奠定了基础。
1 材料与方法
1.1 样品及其来源 10 份SVA 阳性样品来源自广西壮族自治区某屠宰场屠宰的生猪,采样猪外观健康,没有明显的临床发病症状和病理剖检变化,样品经荧光定量RT-PCR 鉴定为SVA 阳性,放置在-70 冰箱保存备用。
1.2 主要试剂 BHK-21 细胞由中国动物卫生与流行病学中心畜病监测室保存。Premix ExTaq酶、一步法 RT-PCR 试剂盒、pMD18-T 载体和 DH5α 感受态细胞均购自宝生物工程(大连)有限公司;TRIzol试剂、DMEM 培养基、胎牛血清、胰酶等均购自life 公司。
1.3 引物设计及合成 根据GenBank 中登录的SVA 病毒株(NC_011349)的VP1 基因序列设计一对引物(SVA-VP1-F:ACTCTCCGTCTCCCCGTTGATTG TAAT/SVA-VP1-R:TGGGTTGTCAGAAGCAGGACC AGGATT),用于SVA 的VP1 基因扩增,扩增特异性序列预期884 bp。
1.4 病毒的分离培养及效价测定 取10 份SVA 阳性样品称重后加入 4 倍体积的 PBS (0.01 mol/L,pH7.2)进行研磨,以8 000 r/min 离心5 min,取上清液,用0.22 μm 无菌滤器过滤后加入到生长良好的单层BHK-21 细胞中,同时用PBS 空白作为阴性对照。接种3 d 后将细胞反复冻融3 次,继续接种新的BHK-21 细胞,如此连续盲传5 代,记录细胞病变(CPE),对分离的病毒用 96 孔板测定病毒的TCID50。
1.5 RNA 的提取 取接种BHK-21 细胞后出现明显CPE 的细胞上清液,按照TRIzol 试剂的操作说明书提取总RNA。同时,对照组BHK-21 细胞的上清液也按照此法提取RNA。
1.6 SVA 分离株 VP1 基因的扩增、测序及结果分析 以1.4 分离病毒提取的RNA 为模板,按照一步法RT-PCR 试剂盒说明书和1.3 中的引物扩增SVA的VP1 基因,PCR 产物经琼脂糖凝胶电泳检测后克隆于pMD18-T 载体,连接产物转化DH5α 接感受态细胞,经蓝白斑鉴定后挑选白斑提取重组质粒进行鉴定,阳性克隆由宝生物工程(大连)有限公司测序。选择GenBank 中已登录的SVA 基因序列作为参考株序列,利用DNAStar 和Clustalw1.83 等软件进行核苷酸序列比对、同源性分析,利用MEGA 5.0 软件构建系统进化树,并以Bootstrap 值1000 验证进化树的可信度。
1.7 SVA 分离病毒上清液中其它病原的检测 利用本实验室构建的方法[11],同时检测该阳性样品和分离病毒上清中是否存在猪瘟病毒、猪圆环病毒2型、猪伪狂犬病病毒、牛病毒性腹泻-黏膜病病毒、猪繁殖与呼吸综合征病毒、猪乙型脑炎病毒等。参考《OIE 陆生动物诊断试验与疫苗手册》 提供的口蹄疫病毒(FMDV)检测方法,检测分离培养的细胞上清中是否含有FMDV。
2 结果与讨论
2.1 病毒分离培养结果 10 份SVA 阳性样品接种BHK-21 后的第一代和第二代接种细胞均无明显的CPE,但接种第 3 代后 GXT91 和 GXT94 等 2 份样品出现了轻微的CPE。继续盲传到第5 代时,仍仅接种 GXT91 和 GXT94 的 BHK-21 细胞可以观察到明显的CPE,显微镜下可见大量细胞变圆、皱缩、死亡和脱落,而对照组BHK-21 细胞形态和单层均较好,同时其它8 份样品接种的BHK-21 细胞均未出现明显的CPE。表明可以用BHK-21 细胞分离和培养SVA,并且SVA 在BHK-21 细胞中经过连续3代盲传后就能够产生典型的特征性CPE,与其它病毒引起的CPE 存在明显差异。进一步将收获的SVA病毒株GXT94 的第5 代病毒进行TCID50测定,效价为107.6/mL。有研究发现,SVA 对肿瘤具有很高的专嗜性,可以溶解小细胞肺癌细胞、小儿神经内分泌癌细胞等,曾用于肿瘤的靶向治疗[12],但有关SVA 的细胞培养特性开展得研究不多,本研究采用BHK-21 细胞从样品中分离培养得到2 株SVA,为SVA 的分离培养提供了一条可行的技术路径。
2.2 SVA VP1 基因的RT-PCR 扩增结果 GXT91和GXT94 接毒后的第5 代上清液与相应的阳性样品提取的 RNA 分别进行 RT-PCR 扩增,结果显示GXT91 和 GXT94 的第 5 代细胞上清液与 GXT94 原始样品均可以扩增出一条约900 bp 的特异性条带,而GXT91 原始样品、空白对照和BHK-21 阴性对照样品均无特异性条带扩增(图1),这可能与原始样品GXT91 中SVA 的含量较少有关。前期对样品初筛时采用的是荧光定量RT-PCR 方法,而本次检测时采用了 RT-PCR 方法, 导致样品 GXT91 用RT-PCR 检测时呈现阴性,但经过5 代连续传代以后,其上清液用RT-PCR 检测到明显的特异性条带。测序结果显示,GXT91 和GXT94 的VP1 基因序列均为884 bp,与预期大小一致,表明 GXT91 和GXT94 接种BHK-21 的上清液中均存在 SVA 的增殖。对GXT91 和GXT94 的第5 代细胞上清液分别进行猪瘟、口蹄疫等外源病原的检测,结果均为阴性,表明这种BHK-21 产生的典型CPE 是由SVA 引起的,而非其它病原感染的结果。
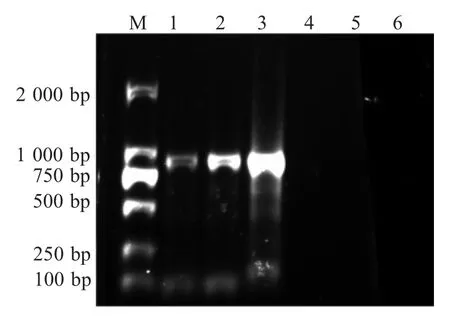
图1 SVA 样品及细胞培养上清液的RT-PCR 检测结果Fig.1 Detections of SVA from the samples and their cell culture supernatant by RT-PCR
2.3 GXT91 和GXT94 分离株 VP1 基因的序列分析 同源进化分析结果显示,GXT94 和GXT91 与SVA 参考病毒株NC_011349 VP1 基因的同源性为90.2 %~90.6 %,推导氨基酸同源性为96.7 %~97.1 %;与其它SVA 株的核酸同源性为92.8 %~97.4 %,推导氨基酸同源性为98.2 %~100 % (图2)。表明本研究分离的病毒确实是SVA,但这两株SVA 分离株与目前SVA 参考株的核酸序列存在一定差异。进一步分析SVA 的遗传变异性发现,新出现的SVA 株与参考株NC_011349 之间的同源性显著降低,仅为90.2 %~90.6 %,低于其它病毒株与NC_011349 的同源性,表明分离病毒株VP1 基因已发生明显的变异。但所有SVA 株之间推导氨基酸的同源性却较高,提示SVA 的核酸突变多为无义突变,这些突变集中发生在氨基酸的第二或第三核苷酸的位置,对编码的氨基酸类别影响较小,即对SVA 的生物学功能影响不大。但这种不断增强的变异也提示要密切关注SVA 的分子演化状况,防止核酸突变积累到一定程度引起病毒的生物学功能发生较大转变。
同时,用SVA 的VP1 基因构建的同源进化树也显示,这些SVA 株可以分为两个大的分支I 和II。SVA 最早的参考株NC_011349 以及美国、泰国和中国的部分病毒株属于分支I,本研究分离的2 个病毒株以及哥伦比亚、美国和中国的部分病毒株属于分支II,与NC_011349 参考株的遗传距离较远(图2)。这一结果提示,SVA 流行株的变异一直持续地进行,新的病毒流行分支不断出现。本研究中分离和鉴定的2 株SVA 与其它SVA 株之间呈现明显差异,表明GXT91 和GXT94 形成的进化分支可能又是一个新的流行分支。
图2 SVA 分离株与参考株的VP1 基因序列进化树分析Fig.2 The evolutionary tree based on the VP1 gene sequences of the SVA isolates and reference strains
现有研究表明,猪的水泡病除了口蹄疫、猪水泡病、猪疱疹性口炎等以外,还与SVA 的感染密切相关[2,10],但截止本文投稿为止,国内外未见从健康猪群分离SVA 的报道。本研究结果表明在健康猪群中SVA 的感染仍然存在,不可忽视。

