生物质炭介导生防微生物抑制辣椒疫霉的作用*
王光飞, 马 艳**, 郭德杰, 罗 佳, 梁永红, 仇美华
生物质炭介导生防微生物抑制辣椒疫霉的作用*
王光飞1, 马 艳1**, 郭德杰1, 罗 佳1, 梁永红2, 仇美华2
(1. 江苏省农业科学院农业资源与环境研究所/江苏省农业科学院农业部长江下游平原农业环境重点实验室 南京 210014; 2. 江苏省耕地质量与农业环境保护站 南京 210036)
生物质炭可有效防控土传病害, 筛选并鉴定出生物质炭介导下的生防微生物, 可为研究生物质炭防病机理和强化生物质炭防病效果提供理论依据。本研究首先进行秸秆生物质炭防控辣椒疫病盆栽试验, 利用定量PCR和平板计数明确生物质炭在防控辣椒疫病时可富集的已知生防微生物, 再通过选择性培养基初筛和定殖复筛筛选出生物质炭可富集的潜在生防微生物菌株, 最后研究各菌株在土壤中对辣椒疫霉的抑制作用。结果表明, 秸秆生物质炭使根际辣椒疫霉数量显著降低95.1%、辣椒疫病发生率显著降低91.1%, 并使具有生防功能的木霉菌、青霉菌、曲霉菌、芽孢杆菌、假单胞菌和鞘氨醇单胞菌数量显著增加2.22倍、4.09倍、3.89倍、2.45倍、1.45倍和1.30倍。通过平板初筛得到可能被生物质炭富集的22株潜在生防菌株。定殖复筛剔除部分假性生物质炭介导菌株, 获得可明确被生物质炭富集的2株木霉菌、3株青霉菌、2株曲霉菌、3株芽孢杆菌、3株假单胞菌、3株链霉菌和2株鞘氨醇单胞菌。木霉菌(TR1和TR3)、青霉菌(PE1)、曲霉菌(AS1和AS2)、芽孢杆菌(BA1、BA2和BA3)、假单胞菌(PS1和PS3)、链霉菌(ST1、ST4和ST5)13个菌株可显著削减土壤辣椒疫霉数量。其中, 所有木霉菌和曲霉菌菌株(TR1、TR3、AS1和AS2)及芽孢杆菌(BA1和BA2)、假单胞菌(PS1和PS3)和链霉菌(ST1)9个菌株与生物质炭具有显著的协同抑制辣椒疫霉效果。因此, 防控辣椒疫病时, 木霉菌、曲霉菌、芽孢杆菌、假单胞菌和链霉菌是生物质炭介导下的主要防病微生物。
生物质炭; 生防真菌; 生防细菌; 辣椒疫霉
生物质炭是由生物质原料如木材、农作物废弃物、畜禽粪便或生活垃圾等在无氧或缺氧条件下高温裂解产生的固体产物, 具有比表面积大、孔结构丰富、吸附能力强的特点, 并且富含有机碳、矿质养分及多种官能团等, 广泛应用于农业、环境、工业、能源等领域[1]。作为一种新型的土壤改良剂, 生物质炭在土壤中稳定性高, 具有改善土壤理化性质、提高水土保持能力和增加有机碳库的良好作用[2-3]。另外, 生物质炭对土壤微生物区系及土壤微生态环境有重要影响, 可直接或间接影响植物生长发育过程。多项研究表明生物质炭能显著提高微生物多样性和活性, 并改善土壤微生物群落结构[2-4]。
近年研究显示生物质炭可有效防控芦笋/番茄枯萎病、黄瓜/豆类猝倒病和烟草/番茄青枯病等土传病害[5-9], 其防控机理在于改善土壤生物和理化性状、抑制病原菌及诱导植物抗病性等[10-11]。本研究室以往研究显示秸秆生物质炭可有效防控辣椒疫霉引起的辣椒疫病, 防病机理与其改变土壤微生物区系密切相关, 同时也初步显示出了生物质炭对潜在生防微生物的增殖作用[12]。多项研究已表明生物质炭能显著提高土壤中木霉、芽孢杆菌、假单胞菌、链霉菌等具有生防功能的微生物数量, 这可能是其防控土传病害的重要机理[8,13-14]。
目前, 虽有一些研究从微生物区系方面探明生物质炭防控土传病害机理[6-8], 但至今少有生物质炭防控土传病害与其富集微生物关系的研究, 也鲜有生物质炭介导防病微生物的筛选研究。鉴于此, 本文研究了生物质炭防控辣椒疫病时可显著富集的潜在生防微生物, 并对其进行筛选和功能验证, 以明确和筛选出可被生物质炭富集并能与生物质炭协同抑制辣椒疫霉的生防微生物。本研究不仅为利用生物质炭防控辣椒疫病等土传病害提供理论依据, 而且为强化生物质炭防控土传病害效果提供理论支持。
1 材料和方法
1.1 试验材料
生物质炭由中国科学院南京土壤研究所谢祖彬研究员提供, 由玉米秸秆经马弗炉500 ℃厌氧裂解1 h所得, 粉碎过40目筛后备用。理化性状: pH 9.82, 电导率6091.3 μS∙cm-1, 有机质含量359.4 g∙kg-1, 全氮含量4.96 g∙kg-1, 全磷含量3.17 g∙kg-1, 全钾含量37.16 g∙kg-1, 有效磷含量2.22 g∙kg-1, 速效钾含量24.77 g∙kg-1。
供试土壤为淮安设施耕作土。理化性状: pH 7.20, 电导率706.5 μS∙cm-1, 有机质含量30.1 g∙kg-1, 全氮含量3.21 g∙kg-1, 全磷含量1.19 g∙kg-1, 全钾含量18.21 g∙kg-1, 有效磷含量165.3 mg∙kg-1, 速效钾含量179.1 mg∙kg-1。
供试辣椒疫霉菌由本实验室分离所得。供试辣椒品种为‘苏椒五号’。
1.2 生物质炭对辣椒根际有益微生物数量的影响
在江苏省农业科学院资源环境研究所大棚进行盆栽试验, 自然光照, 温度25~32 ℃。将制备好的辣椒疫霉游动孢子液喷洒加入土壤中, 并拌匀, 使得每克干土辣椒疫霉数量为100个游动孢子。再将试验土壤设两个处理: 1)空白对照(CK), 生物质炭施用量为0 g∙kg-1。2)生物质炭施用量为13.3 g∙kg-1(BC), 生物质炭加入土壤并拌匀。各处理土壤分装到圆口盆钵中, 每盆550 g含水量为16%的鲜土。每个处理45盆, 每15盆为1个重复。每盆种植1株六叶期辣椒苗。土壤处理时和栽植期间均未施肥。栽植15 d后统计病情指数, 并采集各处理根际土样测定有益微生物数量和辣椒疫霉数量。
测定的有益微生物包括木霉菌()、青霉菌()、曲霉菌()、芽孢杆菌()、假单胞菌()、链霉菌()和鞘氨醇单胞菌()。木霉菌、青霉菌和曲霉菌在马丁氏培养基平板上菌落特征明显, 采用梯度稀释涂平板法测定木霉菌、青霉菌和曲霉菌数量。采用定量PCR测定土壤中的辣椒疫霉[15]、芽孢杆菌[16]、假单胞菌[16]、链霉菌[17]和鞘氨醇单胞菌[18]数量。土壤DNA提取所用试剂盒为MP公司生产的FastDNA SPIN Kit for Soil, 按照使用说明提取土壤DNA。芽孢杆菌、假单胞菌和鞘氨醇单胞菌采用染料法定量PCR, 所用试剂盒为TaKaRa公司生产的SYBR Premix Ex Taq™, 按照使用说明进行定量PCR, 辣椒疫霉、芽孢杆菌、假单胞菌和鞘氨醇单胞菌的定量引物分别为CAPFW/CAPRV1[15]、BacF/1378R[16]、Psf/Psr[16]和Sphingo108f/Sphingo420r[18]。链霉菌采用探针法定量PCR, 所用试剂盒为TaKaRa 公司生产的Premix Ex Taq™ (Probe qPCR), 定量引物为StrepF/ StrepR, 探针为Strep-Probe[17]。
1.3 生物质炭介导生防菌菌株的筛选
1.3.1 平板初筛
将1.2中CK和BC处理的根际土样进行梯度稀释后涂平板, 采用5种不同培养基进行平板培养。马丁氏培养基可生长木霉、青霉和曲霉。V8培养基、King’s B培养基[19]、STR培养基[20]和Sphing培养基[21]分别为芽孢杆菌、假单胞菌、链霉菌和鞘氨醇单胞菌的选择性培养基。通过分析比较不同培养基下CK和BC处理间的目标微生物菌落特征和数量, 初步筛选出BC处理中显著多于CK处理的木霉菌、青霉菌、曲霉菌、芽孢杆菌、假单胞菌、链霉菌和鞘氨醇单胞菌菌株。
1.3.2 分子鉴定及平板拮抗辣椒疫霉效果
将1.3.1中筛选得到的菌株进行基因组DNA提取, 所用试剂盒为OMEGA公司生产的Bacterial DNA Kit和Fungal DNA Kit, 按照使用说明提取DNA。真菌DNA采用ITS保守序列通用引物ITS1/ITS4进行PCR扩增。细菌DNA采用16S rRNA保守序列通用引物27F/1492R进行PCR扩增。扩增产物送至生工生物工程(上海)股份有限公司测序, 将测定序列在GenBank中用Blast软件与数据库序列进行同源性比较。
将新鲜辣椒疫霉菌饼置于PDA平板中央, 在其两侧25 mm处接种待测细菌菌株, 每个菌株重复3次, 28 ℃培养5 d后, 根据待测细菌菌落边缘与辣椒疫霉菌落边缘之间的距离判定拮抗能力。将辣椒疫霉菌饼置于PDA平板离边15 mm处, 在另一侧离边15 mm处接种待测真菌菌株菌饼, 每个菌株重复3次, 28 ℃培养 5 d后, 根据待测真菌菌落对辣椒疫霉菌落重寄生长度判定拮抗能力。
1.3.3 定殖复筛
将1.3.1中初筛得到的真菌菌株进行液体培养, 以获得每个真菌菌株的新鲜菌丝, 离心生理盐水悬浮再匀浆后备用。将初筛得到的细菌菌株进行液体培养, 离心生理盐水悬浮后备用。将试验土壤分为对照土壤和生物质炭土壤, 生物质炭用量分别为0 g∙kg-1和13.3 g∙kg-1, 将各初筛细菌和真菌菌株分别添加到对照土壤中和生物质炭土壤中, 土壤中目标真菌添加浓度均为新鲜菌丝10 g∙kg-1, 目标细菌的添加浓度均为107CFU∙g-1。将含有目标菌的对照土壤和生物质炭土壤分别分装到圆口盆钵中, 每盆550 g鲜土。每个处理3盆, 每盆为1个重复。每盆种植1株六叶期辣椒苗。同1.2条件下种植15 d后, 对根际目标菌进行计数, 方法同1.2。在生物质炭土壤辣椒根际中定殖数量显著高于对照土壤的菌株则为生物质炭介导的潜在生防菌。
1.4 生物质炭介导生防菌削减辣椒疫霉数量能力的测定
将制备好的辣椒疫霉游动孢子液喷洒加入土壤中, 并拌匀, 使得每克干土辣椒疫霉数量为500个游动孢子。再分为对照土壤和生物质炭土壤, 生物质炭用量分别为0 g∙kg-1和13.3 g∙kg-1。将供试生防菌分别加入到对照土壤和生物质炭土壤中。生防真菌的添加方式为将1.3.3中的新鲜菌丝按10 g∙kg-1添加到土壤中。生防细菌的添加方式为将1.3.3中的菌液添加到土壤中, 添加浓度均为107CFU∙g-1。将含有目标菌的对照土壤中和生物质炭土壤, 分别分装到圆口盆钵中, 每盆550 g鲜土。每个处理3盆, 每盆为1个重复。同1.2条件下保湿培养15 d后, 对土壤辣椒疫霉数量进行定量检测。
1.5 数据处理方法
测定数据用Microsoft Excel 2016软件作图, 用SPSS17.0软件进行统计分析。文中发病率和土壤微生物数量均为3次重复平均值。
2 结果与分析
2.1 生物质炭对辣椒根际有益微生物数量的影响
由表1可知, 含等浓度辣椒疫霉的对照土壤(CK)和生物质炭土壤(BC)在移栽辣椒15 d后, 辣椒疫霉病的病情指数分别为32.56%和2.91%, 辣椒疫霉数量分别为12.67´104copies∙g-1(土)和0.62´104copies∙g-1(土), 两处理均存在显著差异。根际有益微生物数量方面, BC处理木霉菌、青霉菌、曲霉菌、芽孢杆菌、假单胞菌和鞘氨醇单胞菌数量分别是CK处理的2.22倍、4.09倍、3.89倍、2.45倍、1.45倍和1.30倍, 且均达到显著差异。与前人研究相符, 生物质炭能有效降低土壤中病原菌数量和土传病害发生率, 并且可增加土壤有益微生物数量, 生物质炭对土壤有益微生物的增殖作用可能是其防控土传病害主要机理之一。虽然本研究中生物质炭对链霉菌数量影响较小, 但笔者以往研究显示生物质炭可显著增加链霉菌数量[12]。
同行不同小写字母表示对照和生物质炭处理间达显著差异(0.05)。In each row, means followed by different lowercase letters are significantly different at< 0.05.
2.2 生物质炭介导生防菌的初筛及分子鉴定
通过分析比较CK处理和BC处理在马丁氏平板上的木霉菌、青霉菌和曲霉菌数量及菌落特征, 初步筛选出BC处理中数量显著多于CK处理的3株木霉菌菌株(TR1、TR2、TR3)、3株青霉菌菌株(PE1、PE2、PE3)和两株曲霉菌菌株(AS1、AS2)。通过分析比较CK处理和BC处理在特定选择性培养基平板上的芽孢杆菌、假单胞菌、链霉菌和鞘氨醇单胞菌数量及菌落特征, 初步筛选出生物质炭可富集的4株芽孢杆菌株(BA1、BA2、BA3、BA4)、3株假单胞菌菌株(PS1、PS2、PS3)、5株链霉菌菌株(ST1、ST2、ST3、ST4、ST5)和两株鞘氨醇单胞菌菌株(SP1、SP2)。各菌株分子鉴定结果见表2。可见, 在马丁氏平板上通过菌落形态辨别木霉菌、青霉菌和曲霉菌具有很高的准确性。芽孢杆菌、假单胞菌、链霉菌和鞘氨醇单胞菌选择性培养基对目标微生物的选择性较高, 结合菌落形态特征也可准确地筛选出特定属微生物。
2.3 生物质炭介导生防菌的复筛
对初筛生防菌进行定殖复筛, 能在辣椒根际土壤中被生物质炭所富集即为生物质炭介导的防病微生物。生防真菌方面, 生物质炭可显著增加根际木霉菌TR1和TR3、青霉菌PE1和PE2及曲霉菌AS1和AS2的数量, 对青霉菌PE3数量也有较强的增加作用。TR1、TR3、PE2和AS2在平板上对辣椒疫霉菌具有强重寄生作用, 但PE1、PE3和AS1作用较弱。生防细菌方面, 生物质炭可显著增加芽孢杆菌BA1和BA2、假单胞菌PS1和PS2、链霉菌ST1和ST4及鞘氨醇单胞菌SP1和SP2的数量, 对芽孢杆菌BA3、假单胞菌PS3和链霉菌ST5数量也有较强的增加作用。芽孢杆菌BA1、BA2和BA3与链霉菌ST1、ST4和ST5在平板上对辣椒疫霉菌具有强抑制作用, 而假单胞菌PS1、PS2和PS3与鞘氨醇单胞菌SP1和SP2抑制作用较弱或者没有抑制作用(表3)。通过定殖复筛, 有效剔除了初筛菌株中的假性生物质炭介导生防菌, 进一步明确了生物质炭介导生防菌菌株。
2.4 生物质炭介导生防菌抑制辣椒疫霉的效果
图1a为在对照土壤和生物质炭土壤中添加各生防真菌对辣椒疫霉数量的影响。对照土壤中, 木霉菌、青霉菌和曲霉菌菌株均能显著减少辣椒疫霉数量, 菌株PE1和AS2效果最佳。在生物质炭土壤中, 木霉菌、青霉菌和曲霉菌菌株也均能显著减少辣椒疫霉数量, 木霉菌TR1和TR3、青霉菌PE1和曲霉菌AS2效果最佳。另外, 在无生防菌添加下, 施用1.33%生物质炭可显著减少18.44%辣椒疫霉数量。对照组和生物质炭组对比分析显示, 生物质炭组的TR1、TR3、AS1和AS2处理辣椒疫霉数量分别是对照组对应处理的75.6%、62.0%、70.8%和65.9%, 可见木霉菌TR1和TR3及曲霉菌AS1和AS2与生物质炭有协同抑制辣椒疫霉作用。
图1b为在对照土壤和生物质炭土壤中添加各生防细菌对辣椒疫霉数量的影响。在对照土壤中, 芽孢杆菌、假单胞菌和链霉菌菌株均能显著减少辣椒疫霉数量, 芽孢杆菌效果最佳, 其次是链霉菌, 鞘氨醇单胞菌对辣椒疫霉数量没有抑制作用。在生物质炭土壤中, 所有芽孢杆菌和链霉菌及两株假单胞菌(PS1和PS3)也均能显著减少辣椒疫霉数量, 芽孢杆菌 BA1、BA2、BA3和假单胞菌PS1效果最佳, 其次是链霉菌 ST1、ST4、ST5和假单胞菌PS3, 鞘氨醇单胞菌对辣椒疫霉数量没有抑制作用。另外, 在无生防菌添加下, 施用1.33%生物质炭可显著减少27.54%辣椒疫霉数量。对照组和生物质炭组对比分析显示, 芽孢杆菌BA1和BA2、假单胞菌PS1和PS3及链霉菌ST1在生物质炭存在时削减辣椒疫霉数量效果显著强于无生物质炭时, 生物质炭组的BA1、BA2、PS1、PS3和ST1处理辣椒疫霉数量分别是对照组对应处理的53.1%、66.0%、31.5%、64.4%和75.0%, 可见芽孢杆菌BA1和BA2、假单胞菌PS1和PS3及链霉菌ST1与生物质炭有协同抑制辣椒疫霉作用。
3 讨论
本研究再次证明生物质炭可有效防控辣椒疫病, 并且可显著降低土壤中辣椒疫霉数量。由此推测, 生物质炭降低土壤中病原菌数量可能是其防控辣椒疫病的直接原因。Jaiswal等[8]的研究显示生物质炭施用下番茄枯萎病病原菌()数量和发病率显著降低, 这与根际可培养木霉菌、荧光假单胞菌和放线菌等有益微生物数量增加有关。本研究中生物质炭能显著提高辣椒根际中的木霉菌、青霉菌、曲霉菌、芽孢杆菌、假单胞菌和鞘氨醇单胞菌等具有潜在生防作用的有益微生物数量, 这可能与辣椒疫霉数量削减有直接关系。多项研究也表明了施用生物质炭可增加土壤中木霉菌、芽孢杆菌、假单胞菌、链霉菌和鞘氨醇单胞菌等有益微生物数量[8,13-14,19,22]。木霉菌、芽孢杆菌、假单胞菌和链霉菌是应用广泛的常见生防菌, 能促进作物生长、产生抑制病原菌物质、诱导植物系统抗性并抑制土传病害, 且在辣椒疫病防控方面的报道也较多[23-26]。此外, 也有文献报道鞘氨醇单胞菌对作物生长具有促进作用[27]。
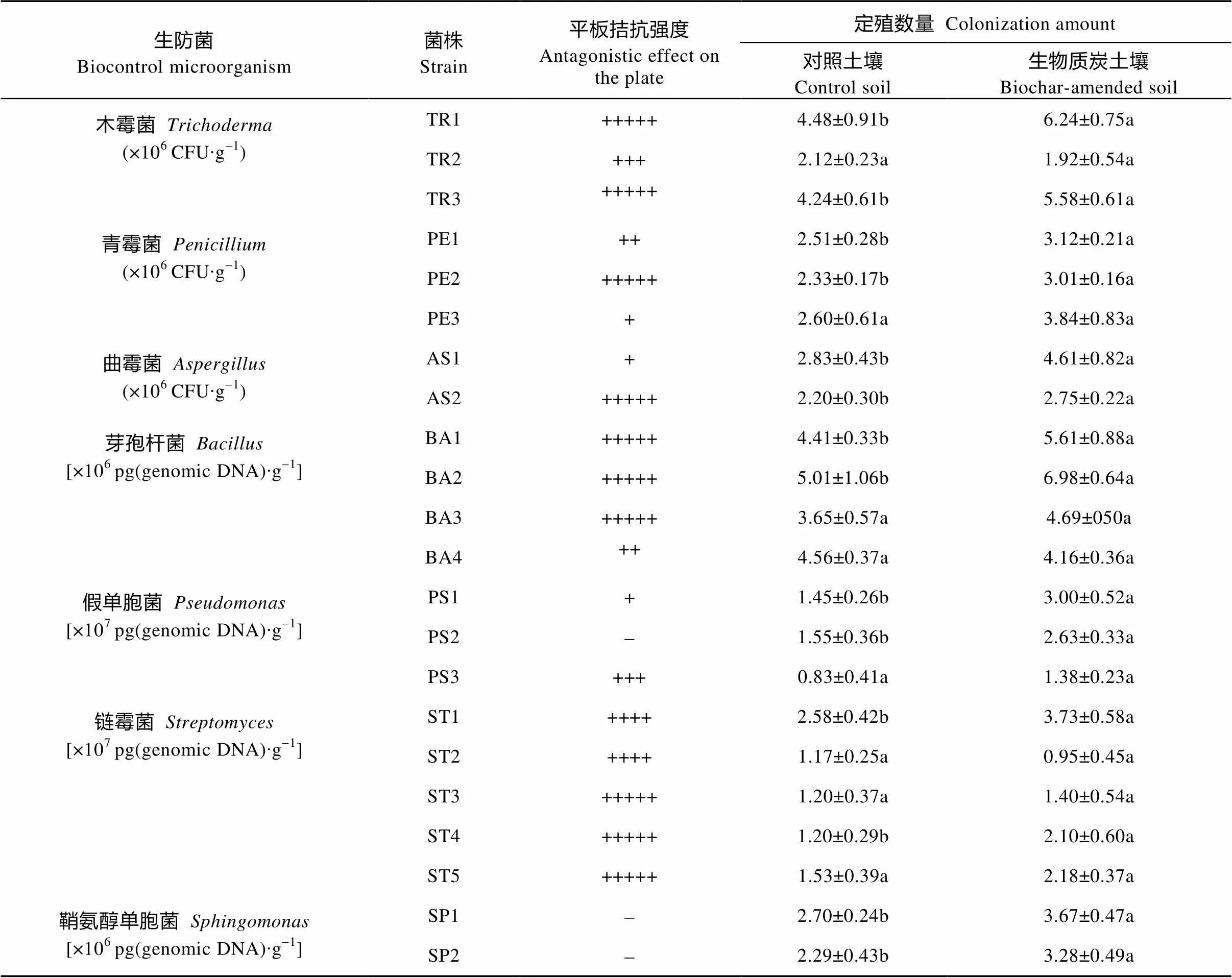
表3 生物质炭对辣椒根际土壤生防菌的定殖影响
真菌拮抗强度: +、++、+++、++++、+++++分别表示重寄生长度为0~4 mm、4~8 mm、8~12 mm、12~16 mm和>16 mm,-表示无重寄生现象。细菌拮抗强度: +、++、+++、++++、+++++分别表示抑菌圈直径0~3 mm、3~6 mm、6~9 mm、9~12 mm和>12 mm;-表示无抑菌圈。For antagonistic effect of fungal strains, +, ++, +++, ++++ and +++++ represent mycoparasitic lengths of 0-4 mm, 4-8 mm, 8-12 mm, 12-16 mm and > 16 mm, respectively.-represents no inhibition. For antagonistic effect of bacterial strains, +, ++, +++, ++++ and +++++ represent inhibition zone widths of 0-3 mm, 3-6 mm, 6-9 mm, 9-12 mm and > 12 mm, respectively.-represents no inhibition.
通过平板筛选初筛出可能被生物质炭富集的潜在生防菌菌株, 再通过定殖复筛剔除不能被生物质炭在辣椒根际中富集的假性生物质炭介导微生物, 明确可被生物质炭富集的潜在生防菌为18株木霉菌、青霉菌、曲霉菌、芽孢杆菌、假单胞菌、链霉菌和鞘氨醇单胞菌株。木霉菌可有效降解生物质炭有机成分[28], 链霉菌和鞘氨醇单胞菌可分泌相关酶降解生物质炭芳香组分[29-30], 这可能是木霉菌、链霉菌和鞘氨醇单胞菌在添加生物质炭土壤中得到增殖的原因。Kolton等[31]的研究也表明生物质炭可增加降解酚类和芳香族化合物的细菌种类, 例如放线菌科和鞘氨醇单胞菌科。青霉菌和曲霉菌与木霉菌同属一科, 也是较为常见的生防真菌[32-33], 也可能通过降解生物质炭组分进而得到增殖。
在生物质炭土壤和对照土壤中, 添加各介导生防真菌均能显著减少辣椒疫霉数量。生防真菌抑制疫霉数量效果与其平板抑制效果不一致。可见, 利用平板拮抗病原菌效果评价生防真菌效果具有较大的局限性。两株木霉菌株抑制辣椒疫霉数量最显著, 其次为青霉菌PE1与曲霉菌AS2和AS1。此外, 该5株菌株均可与生物质炭协同抑制辣椒疫霉数量。因此, 生物质炭介导的生防真菌在生物质炭存在下更能抑制辣椒疫霉数量。
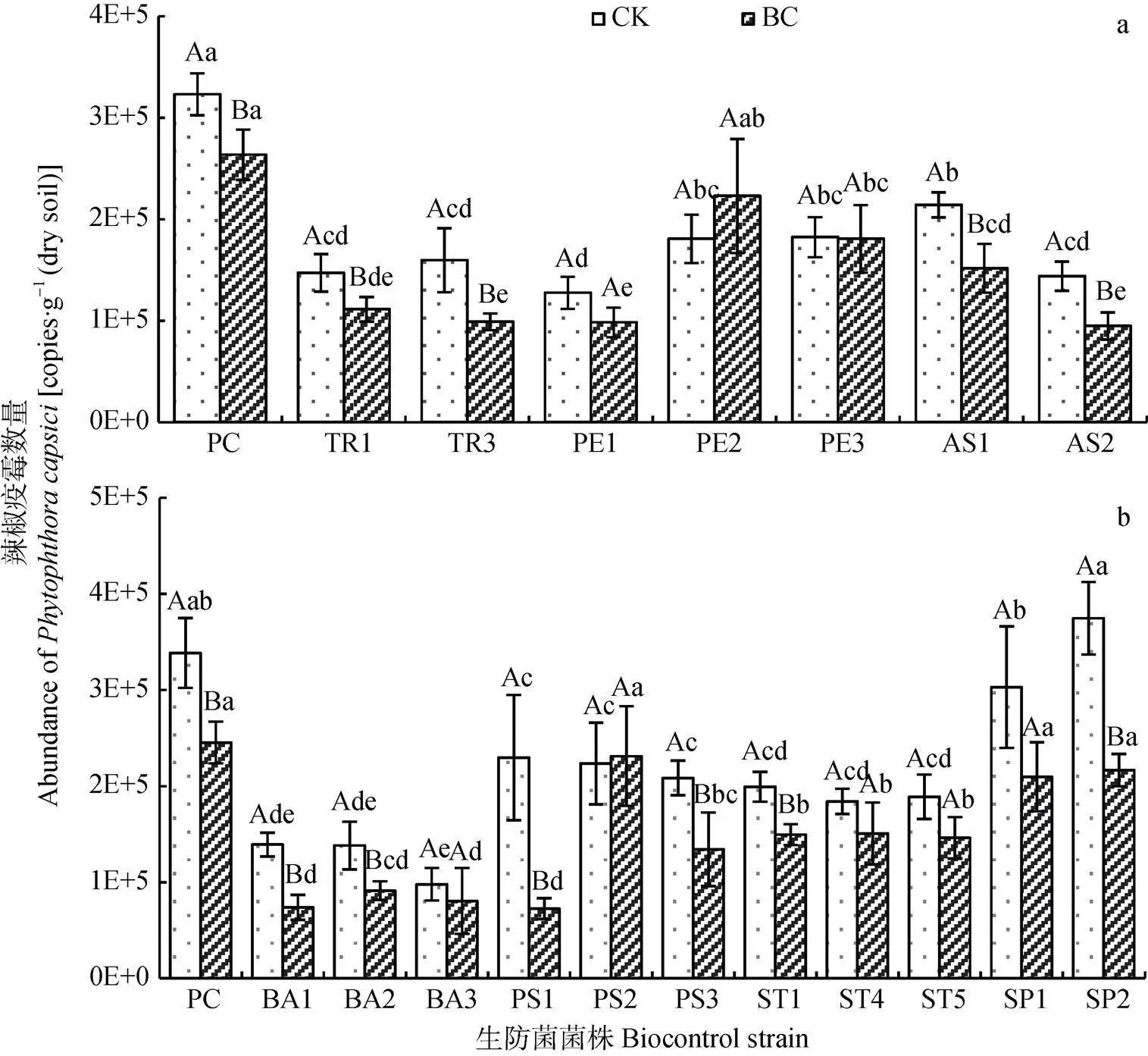
图1 土壤添加生防真菌(a)和细菌(b)对辣椒疫霉数量的影响
CK为未添加生物碳的空白对照土壤, BC为添加13.3 g∙kg-1生物质炭土壤; PC为无生防菌添加, TR1、TR3为木霉菌菌株, PE1、PE2、PE3为青霉菌菌株, AS1、AS2为曲霉菌菌株, BA1、BA2、BA3为芽孢杆菌菌株, PS1、PS2、PS3为假单胞菌菌株, ST1、ST4、ST5为链霉菌菌株, SP1、SP2为鞘氨醇单胞菌菌株。不同小写字母表示不同菌株处理间差异显著(<0.05)。不同大写字母表示同一菌株的空白对照与生物质炭添加处理差异显著(<0.05)。CK: control soil without biochar; BC: biochar-amended soil. PC: control without biocontrol agent.TR1 and TR3 arestrains; PE1, PE2 and PE3 arestrains; AS1 and AS2 arestrains; BA1, BA2 and BA3 arestrains; PS1, PS2 and PS3 arestrains; ST1, ST4 and ST5 arestrains; SP1 and SP2 arestrains. Different lowercase letters indicate significant differences among different strains at< 0.05. Different capital letters indicate significant differences between CK and BC at< 0.05.
生物质炭介导生防细菌方面, 芽孢杆菌、假单胞菌和链霉菌菌株在平板上均对辣椒疫霉有抑制作用。与之相符, Jaiswal等[34]的研究显示可被生物质炭富集的几株假单胞菌和芽孢杆菌菌株对黄瓜猝倒病病原菌()均有强平板拮抗作用。生防细菌菌株抑制辣椒疫霉数量效果与平板拮抗能力具有较高的吻合度, 在生物质炭土壤和对照土壤中, 芽孢杆菌、链霉菌和假单胞菌菌株抑制辣椒疫霉作用较强, 而鞘氨醇单胞菌菌株作用较弱或者无作用。另外, 生物质炭介导的生防细菌与生物质炭具有协同抑制辣椒疫霉数量作用, 主要表现在芽孢杆菌, 其次是链霉菌和假单胞菌。因此, 与生防真菌类似, 生物质炭介导的生防细菌在生物质炭存在下更能抑制辣椒疫霉数量。
生物质炭具有高度多孔性和较高比表面积, 可为细菌、放线菌和真菌的生存繁殖提供栖息地, 且利于微生物躲避土壤掠夺性动物的侵袭[2-3]。近年来, 多有研究以生物质炭作为功能菌载体以增强生物炭或功能菌的作用效果[23,35-36]。生物质炭吸附枯草芽孢杆菌SL-13可协同增强土壤肥力和植株促生长作用[37]。生物质炭联合有益菌菌液可协同增强土壤生物学性状改善效果, 有效减轻苹果连作障碍[38]。本研究中, 生物炭与其介导生防菌可协同增强抑制辣椒疫霉作用。因此, 我们推测将生物炭与介导生防菌等有效联合可研制出生防菌强化型炭基土壤改良剂, 在提高生防菌定殖量和时效性的基础上增强防病和改善土壤性状作用, 这值得深入研究。
4 结论
生物质炭防控辣椒疫病与其介导下的有益微生物具有密切关系。生物质炭富集的主要防病有益微生物是木霉菌、青霉菌、曲霉菌、芽孢杆菌、假单胞菌和链霉菌, 而对生物质炭防病贡献较大的为木霉菌、曲霉菌和芽孢杆菌。此外, 生物质炭介导生防微生物中, 与生物质炭具有协同抑制辣椒疫霉作用的主要是木霉菌、曲霉菌、芽孢杆菌、假单胞菌和链霉菌。将生物质炭与其介导生防菌同时施用以提高防病效果具有重大研究价值和应用前景。
[1] XIE T, REDDY K R, WANG C W, et al. Characteristics and applications of biochar for environmental remediation: A review[J]. Critical Reviews in Environmental Science and Technology, 2015, 45(9): 939–969
[2] KAVITHA B, REDDY P V L, KIM B, et al. Benefits and limitations of biochar amendment in agricultural soils: A review[J]. Journal of Environmental Management, 2018, 227: 146–154
[3] LAGHARI M, NAIDU R, XIAO B, et al. Recent developments in biochar as an effective tool for agricultural soil management: A review[J]. Journal of the Science of Food and Agriculture, 2016, 96(15): 4840–4849
[4] LUO S S, WANG S J, TIAN L, et al. Long-term biochar application influences soil microbial community and its potential roles in semiarid farmland[J]. Applied Soil Ecology, 2017, 117/118: 10–15
[5] JAISWAL A K, FRENKEL O, ELAD Y, et al. Non-monotonic influence of biochar dose on bean seedling growth and susceptibility to: The “Shifted Rmax-Effect”[J]. Plant and Soil, 2015, 395(1/2): 125–140
[6] BONANOMI G, LORITO M, VINALE F, et al. Organic amendments, beneficial microbes, and soil microbiota: Toward a unified framework for disease suppression[J]. Annual Review of Phytopathology, 2018, 56: 1–20
[7] ZHANG C S, LIN Y, TIAN X Y, et al. Tobacco bacterial wilt suppression with biochar soil addition associates to improved soil physiochemical properties and increased rhizosphere bacteria abundance[J]. Applied Soil Ecology, 2017, 112: 90–96
[8] JAISWAL A K, ELAD Y, PAUDEL I, et al. Linking the belowground microbial composition, diversity and activity to soilborne disease suppression and growth promotion of tomato amended with biochar[J]. Scientific Reports, 2017, 7: 44382
[9] FRENKEL O, JAISWAL A K, ELAD Y, et al. The effect of biochar on plant diseases: What should we learn while designing biochar substrates?[J]. Journal of Environmental Engineering and Landscape Management, 2017, 25(2): 105–113
[10] GRABER E R, FRENKEL O, JAISWAL A K, et al. How may biochar influence severity of diseases caused by soilborne pathogens?[J]. Carbon Management, 2014, 5(2): 169–183
[11] KUMAR A, ELAD Y, TSECHANSKY L, et al. Biochar potential in intensive cultivation ofL. (sweet pepper): Crop yield and plant protection[J]. Journal of the Science of Food and Agriculture, 2018, 98(2): 495–503
[12] 王光飞, 马艳, 郭德杰, 等. 不同用量秸秆生物炭对辣椒疫病防控效果及土壤性状的影响[J]. 土壤学报, 2017, 54(1): 204–215 WANG G F, MA Y, GUO D J, et al. Application-rate- dependent effects of straw biochar on control of Phytophthora blight of chilli pepper and soil properties[J]. Acta Pedologica Sinica, 2017, 54(1): 204–215
[13] VECSTAUDZA D, GRANTINA-IEVINA L, MAKARENKOVA G, et al. The impact of wood-derived biochar on the survival ofspp. and growth ofL. in sandy soil[J]. Biocontrol Science and Technology, 2018, 28(4): 341–358
[14] ELMER W H, PIGNATELLO J J. Effect of biochar amendments on mycorrhizal associations and Fusarium crown and root rot of asparagus in replant soils[J]. Plant Disease, 2011, 95(8): 960–966
[15] WANG Q J, MA Y, WANG G F, et al. Integration of biofumigation with antagonistic microorganism can control Phytophthora blight of pepper plants by regulating soil bacterial community structure[J]. European Journal of Soil Biology, 2014, 61: 58–67
[16] DRIGO B, VAN VEEN J A, KOWALCHUK G A. Specific rhizosphere bacterial and fungal groups respond differently to elevated atmospheric CO2[J]. The ISME Journal, 2009, 3(10): 1204–1217
[17] KETTLESON E, KUMAR S, REPONEN T, et al.,, andin home dust and air: Associations with moldiness and other home/family characteristics[J]. Indoor Air, 2013, 23(5): 387–396
[18] SHI S J, BENDING G D. Changes to the structure ofspp. communities associated with biodegradation of the herbicide isoproturon in soil[J]. FEMS Microbiology Letters, 2007, 269(1): 110–116
[19] GRABER E R, HAREL Y M, KOLTON M, et al. Biochar impact on development and productivity of pepper and tomato grown in fertigated soilless media[J]. Plant and Soil, 2010, 337(1/2): 481–496
[20] CONN K L, LECI E, KRITZMAN G, et al. A quantitative method for determining soil populations ofand differentiating potential potato scab-inducing strains[J]. Plant Disease, 1998, 82(6): 631–638
[21] YIM M S, YAU Y C W, MATLOW A, et al. A novel selective growth medium-PCR assay to isolate and detectin environmental samples[J]. Journal of Microbiological Methods, 2010, 82(1): 19–27
[22] PANDEY V, SHUKLA A, KUMAR J. Physiological and molecular signalling involved in disease management through: An effective biocontrol paradigm[M]//KUMAR P, KUMAR V, KUMAR A, et al. Current Trends in Plant Disease Diagnostics and Management Practices. Cham: Springer, 2016: 317–346
[23] 马云艳, 徐万里, 唐光木, 等. 生防链霉菌配施棉秆炭对连作棉田土壤微生物区系的影响[J]. 中国生态农业学报, 2017, 25(3): 400–409 MA Y Y, XU W L, TANG G M, et al. Effect of cotton stalk biochar application on soil microflora of continuous cotton cropping under use of antagonistic actinomycetes[J]. Chinese Journal of Eco-Agriculture, 2017, 25(3): 400–409
[24] SREEVIDYA M, GOPALAKRISHNAN S.andspp. as potential biocontrol agents to control soil-borne pathogens of Chickpea and Sorghum[J]. Acta Phytopathologica Sinica, 2013, 43(S1): 520
[25] SANG M K, KIM K D. Biocontrol activity and root colonization bystrains CCR04 and CCR80 against Phytophthora blight of pepper[J]. Biocontrol, 2014, 59(4): 437–448
[26] ZHANG M J, LI J L, SHEN A R, et al. Isolation and identification ofIBFCBF-1 with potential for biological control of Phytophthora blight and growth promotion of pepper[J]. Journal of Phytopathology, 2016, 164(11/12): 1012–1021
[27] SUKWEENADHI J, KIM Y J, KANG C H, et al.sp. nov., a plant growth- promoting bacterium isolated from soil of a ginseng field[J]. Archives of Microbiology, 2015, 197(8): 973–981
[28] ANYIKA C, MAJID Z A, IBRAHIM Z, et al. The impact of biochars on sorption and biodegradation of polycyclic aromatic hydrocarbons in soils — A review[J]. Environmental Science and Pollution Research, 2015, 22(5): 3314–3341
[29] KHODADAD C L M, ZIMMERMAN A R, GREEN S J, et al. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments[J]. Soil Biology and Biochemistry, 2011, 43(2): 385–392
[30] O'NEILL B, GROSSMAN J, TSAI M T, et al. Bacterial community composition in Brazilian Anthrosols and adjacent soils characterized using culturing and molecular identification[J]. Microbial Ecology, 2009, 58(1): 23–25
[31] KOLTON M, GRABER E R, TSEHANSKY L, et al. Biochar-stimulated plant performance is strongly linked to microbial diversity and metabolic potential in the rhizosphere[J]. New Phytologist, 2017, 213(3): 1393–1404
[32] LARENA I, VÁZQUEZ G, DE CAL A, et al. Ecophysiological requirements on growth and survival of the biocontrol agent212 in different sterile soils[J]. Applied Soil Ecology, 2014, 78: 18–27
[33] WANG H, ZHAO X H, LIU C Y, et al. Effects of the biocontrol agenton the soil microflora and soil enzymes in the rooting zone of pepper plants infected with[J]. Journal of Phytopathology, 2015, 163(7/8): 513–521
[34] JAISWAL A K, ELAD Y, CYTRYN E, et al. Activating biochar by manipulating the bacterial and fungal microbiome through pre-conditioning[J]. New Phytologist, 2018, 219(1): 363–377
[35] 戚鑫, 陈晓明, 肖诗琦, 等. 生物炭固定化微生物对U、Cd污染土壤的原位钝化修复[J]. 农业环境科学学报, 2018, 37(8): 1683–1689 QI X, CHEN X M, XIAO S Q, et al. In situ remediation of U- and Cd-contaminated soils by immobilized microorganisms and biochar[J]. Journal of Agro-Environment Science, 2018, 37(8): 1683–1689
[36] 袁敏, 刘晓冰, 唐美珍, 等. 生物炭固定菌强化人工湿地对低温污水中氮素去除的模拟研究[J]. 生态与农村环境学报, 2018, 34(5): 463–468YUAN M, LIU X B, TANG M Z, et al. Study on removal of nitrogen from low temperature sewage byWD-3 immobilized biochar in constructed wetland[J]. Journal of Ecology and Rural Environment, 2018, 34(5): 463–468
[37] TAO S Y, WU Z S, WEI M M, et al.SL-13 biochar formulation promotes pepper plant growth and soil improvement[J]. Canadian Journal of Microbiology, 2019, doi: 10.1139/cjm-2018-0333
[38] 孙琪然, 徐燕, 相立, 等. 生物炭和菌肥的混合使用对苹果园连作土壤环境及平邑甜茶幼苗生理指标的影响[J]. 中国农学通报, 2017, 33(8): 52–59SUN Q R, XU Y, XIANG L, et al. Effects of a mixture of bacterial manure and biochar on soil environment and physiological characteristics ofseedlings[J]. Chinese Agricultural Science Bulletin, 2017, 33(8): 52–59
Inhibitory effect of biochar-enriched biocontrol agents on*
WANG Guangfei1, MA Yan1**, GUO Dejie1, LUO Jia1, LIANG Yonghong2, QIU Meihua2
(1. Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences / Key Laboratory of Agro-Environment in Downstream of Yangtze Plain, Ministry of Agriculture, Nanjing 210014, China; 2. Jiangsu Province Station of Farmland Quality and Agro-Environmental Protection, Nanjing 210036, China)
Biochar is known to effectively control the Phytophthora blight of pepper. To further understand the mechanisms of biochar-mediated disease control, we screened the biochar-enriched beneficial microorganisms and evaluated their antagonistic activities against. A pot experiment was conducted to determine the effects of straw biochar on the control of Phytophthora blight. Both qPCR and dilution-plate methods were used to identify the biochar-enriched biocontrol microorganisms in rhizosphere soils. Potential antagonistic strains, which were biochar-enriched, were screened using the selective isolation method and rhizosphere colonization assay, after which their antagonistic activity againstin soil was determined. The results showed that biochar amendment could significantly reduce the abundance ofand severity of the Phytophthora blight of pepper by 95.1% and 91.1%, respectively. In addition, biochar amendment significantly increased the abundances of,,,,,andby 2.22, 4.09, 3.89, 2.45, 1.45, and 1.30 times, respectively. Twenty-two potential biocontrol strains that can be enriched by biochar were screened from biochar-amended rhizosphere soils using the selective isolation method. Comparing the colonization between the biochar-amended and control rhizosphere soils, two strains of, three strains of, two strains of, three strains of, three strains of, three strains of, and two strains ofwere confirmed to be enriched by biochar.(TR1 and TR3),(PE1),(AS1 and AS2),(BA1, BA2, and BA3),(PS1 and PS3),and(ST1, ST4, and ST5) strains could significantly reduce the abundance ofin the soil. Among these antagonistic stains,(TR1 and TR3),(AS1 and AS2),(BA1 and BA2),(PS1 and PS3), and(ST1) strainsin synergism with biochar facilitated a significant increase in the inhibition of. Thus,,,,, andenriched by biochar might play an import role in the suppression of Phytophthora blight of pepper under biochar amendment.
Biochar; Biocontrol fungi; Biocontrol bacteria;
, E-mail: myjaas@sina.com
Jan. 3, 2019;
Mar. 6, 2019
S154.3
2096-6237(2019)07-1015-09
10.13930/j.cnki.cjea.190009
王光飞, 马艳, 郭德杰, 罗佳, 梁永红, 仇美华. 生物质炭介导生防微生物抑制辣椒疫霉的作用[J]. 中国生态农业学报(中英文), 2019, 27(7): 1015-1023
WANG G F, MA Y, GUO D J, LUO J, LIANG Y H, QIU M H.Inhibitory effect of biochar-enriched biocontrol agents on[J]. Chinese Journal of Eco-Agriculture, 2019, 27(7): 1015-1023
* 国家重点研发计划项目(2018YFD0201208)、国家自然科学基金项目(31471949)和江苏省农业自主创新资金[CX(17)2025]资助
马艳, 主要研究方向为植物营养与生物资源利用。E-mail: myjaas@sina.com
王光飞, 主要研究方向为土壤微生物学。E-mail: wy_wgf@163.com
2019-01-03
2019-03-06
* This study was supported by the National Key Research and Development Project of China (2018YFD0201208), the National Natural Science Foundation of China (31471949) and the Funds for Independent Innovation of Agricultural Science and Technology in Jiangsu Province [CX(17)2025].


