诺丽自然发酵汁中醋酸菌的分离鉴定及发酵特性
梁丛颖,周 偏,张 琳,蔡 坤,刘四新,2,李从发,*
(1.海南大学食品科学与工程学院,海南 海口 570228;2.海南大学理学院,海南 海口 570228)
诺丽(Morinda citrifolia Linn.),又称海巴戟天,系茜草科巴戟天属植物,原产于太平洋岛屿、澳大利亚、东南亚以及我国的海南岛、西沙群岛等地[1]。早在2 000多年前,波利尼西亚土著居民就将诺丽作为民间药物用于治疗各种疾病,认为其对糖尿病、高血压、心脏病以及关节炎等疾病都有较好的预防和治疗作用[2-4]。研究表明,诺丽果中不仅含有多糖、维生素、有机酸、多种氨基酸、生物碱等[5-6]营养和功效成分,还含有丰富的矿物质,其含量占干物质10%~12%,主要包括镁、硫、钙和磷等[7]。近年来,随着人们生活水平的提高,诺丽的保健功能及药用价值逐渐得到人们的认可,受到研究者的青睐。诺丽发酵汁(诺丽酵素)作为市场上主要的产品形式,是一类新兴的功能性微生物发酵产品,其加工工艺主要是以传统自然发酵为主[8]。在整个发酵过程中,微生物(酵母菌、乳酸菌和醋酸菌等)通过吸收营养物质维持生命和增殖,并降解基质,使其发生一系列复杂的生物化学变化,导致发酵液成分发生改变,在一定程度上促进了风味和功能性化合物的合成[9]。
醋酸菌是一类重要的工业微生物,通常存在于自然发酵食品及饮料中,如传统发酵食品食醋、果醋、红茶菌、兰比可啤酒、开菲尔和可可豆等[10-14],同时醋酸菌在VC制造工业中也发挥着重要作用。近几年针对诺丽发酵汁的研究大多集中在其生物活性分析及活性物质解析方面[15-16],对于诺丽自然发酵过程中发酵汁中微生物群落的分析及优势微生物的分离鉴定相对滞后。Wall等[17]对夏威夷诺丽自然发酵过程中微生物变化研究发现,自然发酵至42 d时细菌数量达到峰值,且从发酵汁中分离出弗拉托葡糖杆菌(Gluconobacter frateurii)。施玮筑[18]对诺丽自然发酵过程中菌群结构及变化情况分析发现,醋酸菌为诺丽自然发酵过程中的优势菌(仅就细菌而言),对发酵产品的质地、口感、风味和颜色都有重要的影响。因此清楚醋酸菌的种类及发酵特性有助于合理控制发酵进程,更可以有效提高诺丽发酵汁的风味品质。16S rRNA在原核生物中广泛存在,功能稳定,其所携带的遗传信息可以有效的反应生物界的进化关系,同时操作简便,适用于各级分类单元,在系统分类学以及进化研究中有着重要的应用意义[19]。
本研究针对诺丽自然发酵汁中的醋酸菌进行筛选、分离纯化,并利用生理生化实验进行初步鉴定,16S rRNA同源序列分析,对比所获得的醋酸菌与工业菌株AS1.41的发酵特性,为醋酸菌的筛选提供较好的参考,以期得到性能优良的醋酸菌菌株,在丰富优质醋酸菌库的同时,为诺丽发酵汁品质的提高以及诺丽新产品开发等提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
诺丽果于2016年11月采摘自海南省万宁市;醋酸菌AS1.41(恶臭醋酸杆菌)来自广东微生物菌种保藏中心。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Tris-HCl、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA) 上海生物工程科技服务有限公司;苯酚、氯仿、异戊醇、琼脂糖 北京索莱宝科技有限公司;6×DNA loading buffer(含二甲苯菁和溴酚蓝双染料)、2×Es Taq Master Mix、D2000 DNA ladder、蛋白酶K北京康为世纪生物科技有限公司;Goldview DNA染料美国Amerco公司;其他试剂均为国产分析纯。
1.1.2 培养基
基础培养基:1.0%葡萄糖,1.0%酵母膏,pH值自然,121 ℃灭菌20 min,使用前加入3.0%(体积分数,下同)无水乙醇。
产酸定性培养基:同基础培养基,121 ℃灭菌20 min,冷却后加入5.0%乙醇。
分离和斜面保藏培养基:基础培养基加入2.0%琼脂,灭菌后加2.0%无菌CaCO3和3.0%乙醇,制成平板,即为分离培养基;基础培养基加入2.0%琼脂,分装于试管,灭菌后加入3.0%乙醇,摆成斜面,即为斜面保藏培养基。
发酵培养基:2%葡萄糖,1.0%酵母膏,0.5%蛋白胨,自然pH值,121 ℃灭菌20 min,使用前加入3.0%乙醇。
1.2 仪器与设备
SW-CJ净化工作台 苏州净化设备有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;DYY-8C型电泳仪 北京市六一仪器厂;Biofuge primo R高速冷冻离心机 赛默飞世尔科技有限公司;A300聚合酶链式反应(polymerase chain reaction,PCR)仪杭州郎基科学仪器有限公司;FA-1604电子天平 上海良平仪器仪表有限公司;LRH-250A生化培养箱 韶关市泰宏医疗器械有限公司;HH-4数显恒温水浴锅常州国华电器有限公司;ZHWY-211B恒温培养振荡器上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 诺丽自然发酵
选取新鲜成熟、无腐烂变质、无病虫害的诺丽果,清洗其表面,经无菌水洗涤并沥干后置于无菌容器内。置于阴暗处,室温(22~28 ℃)自然发酵2 个月。每隔6 d在无菌环境中取样备用。
1.3.2 菌株的富集培养
取诺丽自然发酵汁5 mL,装入含有100 mL基础培养基的三角瓶中,30 ℃、160 r/min培养2~3 d,即可得到初筛菌株富集培养液。
1.3.3 菌株的分离纯化
选取合适稀释度的富集培养液涂布于分离培养基平板上,于30 ℃条件下恒温培养2~3 d后观察,每个梯度3个重复。根据菌落形态特征及碳酸钙溶菌圈的大小挑取长势良好的单菌落。采用划线法进行分离纯化,通过革兰氏染色镜检初步确认是否为疑似醋酸菌菌株,接种于斜面保藏培养基,30 ℃培养2 d后于4 ℃的冰箱中保藏。
1.3.4 醋酸菌的定性实验
取培养2 d的醋酸产生菌及参照菌AS1.41进行生理生化实验,具体鉴定方法和依据参照《伯杰细菌鉴定手册》[20]。
1.3.5 醋酸菌的16S rRNA鉴定
醋酸菌基因组DNA的提取按照参考CTAB法[21-23]。
PCR扩增产物在1.0%琼脂糖凝胶上进行电泳后,置于紫外灯下观察,若出现清晰的条带,并且无明显非特异性扩增,即判断PCR成功。由上海英潍捷基有限公司完成测序工作。利用NCBI数据库,进行BLAST同源性对比分析,选择与目的基因序列同源性最高的序列,选取不同的模式菌株,采用MEGA7.0软件构建系统发育树。
1.3.6 醋酸菌发酵性能的测定
1.3.6.1 菌株生长曲线测定
将菌株挑取1 环接种于50 mL基础培养基中,30 ℃、160 r/min的摇床中培养,每隔6 h测定菌株的生长量。
1.3.6.2 菌株耐受性的测定
耐高温性能测定:将筛选鉴定出的所有醋酸菌活化后接入发酵培养基中,分别在28、31、34、37、40 ℃的条件下摇床培养72 h,转速160 r/min,每隔12 h测量菌株的生长量及产酸量,每株醋酸菌3 个重复。
耐乙醇性能测定:将筛选鉴定出的所有醋酸菌活化后接入发酵培养基中(乙醇体积分数分别为1%、3%、5%、7%、9%),在30 ℃、160 r/min的条件下摇床培养72 h,每隔12 h测定生长量和产酸量,每株醋酸菌3 个重复。
1.3.7 菌株生物量及产酸量的测定
生物量测定以OD600nm值表示;产酸量测定参照GB/T 12456—2008《食品中总酸的测定》[24],以乙酸计算总酸量。
2 结果与分析
2.1 醋酸菌的分离纯化
以诺丽自然发酵汁为样本,按照1.3.1、1.3.2节方法进行菌株富集培养和分离纯化,共得到67 株供试菌株。通过革兰氏染色镜检结果排除21 株革兰氏阳性菌株,见图1。从剩下的46 株菌种中挑选24 株进行生理生化试验,结果表明该24 株菌种均为过氧化氢酶阳性,且醋酸菌定性实验均有红褐色沉淀,为醋酸菌疑似菌株。

图1 菌株革兰氏染色镜检图Fig. 1 Microscopic pictures of Gram-stained bacterial strains
2.2 16S rRNA的鉴定
2.2.1 菌株DNA的提取及PCR扩增结果
将初步筛选出的醋酸菌进行DNA提取及PCR扩增,其扩增后的部分电泳结果如图2所示。
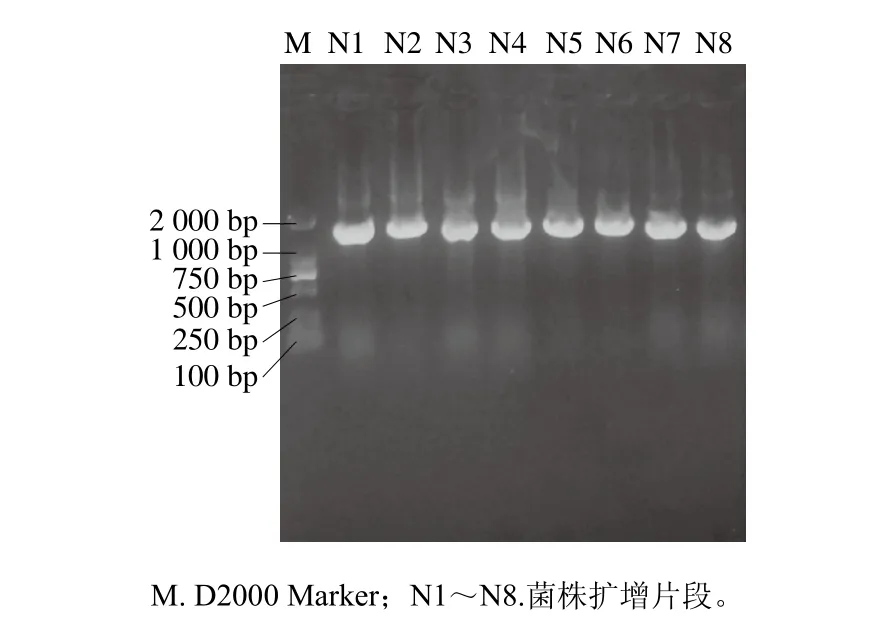
图2 菌株16S rRNA PCR扩增产物的琼脂糖凝胶电泳图Fig. 2 Agarose gel electrophoresis of 16S rRNA PCR amplification products from suspicious strains of acetic acid bacteria
由图2可知,所有醋酸菌疑似菌株16S rRNA的PCR扩增产物的片段大小均在1 500 bp左右,且扩增条带非常清晰明亮可见,无明显非特异性扩增,故该PCR产物可满足后续实验要求。
2.2.2 16S rRNA 序列同源分析鉴定利用NCBI数据库,将筛选和鉴定的菌株的16S rDNA序列进行BLAST分析,选择准确率在98%及以上的分析结果作为鉴定结果。本实验根据鉴定菌株的16S rRNA基因序列同源分析,成功鉴定出24 株醋酸菌,分别编号为N1~N24,如表1所示。从诺丽发酵汁中共鉴定出醋酸杆菌属(Acetobacter)和葡糖杆菌属(Gluconobacter)两大类,包括可可豆醋酸杆菌A. fabarum(9 株)、蒲桃醋酸杆菌A. syzygii(7 株)、巴氏醋酸杆菌A. pasteurianus(2 株)、热带醋酸杆菌A. tropicalis(1 株)、兰比可醋酸杆菌A. lambici(1 株)、日本葡糖杆菌G. japonicus(4 株)6 个种,可见诺丽发酵汁中醋酸菌的丰富多样性。其中A. lambici及A. tropicalis主要存在于发酵初始阶段,A. pasteurianus则在发酵2 周之后才出现,主要存在于发酵中期,而A. fabarum、A. syzygii、G. japonicus在整个自然发酵过程中均有发现,且A. fabarum和A. syzygii分别占菌株总数的37.5%和29.2%,表明A. syzygii和A. fabarum为诺丽自然发酵过程中的主要优势醋酸菌。

表1 16S rRNA序列同源分析鉴定Table 1 Identification of isolates based on 16S rRNA sequencing
曹艳花等[25]从诺丽原浆中分离得到A. fabarum CICC10883,发现其能利用葡萄糖和D-木糖发酵产酸。张欣等[26]从诺丽发酵果原浆中首次分离到1 株东方醋酸杆菌(A. orientalis)CICC10881。施玮筑[18]从诺丽自然发酵汁中得到13 个醋酸菌分离物,但未进行明确的种属鉴定。因此,本研究筛选出的A. fabarum、A. lambici均为首次在诺丽自然发酵汁中分离获得。
2.2.3 系统发育树的构建
选取代表菌株及其相似菌种,采用MEGA7.0软件进行序列分析,构建系统发育树,显示各菌株的分类学地位和系统发育关系,结果如图3所示。

图3 醋酸菌的16S rRNA基因系统发育树Fig. 3 Phylogenetic tree of acetobacter acid bacteria based on their 16S rDNA sequences
由图3可知,代表菌株在系统发育树中基本分为6 个分支:N21与A. tropicalis A77和A. tropicalis Y-1BM处于同一分支;N11与G. japonicus NBRC3271和G. japonicus HD1025为一个分支;N4与A. pasteurianus NBRC3248处于同一分支;N17与A. fabarum G2-5为一个分支;N10与A. lambici LMG27439为一个分支;N5与A. syzygii NBRC16604和A. syzygii 9H-2为一个分支。上述结果已用Bootstrap检验1 000 次随机重复验证支持该分支。综合代表菌株生理生化实验和系统发育树分析结果,可确定其代表菌株中,N21为A. tropicalis,N11为G. japonicus,N4为A. pasteurianus,N17为A. fabarum,N10为A. lambici,N5为A. syzygii,与16S rRNA序列比对分析结果一致。
2.3 醋酸菌的发酵特性
2.3.1 菌株的生长曲线
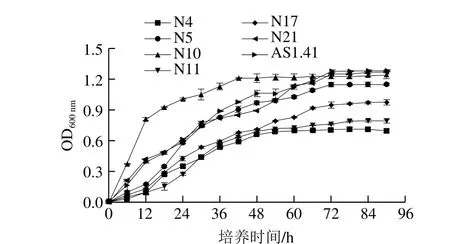
图4 醋酸菌生长曲线Fig. 4 Growth curves of acetic acid bacteria
由图4可知,7 株醋酸菌的生长曲线相似,N4、N10和N11对数期为6~48 h,其他菌株的对数生长期均在6~66 h。其中,N10生长速率最快,在12 h时OD600nm值达到0.810,N21和参照菌株AS1.41生长速率次之且生长量最高,其次是N5、N17、N11和N4,说明菌株N10和N21相比于其他菌株更加适应该条件。处于对数生长期的菌种活力最强,对外界环境因素较为敏感,代谢活跃,繁殖能力强,此阶段接种可使菌体活性达到最高[27],因此选取各菌株种子液培养时间为48 h。
2.3.2 菌株的耐高温性能
不同种属的醋酸菌具有不同的最适温度。在一定的温度范围内,温度的上升有利于醋酸菌的生长及产酸代谢,但温度过高会加快菌体老化,降低产酸速率,导致菌体内酶结构的破坏和酶活性的丧失,甚至直接死亡[28]。由图5可知,7 株醋酸菌在28~40 ℃的温度范围内均能生长,且生长量和产酸量随着温度的上升呈现先增加后下降的趋势。N11、N17分别在28、31 ℃时生长量和产酸量最高,而N4、N5和AS1.41的最适生长温度为34 ℃。当培养温度在28~34 ℃范围时,N4、N5、N10、N17、N21和AS1.41的生长量和产酸量变化较小,而菌株N11相对敏感。温度为31 ℃时,菌株N21的产酸量在各菌株中最高,达到28.92 g/L;当温度升至40 ℃时,7 个菌株均能维持一定程度的生长,但只有N21和参照菌株AS1.41依然保持较好的产酸性能,产酸量分别为14.85 g/L和16.21 g/L。表明在高温条件下N21依然具有较高的乙醇利用率。

图5 温度对7 株菌OD600 nm(A)和产酸量(B)的影响Fig. 5 Effect of temperature on OD600 nm (A) and acetic acid production (B) of seven strains
Soemphol等[29]对从泰国水果中分离出的A. tropicalis SKU1100研究发现,SKU1100具有高耐热性,在40 ℃以上的高温条件下仍可以较好生长。此外,将热带醋酸杆菌应用于罗非鱼养殖过程中,可以促进罗非鱼生长,提高罗非鱼的消化酶和血清非特异性免疫活性,并对净化水体水质方面有积极作用[30]。因此推断,将实验筛选出的A. tropicalis应用于诺丽及其他食品发酵中,可能会对其助消化、提高免疫力等功能特性有积极影响,为开发特定保健功能的新产品提供新的思路。
2.3.3 菌株的耐乙醇性能
醋酸菌主要依靠氧化乙醇形成醋酸,但高体积分数乙醇会抑制醋酸菌生长,使得乙醇转化率和产酸速率下降,从而影响醋酸产量[31]。由图6可知,随着初始乙醇体积分数的增加,各菌株生长量基本呈下降趋势,产酸量均呈先增加后减小趋势;各醋酸菌基本上在乙醇体积分数为1%时生长量最大,乙醇体积分数为3%产酸量最高,表明低体积分数乙醇会限制醋酸菌的产酸量。当乙醇体积分数增加到7%时,菌株N4和N5基本停止生长,N11、N17、N21和AS1.41的生长有所抑制,但OD600nm值均能达到0.650以上,且只有N21和参照菌株AS1.41能维持较高的产酸效率,产酸量达到23.60 g/L,略高于参照菌株AS1.41(22.77 g/L)。
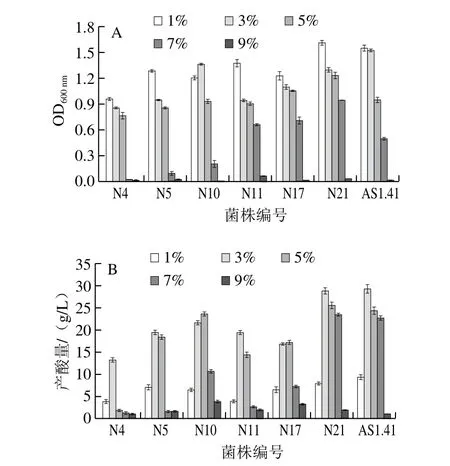
图6 乙醇体积分数对7 株菌OD600 nm(A)和产酸量(B)的影响Fig. 6 Effect of ethanol concentration on OD600 nm (A) and acid production (B) of seven strains
对比国内外其他研究,李大为等[32]从自然发酵苹果醋中筛选鉴定出耐受性较高的A. tropicalis B104,产酸量达33.2 g/L,耐乙醇体积分数为7%,与本实验研究结果相一致。张志燕等[33]对镇江香醋醋醅中的优势醋酸菌进行了筛选和分离鉴定,得到8 株醋酸菌,其中醋酸菌D-3-4可耐受体积分数9%乙醇以及42 ℃高温,且产酸量达到60 g/L,为优势高产酸菌株。卢梦瑶等[34]从多种水果酵素中分离出1 株较高产醋酸菌株芝庇侬醋酸杆菌(A. cibinongensis)LMY-1,在乙醇体积分数4%时其产酸最高达到22.72 g/L,本研究筛选出的菌种N21(A.tropicalis)其产酸量高于LMY-1。
3 结 论
本研究采用传统分离培养方法从诺丽自然发酵汁中分离鉴定出67 株菌。综合传统形态培养特征、生理生化实验和16S rRNA基因序列分析同源性分析,最终鉴定出24 株醋酸菌,分别为A. fabarum(9 株)、A. syzygii(7 株)、A. pasteurianus(2 株)、A. tropicalis(1 株)、A. lambici(1 株)和G. japonicus(4 株),可见诺丽发酵汁中醋酸菌的丰富多样性,A. fabarum和A. syzygii分别占菌株总数的37.5%和29.2%,为诺丽发酵汁中的主要优势醋酸菌种。在菌株发酵特性对比研究中,不同醋酸菌株对温度和乙醇的耐受性差异显著,A. tropicalis N21在乙醇体积分数为3%时产酸量最高,达到28.92 g/L,在40 ℃高温中仍能良好生长且产酸量为14.85 g/L,在体积分数为7%时,产酸量依然达到23.60 g/L,具有良好的生长特性和发酵产酸能力,且耐温及耐乙醇特性优于其他5 株醋酸菌,可考虑作为优势醋酸菌株,用于诺丽纯种发酵。
本实验全面研究了诺丽自然发酵过程中醋酸菌的多样性及分布,不仅丰富了诺丽中醋酸菌种属信息,同时为诺丽发酵汁传统工艺的改善及诺丽发酵产品的开发利用提供一定理论基础。但由于在诺丽发酵汁中关于醋酸菌的研究尚少,其在诺丽发酵过程中的作用和功能以及在诺丽发酵汁中的功效性成分的产生方面是否发挥一定的作用,还有待于进一步研究。

