蓝圆鲹酸/碱等电点沉淀法分离蛋白凝胶特性与消化特性
孙乐常,林怡晨,刘伟锋,翁 凌,张凌晶,刘光明,曹敏杰,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021;3.福建省海洋功能食品工程技术研究中心,福建 厦门 361021)
蓝圆鲹(Decapterus maruadsi),鲈形目(Perciformes),鲹科(Carangidae),系暖水性中上层鱼类,在中国、日本、朝鲜等国家周边海域均有分布[1]。据统计,2016年蓝圆鲹全国捕捞量总计达60.09万 t,其中福建省捕捞量为27.67万 t,居全国首位,且历年产量趋于稳定,具有很好的开发利用前景[2]。目前,蓝圆鲹除鲜食外,主要被加工成鱼干、鱼露或腌制品等低值产品,其精深加工产品比例较低[3]。另一方面,由于过度捕捞与气候环境变化,全球的海洋鱼类资源日益匮乏,一些传统鱼糜原料鱼类产量,如鳕鱼、鳗鱼、马鲛鱼等,已呈现出逐年下降的趋势,与当前我国鱼糜制品需求量不断攀升形成鲜明反差,寻找一种新的鱼糜制品原料已成为沿海地区鱼糜企业亟待解决的问题之一。价格低廉、产量稳定的蓝圆鲹有望成为理想的鱼糜制品新原料[4]。传统鱼糜加工过程中,往往需要通过漂洗以去除鱼肉中的油脂、血液以及水溶性蛋白酶,从而达到增白、提高鱼糜凝胶强度的目的。然而,漂洗同时也导致了大量水溶性蛋白流失,造成优质蛋白的严重浪费。
等电点沉淀技术是基于蛋白质在不同pH值的溶解特性衍生出的蛋白质分离技术。最初该分离技术广泛应用于植物蛋白的分离与制备,能高效提取大豆分离蛋白且保持其生物活性[5]。相比于传统鱼糜制品加工过程中的鱼肉漂洗法,该方法在回收小型低值海洋鱼类蛋白方面具有以下优势:鱼蛋白的回收率显著提高;可以有效去除鱼肌肉中的脂肪成分,防止因油脂氧化而导致的鱼糜品质下降[6]。因此,等电点沉淀法也渐渐应用于水产蛋白资源的开发与利用。目前的报道多集中于斑点叉尾鮰(Ictalurus punctatus)[7]、石首鱼(Micropogon undulatus)[8]、罗非鱼(Oreochromis niloticus)[9]、鲢鱼(Hypophthalmichthys molitrix)[10]、沙丁鱼(Sardinella gibosa)[11]、鳕鱼(Gadus morhua)[12]、鲱鱼(Clupea harengus)[13]等少数鱼类。以上研究发现,鱼类的等电点沉淀分离蛋白所表现出的蛋白构象变化与凝胶特性不仅与pH值相关,也呈现出明显的鱼种差异性。等电点沉淀分离蛋白在经历酸或碱性pH值变化时,会发生一系列构象的展开与折叠,这些变化可能会使其分子的结构、构象、物理化学特性等发生改变,并最终影响蛋白质的功能特性,如凝胶性、乳化性等[14]。此外,蛋白质构象的改变还可能影响其在人体内的消化与吸收,进而改变蛋白的营养价值。然而迄今为止,鱼分离蛋白在等电点沉淀过程中结构变化规律和内在分子机制,以及分离蛋白在人体内的消化性变化仍未阐明[6]。
本研究拟以蓝圆鲹为原材料,采用等电点沉淀法制备肌肉分离蛋白,优化蛋白质分离的条件,并系统比较分析酸法与碱法回收等电点沉淀分离蛋白的凝胶与消化特性,旨在为等电点沉淀技术在蓝圆鲹分离蛋白中的应用及其工业化生产提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
冰鲜蓝圆鲹(均质量约150 g/尾)购于福建省厦门市集美菜市场。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)用标准蛋白 美国Thermo Fisher Scientific公司;猪胃蛋白酶(250 U/mg)、猪胰蛋白酶(1 500 U/mg)美国Sigma公司;氨基酸混合标准品H型 日本Wako公司;邻苯二甲醛(o-phthaldialdehyde,OPA)、9-芴甲基氯甲酸酯(9-fluorenylmethyl chloroformate,FMOC)美国Agilent公司。其他试剂均为国产分析纯。
1.2 仪器与设备
PT-2100 E组织捣碎机 瑞士Kinematica公司;UB-7pH计、MA35M-000230V1水分测定仪 德国Sartorius公司;ATN-300全自动凯氏定氮仪 上海洪纪设备有限公司;GF-1260高效液相色谱仪 美国Agilent公司;Mini-PROTEAN蛋白质电泳装置 美国Bio-Rad公司;G:BOX凝胶成像仪 英国Syngene公司;TA.new plus质构仪 美国Isenso公司;DHR-2流变仪 美国TA仪器公司;Stephan UMC 5真空斩拌机 美国Stephan Machinery公司;E-1010离子溅射仪、S-480扫描电子显微镜 日本日立制造所;Samdri-PVT-3D临界点干燥仪美国Tousimis公司。
1.3 方法
1.3.1 分离蛋白的制备
无特殊说明,所有操作均在4 ℃进行。新鲜蓝圆鲹去皮采肉后,加入4 倍体积冰水用组织捣碎机充分捣碎。得到的肉浆用1 mol/L的NaOH或HCl溶液调节pH值至10.0~11.5或1.5~3.0,经过10 min的磁力搅拌(300 r/min)后,8 000×g离心10 min,小心去除表层白色漂浮状物,并收集上清液组分,用1 mol/L的HCl溶液或NaOH溶液调节pH值至4.5~6.0,搅拌10 min后经过8 000×g离心10 min,收集沉淀部分,并加入一定量的NaHCO3调节pH值至7.0,即为分离蛋白。其中,利用在碱性pH值条件下溶解制备得到的分离蛋白为碱法分离蛋白(alkaline aided protein isolate,KPI),酸性pH值溶解制备得到的分离蛋白为酸法分离蛋白(acid aided protein isolate,API)。蓝圆鲹采后的肌肉组分即为实验中所用全蛋白(total protein,TP),肌原纤维蛋白(myofibrillar protein,MP)的制备则参考Rawdkuen等[15]的方法。得到的4 种蛋白均放置于保鲜密封口袋中,于冰上保存,并在24 h内使用。
1.3.2 理化指标测定
利用水分自动测定仪测定水分含量,加热温度为160 ℃。脂肪、灰分以及粗蛋白含量测定参考Sun Lechang等[16]的方法进行测定,均以干质量计。
1.3.3 氨基酸成分分析
蓝圆鲹分离蛋白的氨基酸成分分析参考孙莎[17]的方法进行。准确称取0.01 g的蛋白质样品,置于10 mm×100 mm真空消化管中,加入1 mL的6 mol/L HCl溶液,120 ℃油浴24 h。消化结束后用1 mol/L NaOH溶液调节pH值至中性。色谱条件:Eclipse-AAA色谱柱(4.6 mm×150 mm,5 μm);检测器:波长338 nm(OPA-氨基酸)和262 nm(FMOC-氨基酸);A相为40 mmol/L Na2HPO4(pH 7.8);B相为乙腈-甲醇-水(45∶45∶10,V/V);进样量0.5 μL;流速2 mL/min;柱温箱40 ℃。
1.3.4 SDS-PAGE分析
参照Laemmli[18]方法对分离蛋白进行分析。将分离蛋白加入2 倍体积的蛋白质溶解液,95 ℃加热20 min。蛋白质溶解液:20 mmol/L Tris-HCl(pH 8.0)含1% SDS,8 mol/L尿素,体积分数2% β-巯基乙醇。
1.3.5 消化特性分析
1.3.5.1 体外模拟胃肠液消化
为探究4 种蛋白热处理后的消化特性,分别将4 组蛋白以1∶4(g/mL)与纯水均质混匀,经90 ℃加热30 min后用于该部分实验。
模拟胃液(simulated gastric fluid,SGF)参照文献[19]的方法,配制质量浓度为2 g/L的NaCl溶液,并用HCl调节pH值至1.2。体外SGF消化参考万楚君等[20]的方法,并做适当修改。整个SGF消化的总反应体系为3 mL,胃蛋白酶与蛋白的比例为1∶100(m/m)。取1.5 mL SGF加入试管中,于37 ℃预热15 min,再与加热处理后的蛋白样品混匀,随后加入胃蛋白酶,于37 ℃水浴锅中振荡反应0、5、10、30、60、120 min。在达到反应时间后,取出200 μL反应液于1.5 mL离心管中,加入60 μL 0.2 mol/L Na2CO3终止反应。对照组的反应除不加蛋白酶外,步骤与样品组一致。
模拟肠液(simulated intestinal fluid,SIF)参照文献[19]配制50 mmol/L磷酸盐缓冲液(pH 7.5)。SIF消化实验参考万楚君等[20]的方法并作适当修改,其总反应体系为3 mL,猪胰蛋白酶与蛋白的比例为1∶600(m/m)。在试管中加入1.5 mL SIF于37 ℃预热15 min,再将加热处理后的蛋白加入试管中混匀,于37 ℃水浴锅中振荡反应0、5、10、30、60、120 min。达到反应时间后,取出200 μL反应液于1.5 mL离心管中,95 ℃加热10 min终止反应。对照组的反应除不加蛋白酶外,步骤与样品组一致。
蛋白的体外模拟胃肠液消化(连续消化)实验,SGF与SIF同上述一致。主要步骤如下:200 μL样品在经过120 min SGF消化后,迅速加入60 μL 0.2 mol/L Na2CO3调pH值为7.0后,再加入200 μL预热的SIF与猪胰蛋白酶,于37 ℃水浴振荡反应120 min,随后置于95 ℃加热10 min灭活,即得到模拟胃肠液消化样品。
1.3.5.2 酶解样品中可溶性肽含量测定
采用三氯乙酸(trichloroacetic acid,TCA)可溶性肽含量测定法评价蛋白的体外模拟消化效果。在得到的消化样品中加入30% TCA使其最终为5%,继续补加5% TCA定容至1 mL,经充分的振荡混匀后,8 000×g离心10 min,取上清液部分。上清液中可溶性肽含量根据Lowry法[21]进行测定,以酪氨酸(Tyr)为标准,以每克蛋白释放的Tyr物质的量表示(μmol/g)[22]。
1.3.6 凝胶特性分析
1.3.6.1 分离蛋白鱼糜凝胶的制备
参考Klomklao等[22]的方法进行制备。用冰水调节蓝圆鲹分离蛋白的含水量至85%,其后放入真空斩拌机中低温空擂10 min,再加入分离蛋白质量分数2%的NaCl继续斩拌10 min。将擂溃后的样品分为两部分:一部分装于圆柱形模具(直径3.5 cm,高4.5 cm)中,两端密封扎紧,用于凝胶质构测定实验;另一部分用于动态流变学分析。分离蛋白鱼糜凝胶化采用2 种加热方式,一种是正常凝胶化加热(kamaboko组),即40 ℃加热30 min后90 ℃加热30 min;另一种是模拟凝胶劣化加热(modori组),即55 ℃加热30 min后90 ℃加热30 min。加热后获得的凝胶样品立刻置于冰水混合物中迅速冷却并于4 ℃过夜后待测凝胶强度。
1.3.6.2 动态流变学分析
参考Abdollahi等[23]的方法对蓝圆鲹分离蛋白的流变学特性进行研究。采用40 mm平行铝板,取上述流变待测样品(1.5~2 g),均匀平铺在测试平台上,除去周围过量的样品,在四周裸露部分涂上少量的石蜡密封,避免水分蒸发。具体参数如下:样品间隙1.5 mm,应变为1%,扫描频率为1 Hz,扫描温度为10~90 ℃,扫描速率2 ℃/min。
1.3.6.3 凝胶强度测定
参考Weng Wuyin等[24]的方法利用质构仪测定鱼糜凝胶样品的凝胶强度。测定前将样品切成高为3 cm左右的圆柱体。质构分析具体参数:探头为5 mm直径球形探头,测试速率0.5 mm/s,触发力5 g,形变程度50%。数据分析曲线上的第1个峰值即为破断力,其对应的穿刺距离即为破断距离。按下式计算凝胶强度:
凝胶强度/(N·mm)= B×D
式中:B为鱼糜制品的破断力/N;D为鱼糜制品的破断距离/mm。
1.3.6.4 微观结构分析
参考Weng Wuyiin等[24]的方法,利用扫描电子显微镜观察鱼糜样品的微观结构。先将样品切成2~3 mm的小块,用固定液(2.5%戊二醛,0.1 mol/L PBS,pH 7.2)在4 ℃条件下浸泡24 h后,用pH 7.2、0.1 mol/L PBS缓冲液漂洗3 次,再进行体积分数30%~100%乙醇溶液梯度脱水,CO2临界干燥后将样品通过导电胶固定值样品台上。经E-1010离子溅射仪镀金后,在10 kV的加速电压下观察鱼糜样品的微观结构。
1.4 数据分析
所有实验均至少重复3 次以上。采用Microsoft Excel 2013软件进行数据处理求平均值、偏差;采用SPSS 17.0软件进行显著性差异分析(Duncan多重检验,P<0.05,差异显著)。
2 结果与分析
2.1 酸/碱等电点沉淀法制备分离蛋白的条件优化

图1 pH值对蓝圆鲹蛋白溶解性与回收率的影响Fig. 1 Effect of pH on the solubility and recovery yield of blue round scad protein
本研究中,蓝圆鲹肌肉蛋白在pH 1.5~12.0范围内的溶解度呈现出典型的U型溶解曲线,蛋白质在酸/碱两端的溶解度最高,如图1a所示。其中,在酸性pH值范围内,肌肉蛋白溶解度在pH 2.0以后趋于稳定,pH 2.0时溶解度达到最高值,蛋白质量浓度达0.52 mg/mL,溶解度为81.2%;在碱性pH值范围内,肌肉蛋白溶解度在pH 10.0以后逐渐趋向稳定,蛋白质量浓度达0.63 mg/mL,溶解度可达95%以上,显著高于酸性pH值。此外,肌肉蛋白在pH 4.5~5.5范围内的溶解度较低,当pH值为5.5时达到最低值(10.2%)。Undeland等[13]研究了鲱鱼白色肉在不同pH值范围的溶解度时发现,肌肉蛋白在pH值小于4.0或大于11.0时均能有90%以上的溶解度,蛋白在pH 5.5~6.0时的溶解度最小,类似结果还见于斑点叉尾鮰[7]、石首鱼[8]、鲤鱼[25]、罗非鱼[9]等,以上结果与本研究中蓝圆鲹肌肉蛋白在不同pH值条件下的溶解性变化规律一致。
由于蛋白在pH 11.0处的溶解度与pH 12.0相差不大,基于实际应用中原料与成本考虑,选择pH 11.0为本次实验碱法制备分离蛋白的最优溶解pH值。在此基础上,本研究选取最优的pH 2.0与pH 11.0的蛋白质溶解条件,并观察等电点沉淀pH值下的分离蛋白回收率情况,结果如图1b所示。通过酸法与碱法溶解的蛋白溶液,在沉淀pH值为5.5时等电点沉淀得到的分离蛋白回收率均最高,分别为65.0%与84.6%,且碱法溶解的分离蛋白回收率显著高于酸法溶解的,这可能与肌肉蛋白本身在酸性pH值下的溶解较低有关。Kristinsson等[7]发现斑点叉尾鮰与石首鱼[8]肌肉蛋白在酸法等电点沉淀的回收率高于碱法等电点沉淀。而罗非鱼[9]以及欧洲鳗鲡(Anguilla anguilla)[26]肌肉蛋白在碱法等电点沉淀下的回收率则高于酸法。本研究的结果与Tian Yuanyong等[25]对鲤鱼肌肉蛋白的回收率研究结果一致。酸/碱等电点沉淀的回收率与鱼的种类、肌肉蛋白的类型和含量有着明显地相关性。
2.2 理化指标测定结果

表1 蓝圆鲹分离蛋白理化指标Table 1 Proximate composition of blue round scad protein isolates%
由表1可知,蓝圆鲹全肉的粗蛋白、脂肪与灰分的质量分数分别为79.6%、13.0%、5.8%,与陈晓婷等[3]对蓝圆鲹肌肉组成分析的结果接近。迴游性海洋鱼类肌肉的脂肪中含有大量的不饱和脂肪酸,在加工与贮藏过程往往会发生脂肪过氧化现象,导致鱼肉品质的下降。因此,在制备分离蛋白时,分离蛋白中脂肪的脱除率也是评价分离方法实际应用效果的重要指标之一[27]。与TP相比,MP与等电点沉淀(API/KPI)均可有效降低鱼肉中的脂肪与灰分含量,其中KPI去除脂肪效果最佳,脱除率达到59.2%。碱法等电点沉淀在脱脂上优于酸法在其他鱼类肌肉蛋白回收中亦有报道,如:彩虹鲑鱼(Oncorhynchus mykiss)[27]、石首鱼[8]、斑点叉尾鮰[7]等,推测其可能是由于油脂与碱发生皂化,生成的脂肪酸盐在离心后会浮于上清液表层从而能被轻易去除。此外,相比于API(80.5%),KPI(87.1%)的粗蛋白质量分数也显著高于TP(79.6%)和MP(77.9%),表明碱法等电点沉淀技术更适用于蓝圆鲹肌肉蛋白分离。
2.3 SDS-PAGE分析
鱼类肌肉蛋白按其溶解特性可分为水溶性的肌浆蛋白、盐溶性的MP以及不溶性的基质蛋白,肌浆蛋白与MP分别占总蛋白的20%~50%与50%~70%,基质蛋白含量最低,在10%以下[28]。利用SDS-PAGE对得到的4 种蛋白(TP、MP、API与KPI)的蛋白组成进行分析,如图2所示,4 种分离蛋白的主要蛋白组成接近,包括肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白(actin,AC)、肌钙蛋白T(troponin-T,TN-T)以及原肌球蛋白(tropomyosin,TM),且MHC含量都是最高。但与其他3 组分离蛋白(TP、AP、KPI)不同,MP组在40~150 kDa区间的蛋白条带明显比较少,这可能由于等电点沉淀法回收了水溶性和盐溶性的蛋白,而MP制备过程水溶性蛋白被除去。Rawdkuen等[15]对比罗非鱼肌肉不同分离蛋白时得到类似的实验结果。此外,API组在150~200 kDa区间出现了较多的降解片段,推测其原因可能是MHC在酸性pH值下发生了部分降解,这种现象与Tian Yuanyong等[25]研究鲤鱼肌肉分离蛋白的结果一致。
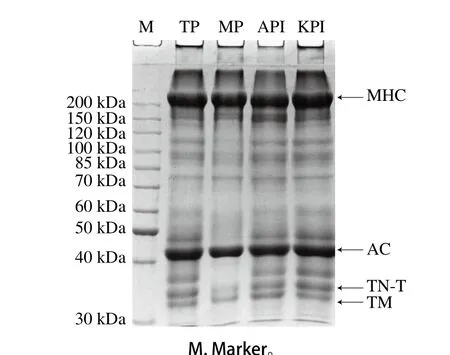
图2 蓝圆鲹鱼肉分离蛋白的SDS-PAGEFig. 2 SDS-PAGE patterns of blue round scad protein isolates
2.4 氨基酸成分分析

表2 蓝圆鲹分离蛋白氨基酸含量分析Table 2 Amino acid conposition of blue round scad protein isolates%
为进一步比较分离蛋白的营养价值变化情况,对其进行氨基酸组成分析,如表2所示。4 组分离蛋白的氨基酸组成基本一致,蛋白中的谷氨酸盐(谷氨酸+谷氨酰胺,Glu+Gln)含量最高,其次为天冬氨酸盐(天冬氨酸+天冬酰胺,Asp+Asn)、亮氨酸(Leu)与赖氨酸(Lys)。除色氨酸因为盐酸水解被完全破坏未检出外,蓝圆鲹肌肉4 组蛋白的必需氨基酸与总氨基酸比例均高于40%,满足FAO/WHO推荐的理想蛋白模式,属于优质蛋白,这个结果与杨伊然等[29]对蓝圆鲹鱼肉蛋白氨基酸分析结果一致。
此外,API与KPI的甘氨酸(Gly)与脯氨酸(Pro)含量明显低于TP与MP(P<0.05),其原因可能由于大部分基质蛋白在酸或碱性条件下溶解性较低,可通过离心去除。而甘氨酸与脯氨酸是基质蛋白的主要组成氨基酸,因此在API与KPI中的含量较低。本研究的结果与Tian Yuanyong等[25]的研究结果相一致。
2.5 凝胶特性分析

图3 蓝圆鲹分离蛋白凝胶强度Fig. 3 Gel strength of blue round scad protein isolates
如图3所示,在kamaboko组,凝胶强度由高至低分别为MP(63.6 N·mm)>TP(23.5 N·mm)>API(12.4 N·mm)>KPI(2.1 N·mm)。相比之下,经过55 ℃模拟凝胶劣化加热后,4 组蛋白的凝胶强度由高至低分别为MP(24.5 N·mm)>API(10.3 N·mm)>TP(3.8 N·mm)>KPI(1.9 N·mm),低于kamaboko组中相应鱼糜制品的凝胶强度,这可能与内源性蛋白酶导致的凝胶劣化有关[30-31]。此外,kamaboko组和modori组中API和KPI均表现比MP低的凝胶强度,特别是KPI的凝胶强度最弱,可能是由于KPI相比于MP含有更多的水溶性蛋白酶[32]。API组在2 种加热方式所测定的凝胶强度并无明显差别,表明内源性蛋白酶在酸法等电点沉淀过程发生了不可逆变性失活。
如图4所示,除API组外,TP、MP和KPI在50~55 ℃出现储能模量(G’)下降的趋势,表明发生了凝胶劣化现象,这与55 ℃加热条件下3 组蛋白鱼糜凝胶强度的下降相吻合。从55 ℃开始,TP、MP和KPI的储能模量出现明显的上升趋势,暗示着发生了典型的鱼糜凝胶化现象[33]。API组没有表现明显的凝胶化和凝胶劣化现象,推测可能在酸法等电点沉淀过程中肌肉蛋白发生了剧烈的蛋白变性现象,导致包括肌球蛋白发生了不可逆变性,从而失去热凝胶能力。有研究指出鱼糜凝胶的形成是由于内部的蛋白质分子间或分子内通过二硫键、氢键、疏水互作等作用力发生交联,从而形成了三维网络结构,而在加热前已经变性的蛋白质则无交联能力,进而无法形成凝胶[34]。肌球蛋白作为鱼糜凝胶形成的关键蛋白,它的变性程度对鱼糜的凝胶形成起着决定性作用。Kristinsson等[12]研究发现在低pH值下肌球蛋白会发生完全的解离,而在pH 11.0下则能够保持相对较高的结构完整性;Park等[11]研究沙丁鱼肌球蛋白在不同pH值条件下的变化中发现,沙丁鱼肌球蛋白在pH 2.0溶解后,再将pH值调回中性会发生完全的蛋白变性,进而导致蛋白的凝胶形成能力显著下降。这些报道与本研究中所做的推测相符。此外,酸性条件不仅使肌球蛋白发生变性,还会使其他内源性蛋白酶变性失活[16],这可能是API在2 种加热方式下凝胶强度并未明显差异的原因。

图4 蓝圆鲹鱼肉分离蛋白流变学分析Fig. 4 Rheological analysis of blue round scad protein isolates


图5 蓝圆鲹鱼肉分离蛋白凝胶微观结构Fig. 5 Microstructure of blue round scad protein isolates
如图5所示,kamaboko组中TP与MP凝胶表层更加致密,这与其内源性谷氨酰胺转氨酶的交联作用有关。刘海梅[35]发现添加了微生物谷氨酰胺氨酶(MTGase)的鲢鱼鱼糜微观结构比未添加的对照组更致密平整。Abdollahi等[10]在研究黑海小鲱鱼(Clupeonella cultriventris)与鲢鱼肌肉分离蛋白凝胶特性时,亦得到与本研究类似的微观结构。此外,扫描电子显微镜中使用的发射电子束强度大小也可能影响凝胶微观形态表征情况,如使用20.0 kV的电子束可以观测到沙丁鱼鱼糜的多孔状凝胶结构[36],而使用了10.0 kV或15.0 kV观测时,则很难看到鲢鱼鱼糜凝胶的网孔状结构[35]。
另一方面,KPI、TP与MP在modori组得到的凝胶结构与kamaboko组相比,更加疏松多孔,这可能与KPI、TP与MP中能存在的内源性蛋白酶有关。该结果与本研究中各组蛋白的质构及流变学分析的结果一致。
2.6 蓝圆鲹分离蛋白的消化特性分析
蛋白质结构的改变可能引起酶解特性的变化,在食物中则反映在蛋白质的消化特性上。本研究将制备的2 种分离蛋白(API和KPI)与TP以及MP进行了90 ℃的热处理,通过体外模拟胃肠液消化实验对其消化特性进行比较分析。如图6所示,胃蛋白酶对于4 种加热蛋白的酶解活性从高到低依次为MP>KPI>API>TP,其在胃蛋白酶水解120 min时释放的可溶性肽含量分别为267.4、207.9、189.7、19.4 μmol/g,MP的消化性最好,KPI与API的消化性略低于MP,TP则表现出强烈的耐消化性。相比之下,4 种加热蛋白都能较好地被胰蛋白酶酶解,其酶解活性从高到低依次为MP>TP>API>KPI,这可能与胰蛋白酶较多的底物催化位点有关。通过连续模拟体外胃肠液消化,结果显示MP、KPI与API的蛋白消化性明显优于TP。综合蛋白的回收率,本研究所制备的分离蛋白KPI与API有回收率高、消化性好的特点,具有良好的应用前景。

图6 蓝圆鲹分离蛋白消化稳定性Fig. 6 Digestibility of blue round scad protein isolates
3 结 论
本研究通过酸/碱等电点沉淀技术从蓝圆鲹肌肉中制备得到了2 种分离蛋白。结果表明,分离蛋白在氨基酸组成上与TP和MP并无显著差异,这意味着分离蛋白在提高回收率的同时,其营养价值并未改变。此外,API、KPI的凝胶强度均发生明显下降,但其各自诱因不同。酸分离蛋白是由于发生了较强烈的变性现象,故而失去热凝胶的形成能力。相比之下,碱分离蛋白的变性程度较低,但与此同时也保留了更高的内源性蛋白酶的活力,这可能与碱分离蛋白回收了大部分的水溶性蛋白有关。体外模拟胃肠液消化实验表明,API、KPI与TP相比,具有更好的消化性,更易被人体消化吸收,这也说明蓝圆鲹分离蛋白可作为一种较理想的蛋白配料应用于食品工业之中。

