植物糖原负载提高姜黄素溶解度
王 攀,樊金玲*,杨亚培,张 月
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
姜黄素(curcumin,CCM)是从姜黄、莪术、郁金等姜黄属植物中提取的一种多酚类化合物[1],是国内外允许使用的天然食用黄色素。同时,CCM具有多种生理和药理活性,如抑菌、抗肿瘤、抗人类免疫缺陷病毒作用、抗纤维化作用等[1-2],耐热性好、安全性高(12 g/d的剂量下对人体无明显毒副作用)[3]。但CCM的水溶性很低(11 ng/mL、25 ℃)[4],导致其在体内的吸收率差、生物利用率低[5],在水溶性基质的食品和药品等相关领域的应用也因此受到极大限制。因此,提高CCM的水溶性是开发其潜在应用价值的关键所在。
目前,提高CCM溶解度的方法包括基于脂质体、胶束、纳米乳液、无定形固体分散体、对CCM进行化学修饰、形成复合物等多种技术或体系,载体材料包括天然聚合物(碳水化合物、蛋白质和脂肪)以及人工合成的聚合物[6-9]。但是,上述方法多数不易适用于食品,例如:脂质体制备需要大量的表面活性剂;大多数天然高分子需要修饰,合成的聚合物通常生物相容性低。另外还存在制备过程复杂、成本较高等问题[7]。
植物糖原(phytoglycogen,PG)是由α-1,4和α-1,6糖苷键连接的、高度支化的可溶性α-D-葡聚糖[10],由于平均链长短、分支度高,同时具有外紧内松的树枝状分支模式以及粒径小等结构特征[11],使其分子表面存在大量的葡萄糖残基,可与水分子形成氢键,易溶于冷水[12]。研究表明,PG不含有簇状结构,而是形成比支链淀粉分支更多、更短、结构更加紧密的球形结构,是一种天然的纳米粒[13]。研究人员以PG负载叶黄素和槲皮素,显著提高了叶黄素的表观溶解度(0.56 μg/mL提高至130.65 μg/mL)和槲皮素溶解度(4.32 μg/mL提高至241.76 μg/mL)[11,14]。
PG具有良好的分散稳定性。以PG为载体,将一定量高浓度的CCM乙醇溶液加入一定浓度的PG溶液中,使得体系中CCM为过饱和状态。部分游离的CCM分子与PG相互作用,形成PG-CCM复合物,提高CCM的表观溶解度。此方法具有制备简单、不添加任何表面活性剂、体系安全无毒等优点。本实验着重研究PG、CCM、体系pH值和离子质量浓度对CCM表观溶解度、负载能力、负载效率的影响;并采用动态激光光散射法研究复合物的粒径分布,通过透射电镜进行形貌观察,并通过傅里叶变换红外光谱、荧光光谱、差示扫描量热分析对PG与CCM的相互作用、负载前后CCM存在微环境及存在状态的变化进行研究。
1 材料与方法
1.1 材料与试剂
加强型甜玉米“中甜8号” 北京金农科种子科技有限公司;姜黄素C1386 美国Sigma公司;磷钨酸(分析纯) 天津市科密欧化学试剂有限公司;普通碳支持膜 中镜科仪(北京)膜科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;H2050高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Nano-ZS90激光粒度仪 马尔文仪器有限公司;TENSPOR27傅里叶变换红外光谱仪 德国Bruker仪器公司;DSC1型差示扫描量热仪 瑞士Mettler-Toledo公司;JEM-2100透射电子显微镜 日本电子公司;G9800A荧光光谱仪 美国Aglient Cary Eclipse公司;JYL-0020铝坩埚 上海菁仪化工材料有限公司。
1.3 方法
1.3.1 PG提取
参照文献[15-16]的提取方法作适当修改。取“中甜8号”玉米样品(100 g),于高速粉碎机中粉碎20 s,至样品呈粗燕麦粉大小;加入去离子水(400 g),搅拌均匀后,于4 ℃冰箱中浸提4 h;浸提物用270 目孔筛过滤,收集滤液;滤渣加入去离子水(400 g)浸提并过滤,此过程重复2 次,合并滤液(约1 200 mL)。用1 mol/L的盐酸调节pH值至4.8,于4 ℃冰箱中静置2 h;5 000×g离心30 min,以除去沉淀的蛋白。收集上清液,于4 ℃冰箱中静置24 h,5 000×g离心30 min,以除去沉淀的淀粉。收集上清液,用1 mol/L的氢氧化钠溶液调节pH值至7;121 ℃高温处理20 min(有絮状物生成),冷却至室温,10 000×g离心20 min,去除变性沉淀的蛋白。取上清液,加3 倍体积的乙醇沉淀PG;布氏漏斗抽滤,收集滤纸上的PG。将其悬浮于一定体积的乙醇中,抽滤,去除溶解于乙醇的小分子糖和呈色物质,重复3 次。将纯化后的PG放置在通风橱中以除去残余的乙醇,得到PG固体粉末,平均提取率为10.4%,采用3,5-二硝基水杨酸法[17]测定PG中还原糖质量分数为0.71%,采用考马斯亮蓝法[18]测定PG中蛋白质质量分数为0.12%。
1.3.2 PG负载CCM
精确称取一定量的PG,将其溶于去离子水,配制出指定质量浓度的PG溶液;精确称取一定量的CCM,将其溶于无水乙醇中,配制出指定质量浓度的CCM乙醇溶液。取4.95 mL的PG溶液,加入0.05 mL的CCM溶液,于摇床中振荡平衡(200 r/min,30 min);10 000×g离心15 min,弃去不溶性的CCM沉淀,清液即为PG-CCM复合物负载溶液。将上述负载溶液冻干成粉,置于干燥器中,于4 ℃冰箱中保存,备用。
1.3.3 影响CCM表观溶解度的因素
1.3.3.1 PG质量浓度对CCM表观溶解度的影响
分别配制质量浓度为1、2、4、6、8、10、20、30、40、50 mg/mL的PG溶液,按1.3.2节方法负载CCM。其中,CCM乙醇溶液质量浓度为4 mg/mL,PG溶液pH值为7,硫酸铵质量浓度为0 mg/mL。
1.3.3.2 CCM质量浓度对CCM表观溶解度的影响
分别配制质量浓度为0.5、1、2、3、4、5 mg/mL的CCM乙醇溶液,按1.3.2节方法负载CCM。其中,PG溶液质量浓度为50 mg/mL,PG溶液pH值为7,硫酸铵质量浓度为0 mg/mL。
1.3.3.3 pH值对CCM表观溶解度的影响
分别配制pH 2、3、4、5、6、7的溶液(用0.01、1 mol/L的NaOH和HCl调节pH值);用上述溶液配制质量浓度为50 mg/mL的PG溶液,再使用HCl溶液对不同pH值的PG溶液进行微量缓慢调节,至溶液pH值分别为2、3、4、5、6、7;按1.3.2节方法负载CCM。其中,CCM乙醇溶液质量浓度为4 mg/mL,PG质量浓度为50 mg/mL,硫酸铵质量浓度为0 mg/mL。
1.3.3.4 盐离子质量浓度对CCM表观溶解度的影响
配制质量浓度为0、100、200、300、400、500 mg/mL的硫酸铵溶液。用上述溶液配制质量浓度为50 mg/mL的PG溶液,按1.3.2节方法负载CCM。其中,CCM乙醇溶液质量浓度为4 mg/mL,PG质量浓度为50 mg/mL,PG溶液pH值为7。
1.3.4 CCM的测定
1.3.4.1 标准曲线的绘制
用80%的乙醇溶液分别配制0.5、1、1.7、2.5、4、5.5、7 µg/mL的CCM标准溶液,分别测出各溶液在425 nm波长处的吸光度,以CCM质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线。CCM质量浓度在0~7 μg/mL的范围内,CCM质量浓度与吸光度呈良好的线性关系,线性回归方程为y=0.172 1x+0.013 7(R2=0.999 7),即适用于PG负载中关于CCM含量的计算。
1.3.4.2 样品的测定
取PG-CCM复合物负载溶液1 mL,加入4 mL无水乙醇,离心(10 000×g,15 min)。收集上清液,以80%乙醇溶液为空白,于425 nm波长处测定吸光度。
按公式(1)~(3)分别计算样品对CCM的表观溶解度、负载能力和负载效率[7]:

1.3.5 PG-CCM复合物纳米粒的粒径分布
取1.3.2节所得PG-CCM复合物负载溶液(其中PG的质量浓度分别为10、20、30、40 mg/mL和50 mg/mL),分别用蒸馏水稀释,使PG终质量浓度均为2 mg/mL;旋涡振荡混匀,采用ZS90型动态光散射激光粒度仪测定粒径分布和电位[16]。
1.3.6 透射电镜分析
将PG-CCM复合物溶解在0.02 mol/L NaAc缓冲液(pH 5.5)中,配制约为0.1 mg/mL PG-CCM复合物溶液;取1 滴配制好的复合物溶液滴在碳涂层上,待干燥后,重复2 次;将1 滴15 mg/mL磷钨酸滴至制好的样品的铜网上,2 min后,用剪成尖角的滤纸吸去染色液,所有样品在室温干燥过夜(12 h)进行透射电镜图像处理[7,19]。
1.3.7 荧光光谱分析
采用稳态荧光光谱仪分别检测CCM溶液和PG-CCM复合物负载溶液的荧光光谱[20-21]。设定激发波长为420 nm,狭缝宽度为10 nm,仪器采样间隔为1 nm,扫描波长范围为450~650 nm。采用荧光光谱仪分别检测CCM溶液和PG-CCM溶液的荧光光谱。配制质量浓度分别为0、0.5、1、1.5、2 mg/mL PG溶液;取10 mL上述溶液,加2 mg/mL CCM乙醇溶液(体系中CCM终浓度为5 μmol/L);混匀,作用2 min后进行荧光光谱扫描。为消除植物糖原的拉曼峰以及其他散射现象对荧光造成的干扰,实验同时记录了不同浓度PG溶液的荧光光谱(即10 mL不同浓度PG溶液加入无水乙醇的荧光光谱);将其作为对照,从各样品的光谱中减去,从而得到样品的荧光光谱,以抵消拉曼峰和其他散射产物所造成的干扰。
1.3.8 衰减全反射傅里叶变换红外光谱分析
精确称取CCM、PG、PG和CCM物理混合物、PG-CCM复合物负载物各1~2 mg,将样品分别与KBr粉末(约100 mg)在玛瑙研钵中充分研磨均匀,用压片机进行压片处理,将不加样的KBr压片(约100 mg)为空白背景,扫描范围500~4 000 cm-1,分辨率为2 cm-1,样品光谱为扫描32 次所得[7]。
1.3.9 差示扫描量热分析
采用差示扫描量热仪研究CCM与PG反应前后的晶体状态是否发生改变。精确称取CCM、PG、PG和CCM物理混合物、PG-CCM复合物负载物各25.0 mg,密封于铝制坩埚中;20 ℃等温保持1 min后,以10 ℃/min的速率升温至250 ℃,氮气吹扫速率为50 mL/min,空盘作为参比盘(空白),记录差示扫描量热曲线[7]。
1.4 数据统计及图像处理
所有实验重复3 次,结果取平均值;用DPS分析各组结果间的差异显著性(P<0.05);结果以 ±s表示;用Origin 8.5软件进行作图。
2 结果与分析
2.1 PG负载提高CCM的表观溶解度因素优化
PG易于在冷水中分散、溶解,以PG为载体负载CCM形成PG-CCM复合物,可提高CCM的表观溶解度,冻干后的PG-CCM复合物易复溶于冷水,如图1所示。

图1 PG-CCM溶液(A)以及PG-CCM复溶溶液(B)Fig. 1 PG-CCM solution (A) and reconstituted PG-CCM solution (B)
2.1.1 PG质量浓度对负载的影响

图2 PG质量浓度对负载的影响Fig. 2 Effect of PG concentration on loading efficiency
如图2所示,随着PG质量浓度增加,CCM的表观溶解度显著提高;PG对CCM的负载效率也随PG浓度增大而显著增加,而负载能力则随PG质量浓度的增大而显著降低。当PG质量浓度从1 mg/mL提高至10 mg/mL时,CCM的表观溶解度呈快速增长的趋势,从8.32 µg/mL提高到18.68 µg/mL;负载效率则从20.79%增至46.70%,负载能力从8.40 µg/mg快速降至1.89 µg/mg。继续提高PG质量浓度至50 mg/mL,CCM的表观溶解度持续提高至29.49 µg/mL,负载效率持续提高至71.59%,负载能力不断下降至0.58 µg/mg。
2.1.2 CCM质量浓度对负载的影响

图3 CCM质量浓度对负载的影响Fig. 3 Effect of CCM concentration on loading efficiency
CCM在无水乙醇中的溶解度较低,大于5 mg/mL质量浓度的溶液不易制备。如图3所示,在0.5~4 mg/mL质量浓度范围内,随着CCM质量浓度增大,CCM的表观溶解度和负载能力提高了约7 倍;而负载效率降低了12%。继续提高CCM质量浓度至5 mg/mL,CCM的表观溶解度、负载能力无显著变化。
2.1.3 pH值对负载的影响

图4 pH值对负载的影响Fig. 4 Effect of pH on loading efficiency
如图4所示,随着pH值由2提高至5,CCM的表观溶解度、负载能力、负载效率逐渐下降至最低点。当pH值由5提高至7,CCM的表观溶解度、负载能力、负载效率大幅提高达到最大值,分别为29.66 µg/mL、0.58 µg/mg和71.59%。据报道,姜黄素在酸性条件下稳定,在中性至碱性pH值条件下易降解[22]。因此,pH 7有利于PG负载CCM。
2.1.4 硫酸铵质量浓度对负载的影响

图5 硫酸铵质量浓度对负载的影响Fig. 5 Effect of ammonium sulfate concentration on loading efficiency
如图5所示,质量浓度0~200 mg/mL的硫酸铵对CCM表观溶解度、负载能力、负载效率无显著影响;当硫酸铵质量浓度大于200 mg/mL时,随着质量浓度增大,CCM表观溶解度、负载能力、负载效率显著下降;当硫酸铵质量浓度为500 mg/mL时,上述3 个参数分别为7.55 µg/mL、0.15 µg/mg、18.88%。前期实验数据表示:质量浓度为10~500 mg/mL的硫酸铵对PG的溶解度无影响,与文献[13]报道一致;对姜黄素本身的溶解度也无影响。推测硫酸铵质量浓度影响PG与CCM间的互相作用力。
Kaminaga等[4]报道了CCM在水中的表观溶解度为11 ng/mL(25 ℃)。Li Jinglei等[7]报道了10 mg/mL可溶性淀粉负载CCM,CCM的表观溶解度提高至6.32 μg/mL。Yu Hailong[23]和Ye Fayin[24]等分别报道了10 mg/mL疏水改性淀粉和辛烯基琥珀酸玉米糊精胶束包封CCM,使其表观溶解度分别提高到18.4 μg/mL和4.44 μg/mL。Tapal等[21]报道了10 mg/mL大豆蛋白分离物与CCM形成复合物,将CCM的表观溶解度提高到8.9 μg/mL。本研究中,10 mg/mL PG溶液中CCM的表观溶解度为18.68 µg/mL,CCM表观溶解度提高了近1 700 倍。CCM的表观溶解度除与载体浓度有关外,还取决于载体在水中的溶解度。PG极易溶于冷水,且溶液黏度很低。如将10 mg/mL PG-CCM复合物冻干粉复溶到PG质量浓度200 mg/mL时,CCM的表观溶解度可达到366 µg/mL,提高近33 000 倍。以上分析表明:与已有报道相比,PG是一种高效的载体,可显著提高CCM表观溶解度。
2.2 PG-CCM复合物的结构表征
2.2.1 PG-CCM复合物的粒径分布
如图6和表1所示,PG的平均粒径为70~75 nm;负载CCM后,粒径无显著变化;不同质量浓度PG-CCM复合物的粒径也无显著不同。本研究在证实PG一种天然存在的纳米粒[25]的同时,也表明了PG-CCM复合物的粒径主要分布在70~75 nm。复合物粒径的聚合物分散性指数(polymer dispersity index,PDI)值约为0.14左右(<0.2),电位为0 mV左右,彼此无显著性差异,表明PG-CCM复合物粒径分布均匀、呈电中性。

图6 PG、PG-CCM复合物(50 mg/mL)的粒径分布Fig. 6 Particle size distribution of PG and PG-CCM complex(50 mg/mL) in aqueous solution

表1 PG-CCM复合物的粒径分布和电位Table 1 Particle size, PDI and zeta potential of PG-CCM complex
2.2.2 透射电子显微镜分析

图7 PG(A)、PG-CCM复合物(B)的透射电子显微镜图Fig. 7 Transmission electron microcopy (TEM) images of PG (A) and PG-CCM complex (B)
如图7所示,PG表现为分布均匀、表面光滑的球形结构;直径在20~40 nm范围内,小于采用动态激光光散射法方法测定的平均粒径(70~75 nm)。采用透射电子显微镜测定样品时,样品需做干燥处理,样品分子会发生脱水,因此测得的粒径通常小于采用激光粒度仪测定的溶液状态下水化分子的粒径[26]。PG粒径的相关报道较多,但测定结果存在较大差异。如Huang Lei[12]和Bi Lin[15]等采用透射电子显微镜测定PG纳米粒的粒径结果与本研究相接近,远小于Bhunia[27]和Scheffler[19]等的测定结果。糖原提取方法不同可能是造成粒径差异的主要原因。玉米籽粒中的糖原可能与蛋白相结合,表现为较大的粒径;提取过程中除去蛋白后,则粒径减小。本研究提取PG时采用了高温处理使大量的蛋白性变性沉淀,后用离心的方法加以除去,糖原样品的蛋白质含量很低(0.12%);Bi Lin等[15]也采用相类似的方法除去蛋白,因此粒径测定结果较小。相比较,Scheffler等[19]提取时无此过程,粒径测定结果偏大。与PG光滑的球形相比,PG-CCM复合物表现为较大的、不规则的平面片状结构。PG与CCM形成复合物后,可能由于二者的相互作用,使之在铜网上不再收缩成球形,而是更倾向于铺展开来,从而形成较大的、片状结构。
2.2.3 荧光光谱分析
如图8所示,在420 nm激发波长条件下,CCM溶液在波长575 nm处呈现一个低强度的宽峰;随着体系中PG质量浓度的提高,荧光强度显著增强,并发生明显蓝移。文献[21]报道了CCM在水溶液中的荧光强度很弱,且与所处体系环境有关。荧光物质的荧光强度和光谱与其所处微环境有关,强度增大、光谱蓝移通常表明分子由极性大向极性小的微环境转移。如Sahu[20]、Tapal[21]等分别用酪蛋白和大豆分离蛋白与CCM作用,使得CCM的荧光强度显著增加且光谱蓝移,认为CCM与从极性较大的水溶液环境向酪蛋白和大豆分离蛋白的疏水结构域转移,并依赖于疏水相互作用最终定位于二者的疏水结构域中。本实验中,PG使CCM的荧光强度增大、光谱蓝移,表明PG与CCM的作用位点极性相对较小,CCM由极性较大的微环境向极性较小的糖原作用区域转移,从而引起上述荧光光谱的变化。Scheffler等[19]的研究表明:PG呈现外紧内松的球形结构,即:由葡萄糖构成较短的侧链在球形结构的外周分布密集,而在内部分布相对较少。目前很难确定CCM在PG纳米球的外周和内部是否分布均一。
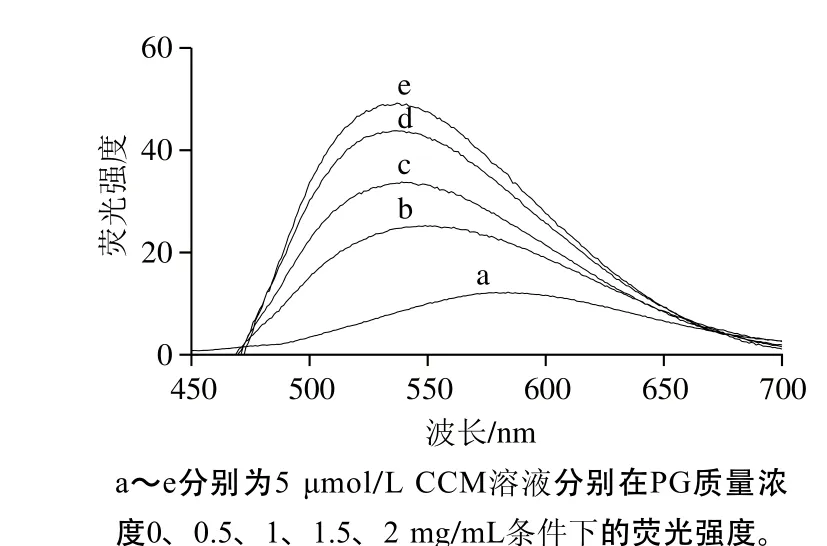
图8 CCM在不同PG质量浓度条件下的荧光发射光谱Fig. 8 Fluorescence emission spectra of CCM at different PG concentrations
2.2.4 衰减全反射傅里叶变换红外光谱分析

图9 CCM(a)、PG(b)、PG-CCM物理混合物(c)、10 mg/mL PG-CCM复合物(d)的红外光谱分析Fig. 9 FTIR spectra of CCM (a), PG (b), physical mixture of PG and CCM (c) and 10 mg/mL PG-CCM complex (d)
如图9所示,在PG的红外光谱中,峰位3 360 cm-1出现一宽峰,为OH的伸缩振动;在CCM的光谱中,3 501 cm-1为苯环OH的伸缩振动,1 625 cm-1为重叠在一起的C=O和C=C的伸缩振动,1 506 cm-1为C—O和C—C的伸缩振动,1 275 cm-1为苯环上C—O的伸缩振动,1 028 cm-1为C—O—C的伸缩振动;在PG-CCM复合物的物理混合物中,除3 501 cm-1为苯环OH的伸缩振动外,上述CCM的特征吸收峰均存在,且略微移向高频。如1 636 cm-1为重叠在一起的C=O和C=C的伸缩振动,1 508 cm-1为C—O和C—C的伸缩振动,1 279 cm-1为苯环上C—O的伸缩振动[13],1 025 cm-1为C—O—C的伸缩振动;在PG-CCM复合物的光谱中与PG-CCM复合物的物理混合物相比,1 508、1 279 cm-1吸收峰消失,即重叠的C—O和C—C的伸缩振动以及苯环上C—O的伸缩振动消失。以上结果表明PG与CCM发生了相互作用。
据文献报道,氢键被认为是酚类化合物与聚合物发生相互作用的主要作用力[28]。本研究中,CCM的C—O及苯环上C—O伸缩振动消失,说明其有可能参与了氢键形成。
2.2.5 差示扫描量热分析
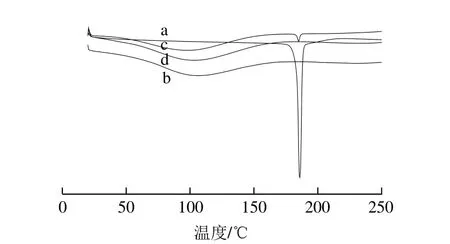
图10 CCM(a)、PG(b)、PG-CCM物理混合物(c)、10 mg/mL PG-CCM复合物(d)的差示扫描量热分析Fig. 10 DSC curves of CCM (a), PG (b), physical mixture of PG and CCM (c) and 10 mg/mL PG-CCM complex (d)
对CCM、PG、CCM和PG物理混合物、PG-CCM复合物进行差示扫描量热分析,结果见图10。PG没有显示特征吸热峰,在75~150 ℃之间有一个宽峰,归因于蒸发自由水和结合水[7]。CCM和PG-CCM复合物物理混合物,均大约在CCM晶体的熔点处(即180 ℃)呈现尖锐的吸热峰(熔点峰)[7],表明CCM以晶体状态存在于PG-CCM复合物物理混合物中。在PG-CCM复合物纳米负载物中,CCM晶体的熔点峰消失,表明:负载于PG中的CCM失去了其结晶结构,以无定形非晶体结构形式存在。
3 结 论
PG是一种新型的纳米粒载体,以自组装的方式负载CCM,形成PG-CCM复合物纳米粒。负载方法简单易行、无任何添加剂,负载后CCM的表观溶解度可提高约33 000 倍。PG与CCM可能通过分子间氢键发生相互作用,PG负载CCM后粒径无显著变化,平均粒径为70~75 nm,其中PG-CCM复合物中CCM以无定形的非晶体状态存在,氢键是CCM与载体PG发生作用的主要作用力,CCM由极性较大的微环境向极性较小的PG作用区域转移。研究结果表明,PG是一种高效的载体,可显著提高CCM的表观溶解度,且PG-CCM复合物制备简单,有望被纳入功能食品中以促进CCM的药理作用。

