二段浸出法提取高炉瓦斯泥中的铟
申星梅, 董亚栋, 吴照金, 武杏荣, 李辽沙
(安徽工业大学 a. 教育部冶金减排与资源综合利用重点实验室,b. 安徽省冶金工程与资源综合利用重点实验室, 安徽 马鞍山 243002)
高炉瓦斯泥是净化处理高炉瓦斯时收集的尘泥.作为一种可回收利用的二次资源,高炉瓦斯泥的主要成分包括铁矿粉、焦粉和煤粉,此外,还有微量的稀有金属铟.作为稀有金属,铟几乎没有单独的矿床,仅以微量伴生于锌、铅等金属矿中.近年来,铟在现代工业中的应用越来越广,可供提取铟的原料却日渐减少.因此,铟的再生资源回收逐渐成为提取铟的重要来源,如有色金属冶炼过程中的烟灰或浸出渣,高炉炼铁过程的瓦斯泥、废铟锡氧化物(ITO)靶材等[1-6].有专家认为,铟的质量分数达到0.002%时,该固废即有工业回收价值[7].
目前,从冶金固废中提取铟,大多是以硫酸作为浸出剂,使原料中的铟溶解进入溶液[8-19].唐谟堂等[14]采用硫酸从含铟固废中提取铟,在最优条件下铟的浸出率达96%.高照国等[15]采用二段硫酸浸出法从含铟铅烟尘中提取铟,即先采用200 g·L-1浓硫酸在95 ℃下浸出5 h,再采用稀硫酸浸出2 h,铟的浸出率为91.5%.刘郎明[16]采用二段硫酸浸出法从铅浮渣反射炉烟尘中提取铟,在高温、强酸和氧化剂锰粉的作用下,铟的浸出率达95%以上.刘大春等[17]采取先中性后酸性的二段浸出法从富铟渣中提取铟,两次浸出后铟的浸出率可达90%~95%.
然而,高炉瓦斯泥中除微量铟外,还含有大量的铁,以及少量的锌、镁、钙、铝等金属元素.浸出过程中,除铟进入溶液外,铁、锌、钙、铝等元素也不同程度地随铟一起进入溶液,对后序铟的分离产生不良影响.尤其是铁元素,对铟的分离过程干扰较大[20-23].因此,高炉瓦斯泥中提取铟的研究重点主要集中在两个方面:一是如何使瓦斯泥中的铟完全溶解进入溶液;二是在保持较高铟浸出率的情况下,如何使铟与一起进入溶液的其他元素分离.
基于此,本文采用先酸性后碱性的二段浸出法提取高炉瓦斯泥中的铟,以期为贫铟固废中铟的回收提供新的思路.
1 实验材料及方法
高炉瓦斯泥取自马鞍山钢铁有限公司,其化学成分如表1所示.硫酸、氢氧化钠均为分析纯.实验所用仪器有常州国华电器有限公司生产的JJ-1型精密增力电动搅拌器,金坛市文华仪器有限公司生产的HH-S2型数显恒温水浴锅,赛默飞世尔科技有限公司生产的ARL Advant’X Intellipowe 3600型X射线荧光光谱仪,北京瑞利分析仪器公司生产的WFX-310型原子吸收分光光度计,北京有色金属研究总院生产的铟空心阴极灯,上海雷康分析仪器有限公司生产的CROB型自动分析进水系统.

表1 高炉瓦斯泥化学成分的质量分数Table 1 Mass fraction of blast furnace sludge chemical composition %
将现场取来的高炉瓦斯泥放入80 ℃烘箱中,烘至恒重. 称取干燥后的瓦斯泥样品置于烧杯中,加入一定质量浓度的硫酸溶液后,在70 ℃恒温水浴中搅拌反应. 反应完毕后, 放入离心机中进行固液分离.将上清液倒入烧杯,加入浓度为10 mol·L-1的氢氧化钠溶液,在80 ℃恒温水浴中搅拌反应.离心分离后,采用火焰原子吸收法进行检测[24].测定0、1.00、2.00、4.00、6.00、8.00 μg·mL-1铟标准系列溶液的吸光度,作图得出校准曲线,求得其回归方程为A=0.016ρ+0.000 2,相关系数r=0.999 9.其中,A为吸光度,ρ为铟标样质量浓度.测量空白溶液和铟浸出液样品的吸光度,铟浸出液吸光度减空白值后,根据回归方程即可得出浸出液中铟的质量浓度.按照式(1)计算得出铟的浸出率.
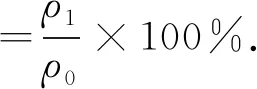
(1)
式中:ρ1为浸出后溶液中铟的质量浓度;ρ0为浸出前瓦斯泥中铟的质量浓度.
2 实验结果及分析
2.1 先酸性后碱性二段浸出原理
金属离子在溶液中的稳定性与其电位、pH值密切相关,故电位-pH值图被广泛用来分析浸出过程的热力学条件.在电位-pH值图上不仅可以看出各种反应的平衡条件和各组分的稳定范围,还可以判断条件变化时平衡移动的方向和限度[7].图1是In-H2O的电位-pH值图.从图1中可以看到,①线、②线包围的区域即In3+的存在区.浸出过程就是要创造条件使瓦斯泥中的In2O3跃过①线,进入In3+的存在区,此区域的临界pH值约为2.5.
一段酸性浸出的目的是为了使瓦斯泥中的铟进入溶液.铟在高炉瓦斯泥中主要以In2O3的形态存在,有时也会有极微量的In单质存在.其浸出反应式为:
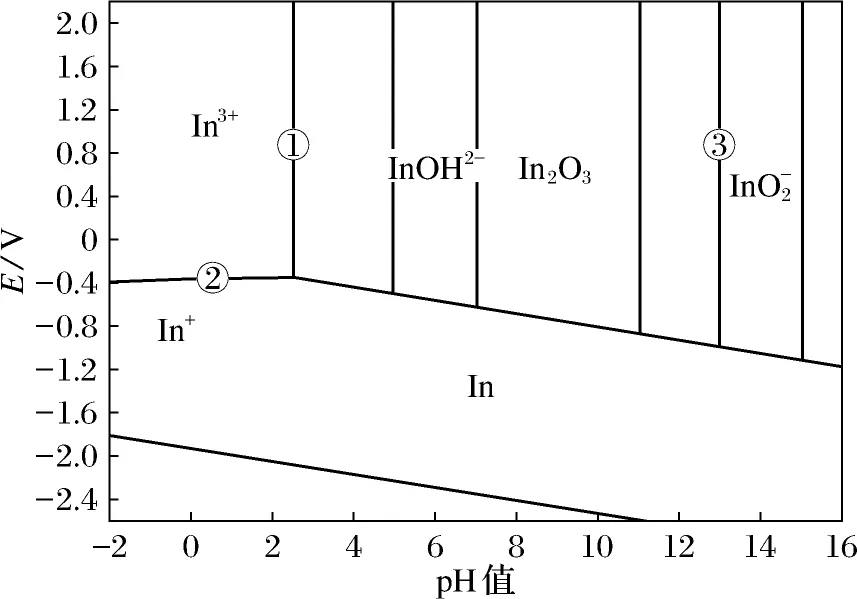
图1In-H2O的电位-pH值图
Fig.1Potential-pH diagram of In-H2O
热力学计算表明,式(2)、式(3)化学反应的ΔG⊖均小于0[25], 即反应能自发进行.酸浸之后,瓦斯泥中的铟、铁、镁等分别以In3+、Fe3+和Mg2+的离子形式存在.这时,需要将溶液中微量的In3+与大量存在的Fe3+等其他离子分离.
二段碱性浸出的目的就是为了使In3+与其他离子分离.In(OH)3是两性化合物,在低浓度的碱中不溶;在高浓度的碱中,胶溶为透明溶液;在过高浓度的碱中,转变为铟的络合物.In(OH)3在氢氧化钠中的溶解度如图2所示[7].在含有In3+、Fe3+、Mg2+等离子的酸浸液中加入碱液后,In3+、Fe3+、Mg2+等离子沉淀为In(OH)3、Fe(OH)3、Mg(OH)2.利用In(OH)3两性化合物的性质,用合适浓度的碱液溶解In(OH)3,使铟由金属离子沉淀相再次进入溶液,而铁、镁仍留在沉淀相中,从而实现In3+与其他离子的分离.
从图1中可以看到,在碱性区域内,铟以离子形式存在至少要跃过③线,此区域的临界pH值约为13,即碱浸时需要使用较高浓度的碱液.
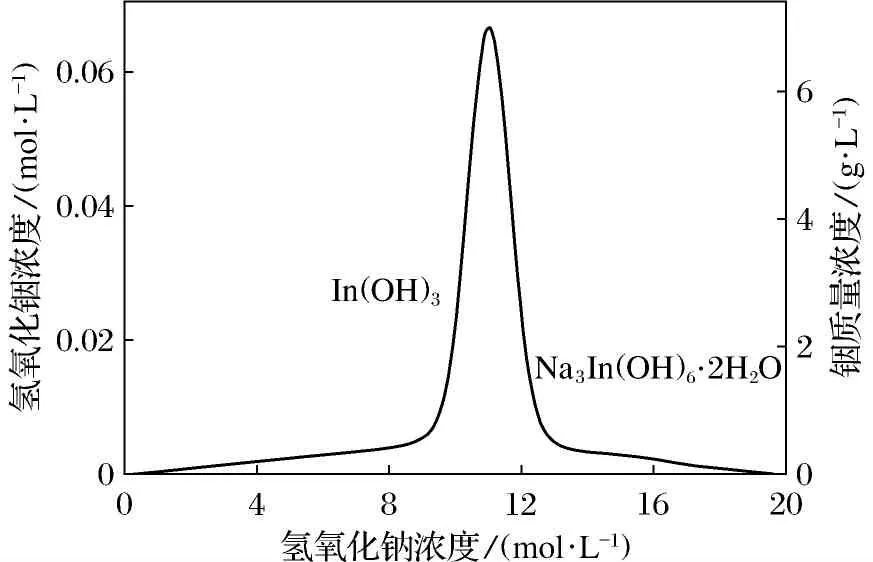
图2In(OH)3在氢氧化钠中的溶解度图
Fig.2Solubility curves of In(OH)3in NaOH solutions
2.2 浸出工艺对铟浸出率的影响
酸用量是影响铟浸出率的一个重要因素.图3是铟浸出率随硫酸质量浓度的变化曲线.从图3可以看出,随着硫酸质量浓度的增加,铟的浸出率明显增加.这是因为高炉瓦斯泥中含有钙、铁、镁、铝等多种金属氧化物,其中不少金属氧化物的化学性质比In2O3活泼.加入硫酸后,这些较活泼的氧化物会先与溶液中的H+反应,消耗掉大部分H+,使溶解In2O3的反应难以进行彻底.增加硫酸质量浓度,可使化学反应式(2)、(3)中的H+浓度增加,平衡向右移动,从而使铟的浸出率得到提高.当硫酸质量浓度达到200 g·L-1时,铟的浸出率为38%.如果继续增加硫酸质量浓度,铟浸出率还会有所提高.但是,过多使用硫酸会增加成本、造成设备损耗等,而且也会导致后续碱液用量的增加.因此,最佳硫酸质量浓度为200 g·L-1.
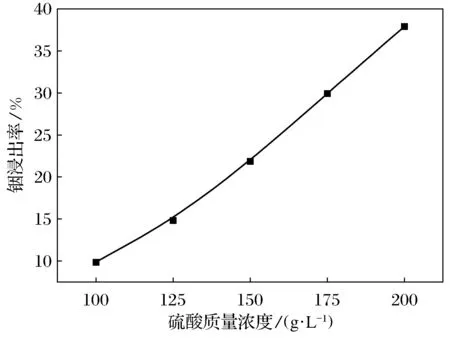
图3 铟浸出率随硫酸质量浓度的变化曲线
图4是铟浸出率随酸浸时间的变化曲线.由图4可知,铟浸出率随酸浸时间的增加而持续增加.酸浸2 h后,浸出率的增加速度明显变慢;4 h后,铟浸出率达45%.再继续延长酸浸时间,浸出率基本保持不变.浸出时间过长会导致能耗增加,生产循环周期延长,从而导致生产率降低.若能在保持较高浸出率的基础上,将浸出时间控制在一定范围之内,将会取得较高的生产率和经济效益[26].因此,最佳酸浸时间为2 h.
由图2可知,In(OH)3在10~11 mol·L-1氢氧化钠中的溶解度最大.本实验选择10 mol·L-1的氢氧化钠进行碱浸.图5是铟浸出率随氢氧化钠体积分数的变化曲线.从图5中可以看出,铟浸出率随氢氧化钠体积分数的增加而增加.在酸浸后含有多种金属离子的溶液中加入氢氧化钠后,一方面OH-与溶液中大量的H+结合,另一方面OH-与金属离子结合生成沉淀.氢氧化钠体积分数较低时,溶液pH值无法跃过图1中的③线,则氢氧化铟无法溶解进入液相,浸出率较低.随着氢氧化钠体积分数增加,浸出率逐渐增加,当氢氧化钠体积分数增加到19%时,浸出率达96%.继续增加氢氧化钠,浸出率基本保持不变.因此,最佳氢氧化钠体积分数为19%.
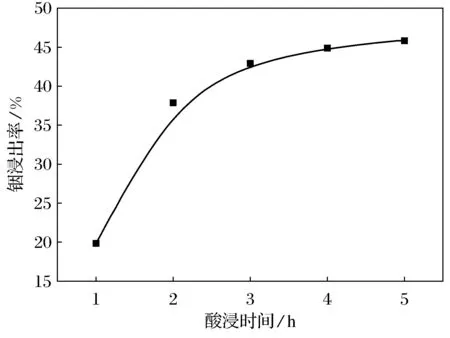
图4 铟浸出率随酸浸时间的变化曲线
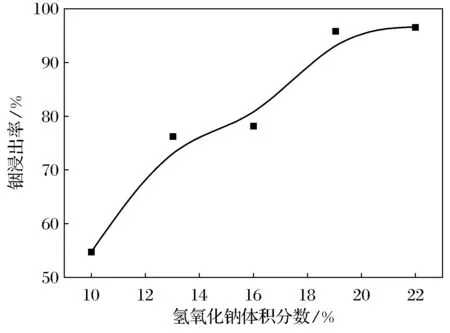
图5 铟浸出率随氢氧化钠体积分数的变化曲线
3 结 论
(1) 采用先酸性后碱性的二段浸出法提取高炉瓦斯泥中的铟.一段酸性浸出,使瓦斯泥中的金属离子进入液相;二段碱性浸出,利用氢氧化铟两性化合物的性质,使铟留在液相,从而与其他金属离子分离.
(2) 浸出的最佳工艺条件为:硫酸质量浓度200 g·L-1,酸浸时间2 h,氢氧化钠体积分数19%.

