Cry1Ia和Cry2Ab融合蛋白的表达
郭小琴,钱红梅,郭俊佩,史宗勇,高建华*,王兴春*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 农业生物工程研究所,山西 太谷 030801)
基因堆叠是害虫抗性治理中的一种重要策略[1]。该策略同时使用不同作用机制的杀虫蛋白,从而防止或显著延缓靶标害虫抗性的产生。Zhao等报道,在花椰菜中同时表达苏云金芽孢杆菌(Bacillusthuringiensis,Bt)杀虫蛋白Cry1Ac和Cry1C,能显著延缓小菜蛾的抗性发展[2]。目前,基因堆叠已有多个成功的商业化案例,比如Bollgard II(Monsanto 15985)抗虫棉同时表达两种Bt基因,cry1Ac和cry2Ab。当然,基因堆叠时,蛋白可以独立表达,比如Bollgard II抗虫棉;也可以以融合蛋白的形式表达,比如,Cry1Ab和Cry1C的融合蛋白[3~5]、Cry1Ac-Cry1I-like[6]、Cry1Ab-Vip3A[7]等融合蛋白的抗虫性能均在相应的转基因作物中获得了验证。
Cry2Ab和Cry1Ia蛋白是Bt表达的常见杀虫蛋白。两种蛋白质均含有大多数Cry蛋白典型的N端3个结构域(Domain Ⅰ、Ⅱ和Ⅲ),这3个结构域分别用于形成跨膜通道(Domain I)、受体的识别与结合(Domain Ⅱ和Ⅲ),是Gry蛋白执行功能的核心区域[8~10]。通常,具有经典3结构域的Cry蛋白有两种大小[11]。一类是在3结构域的C端存在几乎与之等长的长肽,这类Cry蛋白的分子量约135 kDa,比如Cry1A,Cry9等。另一类Cry蛋白不具有C端长肽,因此分子量远小于前者,比如Cry2A和Cry1I蛋白等。
Cry2Ab蛋白缺少C端长肽,其分子量约70 kDa。目前认为,Cry蛋白C端的长肽能够帮助其N端3结构域形成晶体结构。Cry2Ab蛋白伴孢晶体的形成,可能需要借助其他蛋白质辅助。与其亲缘关系很近的Cry2Aa蛋白,需要借助该蛋白编码基因所在操纵子中的一个基因(orf2)编码产物的辅助[12]。
Cry1Ia虽与Cry2Ab类似,只具备经典的N端3结构域,缺乏C端长肽。GryⅡ是Cry蛋白中少有的分泌型蛋白,由N端45个氨基酸组成的多肽介导其跨膜转运。在宿主细胞中表达后,不形成伴孢晶体[13]。
Cry2Ab对常见作物的重要鳞翅目害虫具有良好的防治效果,已在转基因棉花、玉米等中获得广泛应用。如表达Cry2Ab蛋白的转基因抗虫棉,对棉铃虫(Helicoverpaarmigera),谷实夜蛾(Helicoverpazea)和澳洲棉铃虫(Helicoverpapunctigera)等害虫具有较好的杀虫活性[14]。Cry1Ia蛋白对鳞翅目和鞘翅目部分昆虫具有杀虫活性[15]。
本文选择上述两种分子量相对较小的Cry蛋白,按照两种先后顺序排列,构建融合蛋白Cry2Ab-Cry1Ia和Cry1Ia-Cry2Ab。另外,Soberón等将Cry1Ab和Cry1Ac蛋白N端第一个α-螺旋删除后,获得的突变体Cry1AbMod和Cry1AcMod对抗性昆虫的活性显著提高[16]。本文模拟Cry1AbMod和Cry1AcMod,将Cry1Ia蛋白N端73个氨基酸的编码序列删除后,构建第三个融合蛋白Cry1IaD73-Cry2Ab。在Bt细胞中表达三种融合蛋白,为进一步筛选高活性的融合杀虫蛋白奠定基础。
1 材料与方法
1.1 试验材料
本文涉及的菌株为大肠杆菌(EscherichiaColi)TG1菌株Tp304-1Ia和Tp304-2Ab。两种菌株分别含有304-P1IaT质粒和304-P2AbT质粒[16]。
本文涉及的分子生物学试剂包括:用于PCR反应的Takara Premix Taq(货号RR003 A);用于基因克隆的Takara pMD19载体(货号6013)和天根大肠杆菌DH5α感受态细胞;质粒提取使用天根快速质粒小提试剂盒(货号DP105);DNA片段凝胶回收使用天根通用型DNA纯化回收试剂盒(货号DP214)。DNA测序委托铂尚生物技术(上海)有限公司完成。
1.2 试验方法
1.2.1 融合基因的构建
将Tp304-1Ia和Tp304-2Ab菌株在37 ℃,200 rpm条件下,过夜培养。分别取2 mL菌液至离心管,12000 rpm离心3 min,收集细胞沉淀,并提取质粒,备用。以304-P2AbT为模板,使用引物2Ab-bbF(5′-GGATCCACCATGAATAGTGTATTGAATAGC)和2Ab-bbR(5′-AGATCTATAAAGTGGTGAAATATTAGTTGGTAC-AAGCA)进行PCR反应,获得Cry2Ab的编码序列,预期大小约1.9 kb。以304-P1IaT为模板,使用引物1Ia-bbF(5′-GGATCCACCATGAAACTAAAGAATCAAGATAAG)和1Ia-bbR(5′-AGATCTCATGTTACGCTCAATATGGAGTTG)进行PCR反应,获得Cry1Ia的编码序列,预期大小约2.1 kb。将两个PCR产物割胶回收后,分别进行T克隆。测序正确后,将目的片段用BamHI和BglII切除,分别接入304-P1IaT和304-P2AbT质粒的BamHI位点。将正确的质粒,分别命名为p304-2Ab-1Ia和p304-1Ia-2Ab。
使用引物IaD73-bbF(5′-GGATCCACCATGTCTGAGTATGAAAATGTAGAG)和1Ia-bbR进行PCR反应,获得cry1IaD73基因。然后,将其插入304-P2AbT质粒的BamHI位点(方法类似p304-2Ab-1Ia质粒的构建)。该质粒命名为p304-1IaD73-2Ab。
将构建好的表达质粒分别转入Bt BMB171菌株,获得Bp304-2Ab-1Ia、Bp304-1Ia-2Ab和Bp304-1IaD73-2Ab菌株。
1.2.2 融合蛋白的表达与SDS-PAGE分析
将Bp304-2Ab-1Ia、Bp304-1Ia-2Ab和Bp304-1IaD73-2Ab菌株分别划线培养。然后,挑取单克隆,在液体LB培养基中培养72小时(含25 μg·L-1的红霉素。如无特殊说明,培养条件均为28.5 ℃,200 rpm)。离心,分离其中的细胞与LB培养液。其中,细胞沉淀用PBS缓冲液(137 mM NaCl,2.7 mM KCl,10 mM Na2HPO4,和2 mM KH2PO4,pH7.4)重悬。向细胞重悬液和上清液中,分别加入PBS缓冲液四分之一体积的5×Loading Buffer,混匀后,沸煮10分钟。12000 rpm离心10分钟后,上样进行SDS-PAGE检测。
1.2.3 融合蛋白表达的western blot分析
重复上述SDS-PAGE分离。分离好后,用湿转法转至硝酸纤维素薄膜上进行蛋白印记(western-blot)分析。首先,将转好的硝酸纤维素膜放入含有5%脱脂牛奶的1×TBST(0.1 mmol·L-1Tris-HCL,0.15 mmol·L-1NaCl,0.1% Tween-20)中,37 ℃温浴2小时。然后,替换为含有一抗(兔源抗Cry2Ab多克隆抗体)的1×TBST,4 ℃过夜。次日,将膜用1×TBST清洗3~4次后,放入含有二抗(辣根过氧化物酶偶联的羊抗兔抗体)的1×TBST中,温浴2小时。将膜用1×TBST清洗3~4次后,使用二氨基联苯胺(3,3′-diaminobenzidine,DAB)进行显色,分析。
1.2.4 温度对融合蛋白表达的影响
将含有三种融合基因的Bt菌株分别挑取单克隆,并接入前述LB液体培养基中。一式三份,分别在25 ℃、28.5 ℃和32 ℃条件下培养至72小时。然后,按前述方法,进行SDS-PAGE检测,分析不同融合蛋白在不同温度条件下表达的稳定性[16]。
2 结果与分析
2.1 融合基因的载体构建
对三种质粒分别进行双酶切(BamHI和SacI)鉴定。结果显示,三种载体构建正确(图1)。
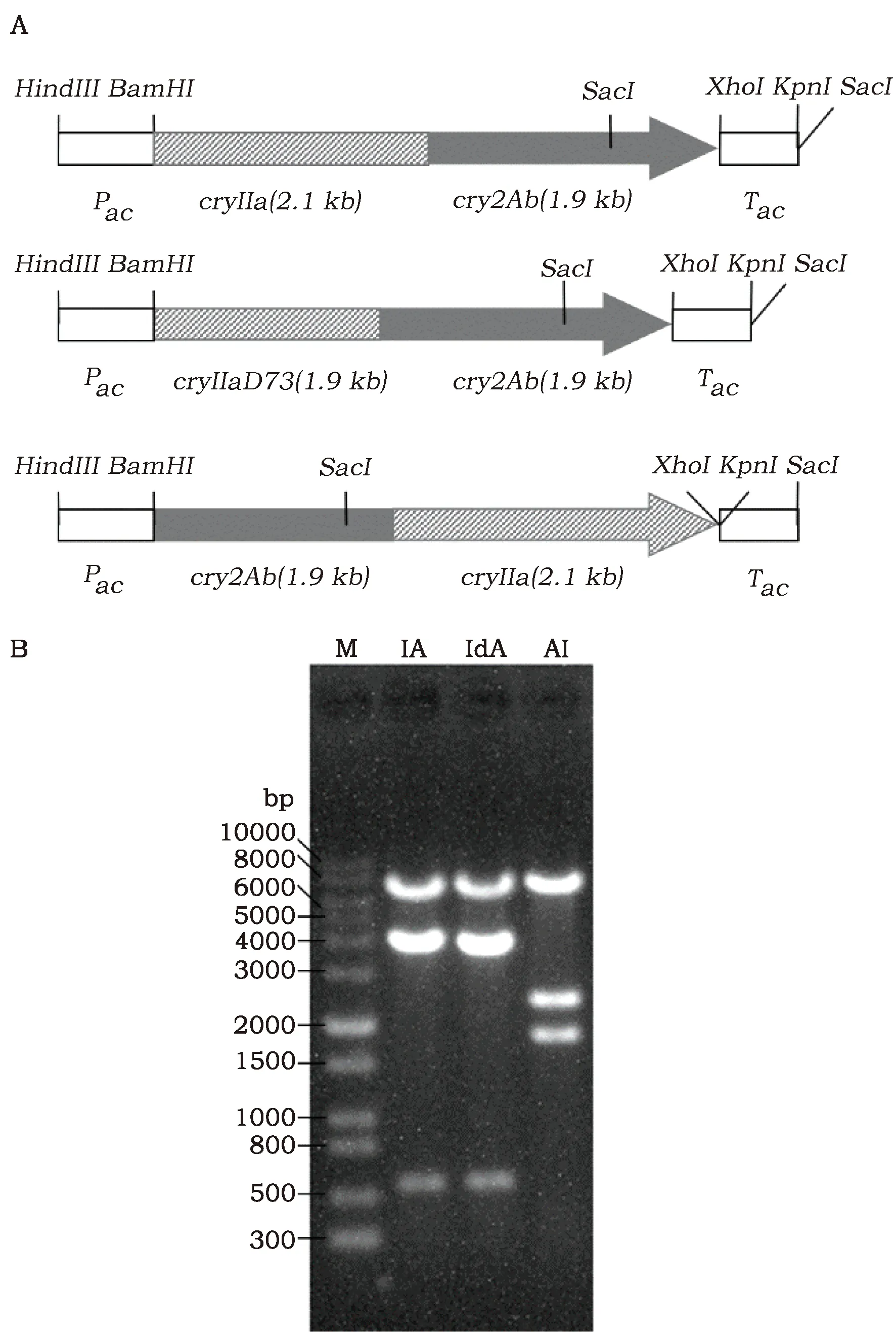
图1 三种融合基因质粒的酶切鉴定Fig.1 Restriction analysis of three plasmid containing fusion genes注:使用BamHI和SacI双酶切。“IA”泳道为Cry1Ia-Cry2Ab;“IdA”泳道为Cry1IaD73-Cry2Ab;“AI”泳道为Cry2Ab-Cry1Ia;“M”泳道为核酸标准分子量。Note:The three plasmids were digested simultan eously by Bam HI and SacI;Lane IA:Cry1Ⅰa-Cry 2Ab;Lane IdA:Gry Ⅱad73-Cry 2Ab;Lane AI:Cry2 Ab-Cry 1Ⅰa Lane M:DNA Marker.
2.2 融合基因的表达
将三种质粒分别电击转化Bt BMB171菌株,用于融合蛋白的表达。结果显示,三种融合蛋白均能够表达,且表达量较高(图2)。SDS-PAGE分析目标条带的大小,与预期分子量相近。其中Cry2Ab-Cry1Ia和Cry1Ia-Cry2Ab分子量一致(约152 kDa);Cry2Ab-Cry1IaD73因缺少Cry1Ia蛋白N端73个氨基酸,因此分子量略小(约144 kDa)。
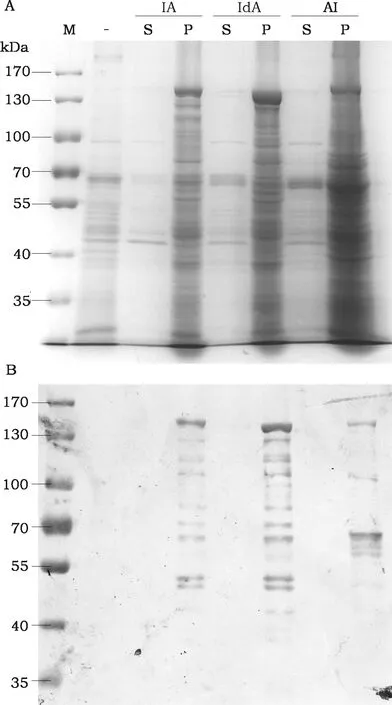
图2 融合蛋白的表达分析Fig.2 Expression of the fusion proteins注:IA为Cry1Ia-Cry2Ab;IdA为Cry1IaD73-Cry2Ab;AI为Cry2Ab-Cry1Ia;M泳道为蛋白标准分子量。“S”泳道为细胞培养液的上清;“P”泳道为收集的细胞样品;“-”为阴性Bt细胞培养液样品。Note:IA:Cry1Ia-Cry2Ab,IdA:Cry1IaD73-Cry2Ab,AI:Cry2Ab-Cry1Ia Lane M:PageRuler Prestained Protein ladder;Lane S:Culture medium supernatant;lane P:Cell Precipitate;lane"-"negative control.
对三种表达产物进行蛋白印记分析,结果发现,三种融合蛋白能够表达其完整分子,但是也检测到部分较小的免疫条带。对比发现,这些条带并不完全是非特异性条带。如在Cry1Ia-Cry2Ab和Cry1IaD73-Cry2Ab中检测到的非预期条带图谱基本一致,暗示其降解形式相似。而另一种融合蛋白Cry2Ab-Cry1Ia的降解形式与前两者完全不同(图2)。其中,信号最强的一条降解条带,与cry2Ab基因单独表达的蛋白分子量接近(70.7 kDa)。
最后,对不同温度下,三种融合蛋白的表达情况进行检测。结果发现,25 ℃下,蛋白表达不稳定,72 h未获得理想的蛋白表达量(图3)。而28.5 ℃和32 ℃,均能获得较理想的蛋白表达。
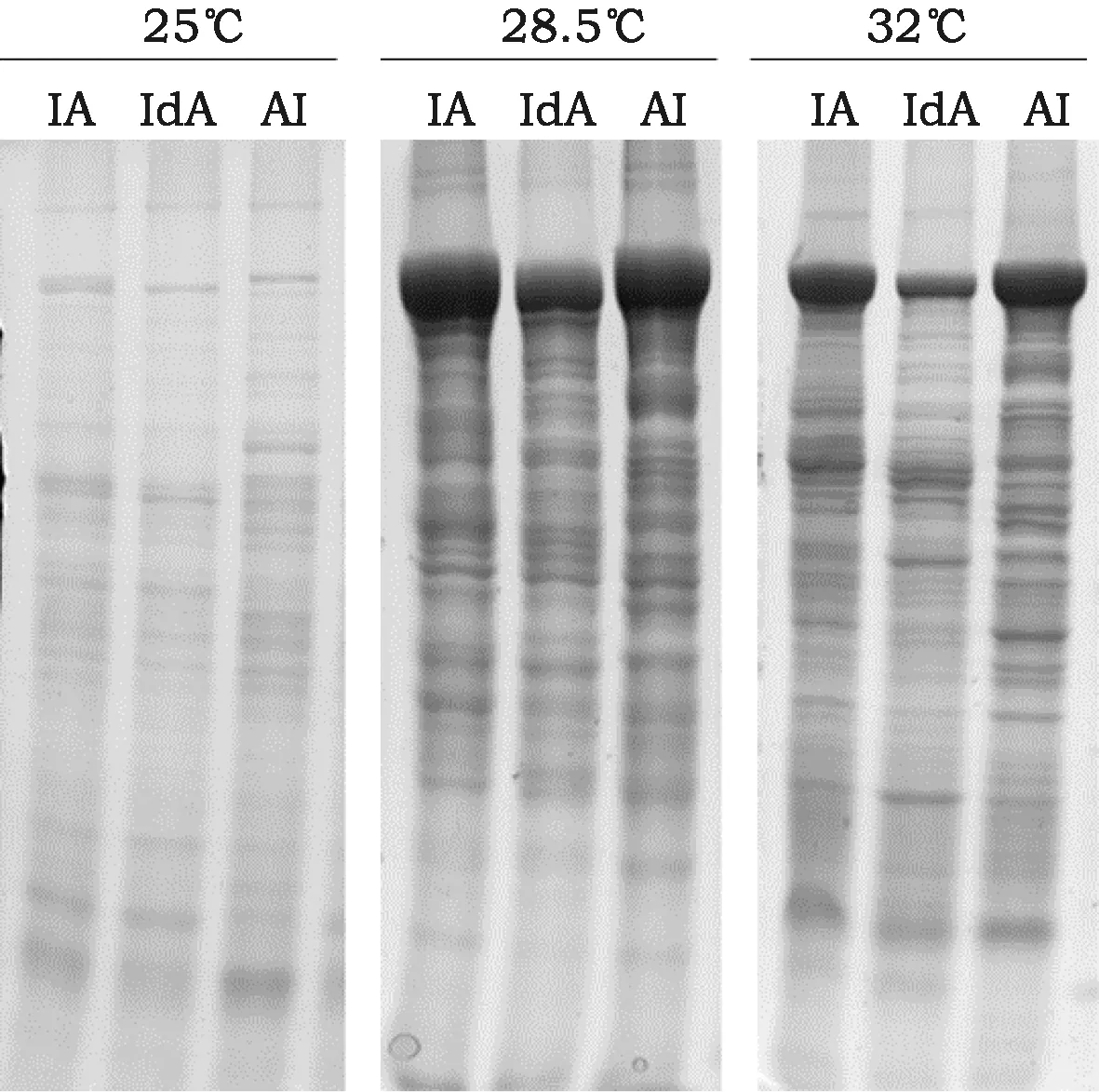
图3 融合蛋白的可溶性分析Fig.3 Analysis of the solubility of three fusion proteins
3 结论与讨论
本文利用Cry1Ia和Cry2Ab蛋白,构建了3个融合杀虫蛋白。3个融合基因在Bt细胞中均获得了较好的表达量。本文设置的3种培养温度中,只有25 ℃对其蛋白表达影响明显,这可能是由于低温延缓细胞进入孢子形成期,从而影响了cry1Ac启动子的活性。另外两个培养温度下,三种融合蛋白均获得理想的表达,这与前文研究结果一致[16]。
目前为止,已经有多种融合蛋白被构建,比如前述的Cry1Ab和Cry1C的融合蛋白[3~5]、Cry1Ab-Cry9Aa[17]、Cry1Ac-Cry1I-like[6]和Cry1Ab-Vip3A[7]等。很多融合杀虫蛋白都获得了理想的杀虫活性或杀虫谱,部分融合蛋白的性能在转基因作物中也获得了较好的验证。如表达Cry1Ab和Cry1C融合蛋白的转基因玉米对西南玉米螟(Diatraeagrandiosella)、小蔗螟(Diatraeasaccharalis)和草地贪夜蛾(Spodopterafrugiperda)具有较好的杀虫活性。而在转基因水稻中,这种融合蛋白能够抵御三化螟(Scirpophagaincertulas)等重要害虫的侵害。本文构建的三种融合蛋白在害虫治理方面的作用,需要进一步研究。
本研究中,Cry1Ia-Cry2Ab并没有分泌到上清液中,说明基因融合后对Cry1Ia蛋白的分泌产生了影响。另一种影响分泌的潜在原因在于,cry1Ac基因的启动子在Bt细胞中为强启动子,在孢子形成期迅速表达出大量融合蛋白,并形成包涵体。另外,Cry1IaD73蛋白参与的融合蛋白Cry2Ab-Cry1IaD73稳定性并没有显著改变。
在蛋白表达过程中,尤其是对于分子量偏大的蛋白质,往往会有部分蛋白表达不完整或者表达后出现降解的现象。本文构建的三种融合蛋白在表达过程中,均检测到比预期片段小的条带。通过蛋白印记分析发现,这些条带并不完全是非特异性条带,而是蛋白质降解产生的。其中Cry2Ab-Cry1Ia蛋白降解的中间过渡体较少,大部分以单独Cry2Ab蛋白的形式被检测到。该结果也验证了前人的观点,即Cry蛋白构建的融合杀虫蛋白可以被部分蛋白酶消化,从而形成两个单独的Cry蛋白,进而执行其杀虫作用[1]。当然,还需要进一步研究才能真正揭示三种新型融合蛋白的降解原因和具体方式。
综上,本文构建了3种融合杀虫基因,并成功在Bt细胞中表达。该结果为进一步研究三种融合蛋白在害虫治理和抗性治理中的作用奠定了基础。

