外源MeJA对低温下紫苏脂肪酸合成及FAD3基因表达的调控
王计平,梁倩,周雅莉,李润植,薛丽芳,郝晓娟
(山西农业大学 农学院,山西 太谷 030801)
紫苏(Perillafrutescens(L.)Britt.),又名桂荏、白苏、赤苏等,是唇形科紫苏属下唯一种,一年生草本植物。作为一种新型油料作物,紫苏种子含油量高达45%~55%,其中α-亚麻酸含量占总脂肪酸含量的65%左右,是目前发现的亚麻酸含量较高的特用油料作物之一[1]。
脂肪酸是构成生物膜的必要组分,对植物细胞膜结构的形成和稳定起重要作用。膜中不饱和脂肪酸比例决定膜脂的相变温度,不饱和脂肪酸含量越高,膜脂相变温度越低,植物越耐低温[2,3]。茉莉酸类物质作为信号分子参与调控植物的生长发育、抵御病原体感染等生物胁迫及干旱、低温、高盐等非生物胁迫[4]。α-亚麻酸是植物体内茉莉酸合成的前体物质,它的内源含量直接关系到生成茉莉酸的量,而ω-3脂肪酸脱氢酶(FAD)可以催化亚油酸合成α-亚麻酸,当植物受到低温胁迫后就会诱导FAD基因的表达和亚麻酸的形成,使α-亚麻酸转变为茉莉酸[5,6],从而提高植物的抗冷性。茉莉酸甲酯(MeJA)作为天然茉莉酸类植物生长调节剂,在调节植物应激反应和植物发育过程中发挥重要作用,研究表明施用外源MeJA可以显著提高植物对干旱[7]、高温[8]、低温[9]、病虫害[10]等的抗性。
本试验通过研究一定浓度外源MeJA及低温胁迫处理对紫苏幼苗脂肪酸组分及含量、相对电导率、丙二醛含量及亚麻酸合成关键酶基因FAD3表达特性的影响,探究外源MeJA是否能增强紫苏对低温胁迫的耐受性,有助于从脂肪酸代谢角度阐明MeJA对低温胁迫的响应机制。
1 材料与方法
1.1 试验材料
供试材料为晋紫苏1号,由中北大学张志军教授提供。
挑选籽粒饱满的紫苏种子,蒸馏水冲洗干净后,用0.1% HgCl2消毒8 min,蒸馏水冲洗3~4次,然后将圆形滤纸吸饱水铺在一次性培养皿中,将种子均匀撒在滤纸上,置于光照培养箱中培养,待长出侧根后移栽到花盆。当幼苗长出第4片真叶后,挑选发育良好且长势一致的幼苗喷施0.025 mmol·L-1MeJA,每天1次,喷至叶片表面有小液珠滴下为止,连续喷施3 d,经MeJA处理后的幼苗分别进行0、3、6、9、12、24 h低温胁迫(4 ℃),然后分别收集幼苗顶端的展开真叶,置于液氮中速冻,-80 ℃冰箱保存备用。以不经过外源MeJA处理直接进行4 ℃低温胁迫0、3、6、9、12、24 h的紫苏幼苗作为对照(CK)。
1.2 主要仪器
安捷伦7890 A气相色谱仪,CFX96 Real-Time PCR Detection System。
1.3 试验方法
1.3.1 脂肪酸提取及含量测定
-80 ℃保存的样品经真空冷冻干燥过夜,称取冻干叶片样品50 mg置于干燥玻璃试管中,使用玻璃棒小心研磨至粉末状。每毫克冻干样品加10 μg Tri 17∶0用于内对照。加入1 mL氯仿:甲醇(2∶1)溶液,用玻璃棒搅拌后静置,加入0.5 mL 0.9% KCl溶液搅拌混匀后,再加入1 mL氯仿,混匀,3 000 rpm离心后使其分层。使用玻璃吸管将试管底部的氯仿相吸出,然后转移至另一新的玻璃试管内,将该试管置于水浴锅(55 ℃)中蒸发,留下10~20 μL时,向试管中加入0.5 mL甲醇钠(含BHT)混匀,置于摇床上震荡20~45 min。之后加入0.5 mL异辛烷,进行混匀,3 000 rpm离心,使试管内溶液分层,再加入1 mL 0.9 %的KCl溶液,混匀,3 000 rpm再离心至分层。吸取上层溶液(含有脂肪酸甲酯),放入GC瓶中,编号,-20 ℃冰箱保存待测。
通过Agilent 7890 A气相色谱仪进行分析,采用以下条件:VF-23 MS毛细管色谱柱30 m×0.25 mm×0.25 μm。进样体积1 μL,进样口温度为260 ℃,分流比30∶1,恒压22 psi,载气为高纯氮气。程序升温:初温110 ℃,运行3 min,以每分钟4 ℃的频率升至220 ℃后保持15 min。FID检测器温度为260 ℃,尾吹气氮气每分钟45 mL,空气每分钟450 mL,氢气每分钟40 mL。
1.3.2 相对电导率和丙二醛含量测定
参照高俊凤[11]的方法测定不同处理条件下紫苏幼苗叶片相对电导率及丙二醛含量。
1.3.3 荧光定量PCR检测
取不同处理的叶片样品按照TIAN Gen Biotech 公司TRIZOL提取试剂盒及FastQuant cDNA第一链合成试剂盒进行RNA提取及第一链cDNA的合成。选择18SrRNA作为内参基因,并根据转录组数据库中获得的FAD3基因序列设计荧光定量特异引物。所用引物序列分别为:
18SrRNAF:5′- CGGCTACCACATCCAAGGAA-3′
18SrRNAR:5′- GCTGGAATTACCGCGGCT-3′;
PfFAD3 F:5′- CTCCTCTATGCCTCCACCATTGTTG-3′
PfFAD3 R:5′- ATAACTCCATTCCTTGCTGCGGTAC-3′。反应体系为10 μL:RealStar Green Power Mixture(2×)5 μL,ROX Reference Dye(50×)0.2 μL,10 μmol L-1引物对各0.2 μL,模板cDNA 0.2 μL,RNase-free H2O 4.2 μL。反应采用两步法Real-Time PCR:95 ℃ 10 min;95 ℃ 15 sec,60 ℃ 1 min,40次循环;每个样品进行3次生物学重复和3次技术重复。所用引物由上海生工生物工程有限公司合成。
1.4 数据统计
采用Microsoft Excel处理数据和作图,不同处理间差异显著性用SPSS16.0软件中的Duncan′s新复极差法进行统计分析。试验结果用mean±SE表示。
2 结果与分析
2.1 MeJA对低温胁迫下紫苏叶片脂肪酸组分及含量的影响
紫苏幼苗喷施外源MeJA后进行4 ℃低温胁迫,分别于0、3、6、9、12、24 h测定叶片中脂肪酸组分及含量。结果表明(表1),在不同处理中叶片主要脂肪酸均包括5种类型,即棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)和亚麻酸(C18∶3);各组分含量(mg·g-1)依次为:C18∶3>C18∶2>C16∶0>C18∶0>C18∶1。4 ℃低温胁迫(CK)后,随着处理时间的延长,叶片中C16∶0、C18∶0、C18∶1和C18∶3的含量均显著高于对照,C18∶3的含量在处理9 h时达到最高,而C18∶2的含量呈明显降低趋势;MeJA+4 ℃处理后,不饱和脂肪酸C18∶3的含量急剧上升,在处理6 h时亚麻酸含量为871.57 mg·g-1,可以达到不进行任何处理的紫苏叶片中C18∶3含量的6.96倍,是单独进行4 ℃低温胁迫6 h时C18∶3含量的2倍,而C18∶2的含量在处理6 h时达到最低;且不同处理之后,紫苏叶片总脂肪酸含量均显著上升,MeJA+4 ℃处理12 h时达到对照的3.93倍,是经过MeJA处理且 4 ℃胁迫0 h时总脂肪酸含量的 2.74倍。

表1 MeJA+4 ℃低温处理后紫苏幼苗叶片脂肪酸组成及含量Table 1 Fatty acid composition and content in perilla seedlings leaves after MeJA+4 ℃ treatment
注:同列数字后的不同小写字母表示各处理间差异达显著水平(P<0.05)。
Note:Different small letters indicate the significant difference among various treatments atP<0.05 level.
2.2 MeJA对低温胁迫下紫苏叶片脂肪酸不饱和度的影响
脂肪酸不饱和度(UFA/SFA)是反映脂肪酸构成比例的重要指标。如图1所示,总体来说,MeJA+4 ℃处理后,紫苏叶片中脂肪酸不饱和度UFA/SFA均显著高于4 ℃低温胁迫处理;4 ℃低温胁迫条件下,随着处理时间的延长,UFA/SFA呈先上升后下降趋势,胁迫处理9 h时UFA/SFA达到最大,为对照的1.44倍;MeJA+4 ℃处理后,不饱和脂肪酸含量远高于饱和脂肪酸含量,UFA/SFA显著上升,在处理6 h时达对照的1.96倍,随后呈不断下降趋势。
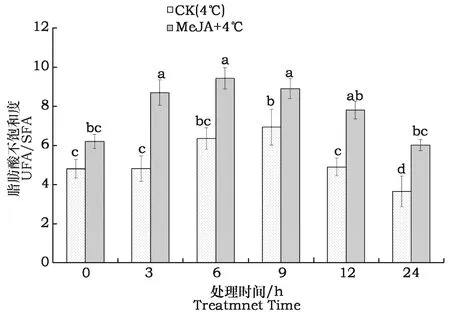
图1 MeJA+4 ℃低温胁迫后各处理紫苏幼苗叶片脂肪酸不饱和度Fig.1 The unsaturation degree of fatty acid (UFA/SFA)in perilla seedling leaves after MeJA+4℃treatment注:图柱上不同小写字母表示各处理间在0.05水平上差异显著。Note:Bar superscripted by different letters are significantly different among various treatments at P<0.05.
2.3 MeJA对低温胁迫下紫苏幼苗叶片相对电导率及丙二醛含量的影响
相对电导率和丙二醛(MDA)含量是衡量植物细胞膜受伤害程度的重要指标,可以进一步反映逆境胁迫下细胞膜的完整性和稳定性。随着低温胁迫时间的延长,4 ℃和MeJA+4 ℃两种处理后,各处理的相对电导率和MDA含量都有显著增加,但经过外源MeJA处理后再进行4 ℃低温胁迫时,相对电导率和MDA含量都比直接进行低温胁迫时显著降低(图2),说明在外源MeJA处理下细胞膜完整性较好。

图2 MeJA+4 ℃低温胁迫后各处理紫苏幼苗叶片相对电导率和丙二醛含量Fig.2 Relative conductivity and MDA content in perilla seedling leaves after MeJA+4 ℃ treatment注:图柱上不同小写字母表示各处理间在0.05水平上差异显著。Note:Bar superscripted by different letters are significantly different among various treatments at P<0.05.
2.4 MeJA对低温胁迫下紫苏幼苗叶片FAD3基因表达的影响
基于实时荧光定量PCR技术分析4 ℃和MeJA+4 ℃两种处理后,FAD3基因的表达模式(图3)。在4 ℃低温胁迫下,随着胁迫时间的延长,FAD3基因的表达量略有升高,而经过MeJA+4 ℃处理不同时间后,该基因的表达量有显著差异,在处理3 h时达到最高,为对照的15.9倍,是4 ℃胁迫3 h时表达量的4.43倍,然后呈下降趋势,到处理后24 h时仍然为对照的6.1倍,其表达量在整个处理过程中整体呈现先升高后降低的趋势。
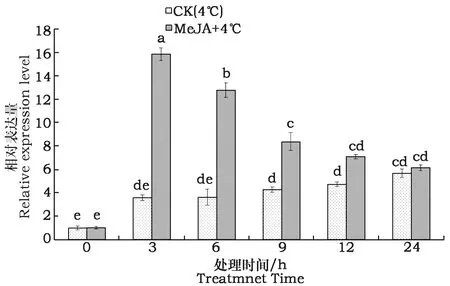
图3 MeJA+4 ℃低温胁迫后各处理紫苏幼苗叶片中FAD3基因的表达特性Fig.3 FAD3 gene expression analysis in perilla seedling leaves after MeJA+4 ℃ treatment注:图柱上不同小写字母表示各处理间在0.05水平上差异显著。Note:Bar superscripted by different letters are significantly different among various treatments at P<0.05.
3 讨论与结论
脂肪酸是植物细胞膜系统的重要组成成分,其中16或18碳的脂肪酸在膜系统中广泛存在。不同植物的膜脂组分和不饱和脂肪酸水平具有物种特异性。研究发现,拟南芥叶片中C16∶0约占总脂含量的15%,C18∶3的含量在50%~60%左右[12],水稻叶片中二者含量占比分别为40%和30%以下[13]。植物膜脂中脂肪酸组分和不饱和度在物种间的差异在一定程度上反映了植物对逆境胁迫的抵抗能力。Zheng等[14]研究结果表明,调节脂肪酸的不饱和程度是植物适应逆境胁迫的重要方式。本研究对不同处理条件下紫苏叶片中脂肪酸的组分及含量进行了测定,结果表明,正常培养的紫苏叶片中C16∶0约占总脂含量的10%,C18∶3的含量为47%,脂肪酸不饱和度(UFA/SFA)达4.8;MeJA+4 ℃处理6 h后,C18∶3的含量急剧上升,高达871.57 mg·g-1,占总脂含量的86%,UFA/SFA增加到9.42,不饱和脂肪酸含量显著增加,进一步增强了紫苏对低温胁迫的抗性。
近年来,由于MeJA在调节植物应激反应和植物发育过程中的重要作用而被广泛关注。低温胁迫通常会导致细胞结构受损,细胞膜完整性被破坏。研究表明使用外源MeJA处理后可以提高植物的抗冷性[15,16]。马晓寒等[16]研究发现在低温条件下喷施10 μmol·L-1MeJA能使烟草叶片中相对电导率和丙二醛含量降低,增强细胞膜的可塑性,从而提高了烟草幼苗的抗冷性。本试验研究结果也证实了在施用0.025 mmol·L-1外源MeJA后,可以降低紫苏幼苗叶片中相对电导率和丙二醛含量,保持了细胞膜结构的稳定性,这与MeJA处理其他植株的结果相一致。
FAD是植物膜脂中不饱和脂肪酸合成的关键酶,负责调控脂肪酸不饱和度[17,18]。研究表明拟南芥AtFAD8基因的表达受低温胁迫诱导[19],大豆GmFAD3基因也受低温胁迫诱导表达[20]。本试验研究了4 ℃和MeJA+4 ℃两种处理条件下FAD3基因的表达特性,结果表明4 ℃低温胁迫下,随着胁迫时间的延长,FAD3基因的表达量略有升高,而经过MeJA+4 ℃处理不同时间后,该基因的表达量有显著差异,在处理3 h时达到最高,为对照的15.9倍。该研究结果进一步证明低温胁迫诱导紫苏幼苗叶片中FAD3基因的表达,而喷施MeJA后再进行4 ℃处理该基因的表达量急剧上升,从而提高了紫苏叶片中不饱和脂肪酸含量,尤其是亚麻酸的含量,保持细胞膜的稳定性,增强了紫苏幼苗抵抗冷害的能力。
本研究针对外源MeJA是否能在低温胁迫下通过调节紫苏幼苗叶片中脂肪酸组分及含量以及不饱和脂肪酸合成关键酶基因的表达,从而增强紫苏抵抗低温胁迫的能力,为下一步深入探讨紫苏对低温胁迫的响应机制奠定理论基础。

