脱胶条件对盐解丝素蛋白分子量的影响
董悦涵

摘要 丝素蛋白分子量的大小是影响其应用范围及应用价值的重要因素,控制其分子量对丝素蛋白产品的开发至关重要。本文采用碱脱胶法,以不同的脱胶温度(100 ℃和80 ℃)制备2种脱胶蚕丝,以脱胶率来表征其脱胶程度,然后均用2种溶解温度(60 ℃和75 ℃)和相同的溶解体系来溶解一定时间,观察其溶解程度;对不同处理所得的丝素蛋白,采用SDS-PAGE4电泳方法观察其分子量的分布情况,从而研究脱胶条件对盐解丝素蛋白分子量的影响。结果表明,采用碱脱胶法,100 ℃脱胶蚕丝比80 ℃脱胶蚕丝的脱胶得率高;在相同的溶解液和溶解温度下,100 ℃脱胶蚕丝溶解比80 ℃脱胶蚕丝快;相同条件的脱胶蚕丝在不同的溶解温度下,溶解所得的丝素蛋白的分子量分布有所不同;而在相同溶解温度下,不同的溶解时间对分子量分布的影响不大。
关键词 家蚕丝;脱胶;丝素蛋白;分子量
中图分类号 TS141.8 文献标识码 A 文章编号 1007-5739(2019)06-0211-03
蚕丝是一种天然蛋白质长丝,是传统的服装用纤维,由丝素及包覆在外的丝胶构成。随着相关学科的交叉和发展以及人们对蚕丝结构与性能研究的不断深入,丝素与丝胶因其蛋白特性和良好的生物相容性、可降解性而成为备受关注的功能材料,应用领域也由传统的纺织服装拓展到食品、化妆品、生物医药等领域[1-3]。这些研究的技术路线基本上都是将丝素(或丝胶)溶解(或降解)后制成某种成型物(例如粉体、膜材等)。因此,丝素与丝胶的分离成为相关研究中首先需要解决的问题。丝素与丝胶的分离原理是基于丝素不溶于水,而丝胶具有水溶性的特点,在一定作用条件下丝胶溶解,从丝素上脱除下来,从而达到分离的目的,这一过程称为脱胶。常规的脱胶方法[4-6],因所用的助剂不同,可分为酸脱胶、碱脱胶、酶脱胶、皂脱胶、高温高压脱胶及复合脱胶等,本文采用碱脱胶法。
由于丝素是高分子质量的蛋白质,蛋白分子量的大小是影响其应用范围及应用价值的重要因素。因此,控制分子质量对丝素蛋白产品的开发至关重要[7-8]。本文采用SDS-PAGE电泳技术分析不同条件溶解体系制取的丝素蛋白的分子质量,探讨调控丝素蛋白分子质量的方法。
1 材料与方法
1.1 试验材料
1.1.1 材料。家蚕茧;透析袋(截留分子量8~14 kDa),由上海源叶生物科技有限公司生产。
1.1.2 试剂。脱胶及溶解所用试剂:无水碳酸钠、无水氯化钙、无水乙醇均为分析纯。SDS-PAGE电泳所用试剂:丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠、三羟甲基氨基甲烷、过硫酸铵、四甲基乙二胺、巯基乙醇、溴酚蓝、甘油、冰乙酸、甲醇、考马斯亮蓝、甘氨酸等;标准蛋白Marker(分子质量在2~200 kDa,上海捷瑞生物工程有限公司)。
1.1.3 仪器与设备。移液枪、温度计、离心管、AR2140(电子天平梅特勒-托利多仪器有限公司)、HH-2(数显恒温水浴锅常州国华电器有限公司)、DGG-9070A(电热恒温鼓风干燥箱上海森信实验仪器有限公司)、TG16-WS(高速离心机上海卢仪)、JY200C(电泳仪北京君意东方电泳设备有限公司)。
1.2 试验方法
本文采用碱脱胶法,并用聚丙烯酰胺凝胶电泳技术鉴定不同条件溶解体系的丝素蛋白分子量。
1.2.1 蚕茧的脱胶。100 ℃脱胶蚕丝制备:取10 g蚕茧,5 g无水碳酸钠,投入1 000 mL沸水中,水浴45 min,捞出脱胶蚕丝,用等量(1 L)的蒸馏水清洗3~4遍,拧干,蓬松放入干燥箱中风干(45 ℃,过夜)。
80 ℃脱胶蚕丝制备:取10 g蚕茧,5 g无水碳酸钠,1 000 mL水沸腾后冷却至80 ℃再投入,水浴30 min,捞出脱胶蚕丝,用清水清洗3~4遍,再放原脱胶液中,水浴30 min,捞出,用蒸馏水清洗,拧干,蓬松放入干燥箱中风干(45 ℃,过夜)。
1.2.2 脱胶率的计算。计算公式如下:
D(%)=100×(W0-W)/W0
式中,D为脱胶率,W0、W分别为蚕茧脱胶前、后的干重。
干重的称量条件:材料晾干后置于鼓风干燥箱中,在105 ℃下干燥,取出放入干燥平皿中冷却至室温后称量。每种脱胶方案重复3次,取3次试验结果的平均值。
1.2.3 絲素蛋白溶液物理现象的观察。采用CaCl2-EtOH-H2O为溶解液[9-10]。在60 ℃溶解温度下,5 g的100 ℃和80 ℃脱胶蚕丝,均置于盛有23 g 无水氯化钙、23.8 mL无水乙醇及30 mL蒸馏水的锥形瓶中,溶解时间设置40、60、90 min 3个水平,观察其物理现象并记录。在75 ℃溶解温度下,5 g的100 ℃和80 ℃脱胶蚕丝,均置于盛有23 g 无水氯化钙、23.8 mL无水乙醇及30 mL蒸馏水的锥形瓶中,溶解时间设置40、60、90 min 3个水平,观察其物理现象并记录。丝素蛋白溶液物理现象观察:将盛有已处理过的丝素蛋白溶液的玻璃容器,对光观察其颜色,用溶液中是否含有颗粒状来判断其溶解程度。
将上述溶解后的液体,装入透析袋中放置透析缸中进行透析,透析3 d,每天换1次水,除去其中的盐和乙醇,最后利用分离技术将丝素蛋白与杂质分离,得到纯化的丝素蛋白。
1.2.4 丝素蛋白分子量检测。采用SDS-PAGE凝胶电泳方法[11]检测。配制15%分离胶和5%浓缩胶。取12 μL样品蛋白溶液于EP管内,加3 μL样品缓冲液,加样前在沸水中加热3 min,再加入溴酚蓝5 μL。采用JY-SCZ2+型直板电泳槽,每孔加样量20 μL。用30 mA电流完成浓缩胶电泳过程,再把电流调至20 mA,完成分离胶电泳过程。电泳结束后用考马斯亮蓝染色,再用脱色液(冰乙酸100 mL、甲醇100 mL,加蒸馏水定容至1 000 mL)进行脱色。最后用扫描仪器拍胶。
2 结果与分析
2.1 不同处理温度对蚕茧脱胶率的影响
从表1可看出,100 ℃脱胶蚕丝的脱胶率比80 ℃高。有文献报道,脱胶率>30%说明蚕丝脱胶完全[4]。由此可见,在80 ℃温度下进行的脱胶并不完全,其中脱胶蚕丝还残留部分丝胶。因此,应根据不同的用途选择不同的温度和时间进行脱胶。
2.2 不同脱胶蚕丝在不同温度溶解的物理现象
据文献报道,丝素蛋白溶液是乳白色的,如果溶液呈浅黄色,说明其中的氨基酸被脱出来[4]。由表2可知,100 ℃下脱胶蚕丝就出现此现象,可能是由于脱胶温度过高,导致蚕丝蛋白中的氨基酸脱出。因此,最后丝素蛋白溶液的颜色与脱胶的温度和脱胶时间有关,与溶解温度和溶解时间无关;而溶解程度与溶解温度、溶解时间有关。也可得出,100 ℃脱胶蚕丝的溶解液分子量要小于80 ℃脱胶蚕丝的溶解液的。
从表2可以看出,相同的100 ℃温度下脱胶蚕丝在60 ℃水浴条件下的完全溶解时间为90 min,而80 ℃的脱胶蚕丝要在75 ℃水浴温度下,需要60 min才能溶解完全。100 ℃脱胶蚕丝和80 ℃脱胶蚕丝在相同溶解温度下,100 ℃脱胶蚕丝比80 ℃脱胶蚕丝溶解所用的时间短,其原因是80 ℃脱胶丝还有残留丝胶,导致其所需溶解时间长和溶解温度高。因此,可以得出100 ℃脱胶蚕丝最佳溶解温度为60 ℃,时间为90 min;80 ℃脱胶蚕丝最佳溶解温度为75 ℃,时间为60 min。
2.3 不同条件溶解体系制取的丝素蛋白的分子量
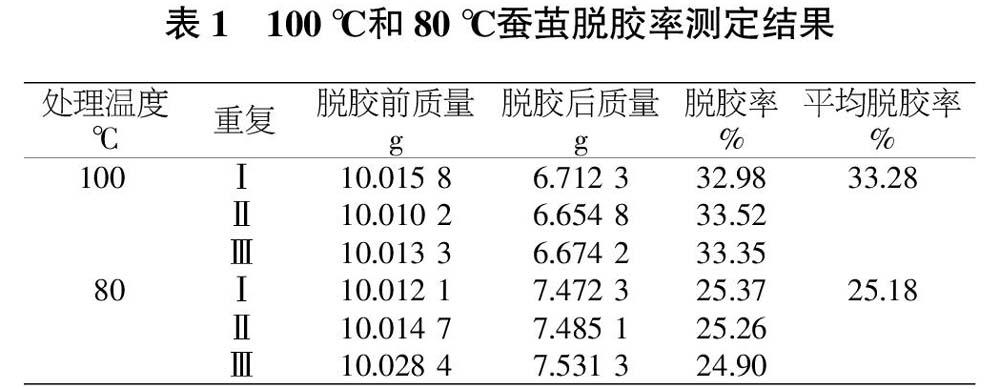
采用SDS-PAGE凝胶电泳方法进行检测。图1~4中颜色较深的表示蛋白质聚集的较多,颜色较浅的表示蛋白质聚集的少。由图1可知,100 ℃脱胶蚕丝在75 ℃水浴下溶解,分子量在15~31 kDa之间,随着时间变化,对分子量大小的影响可忽略。
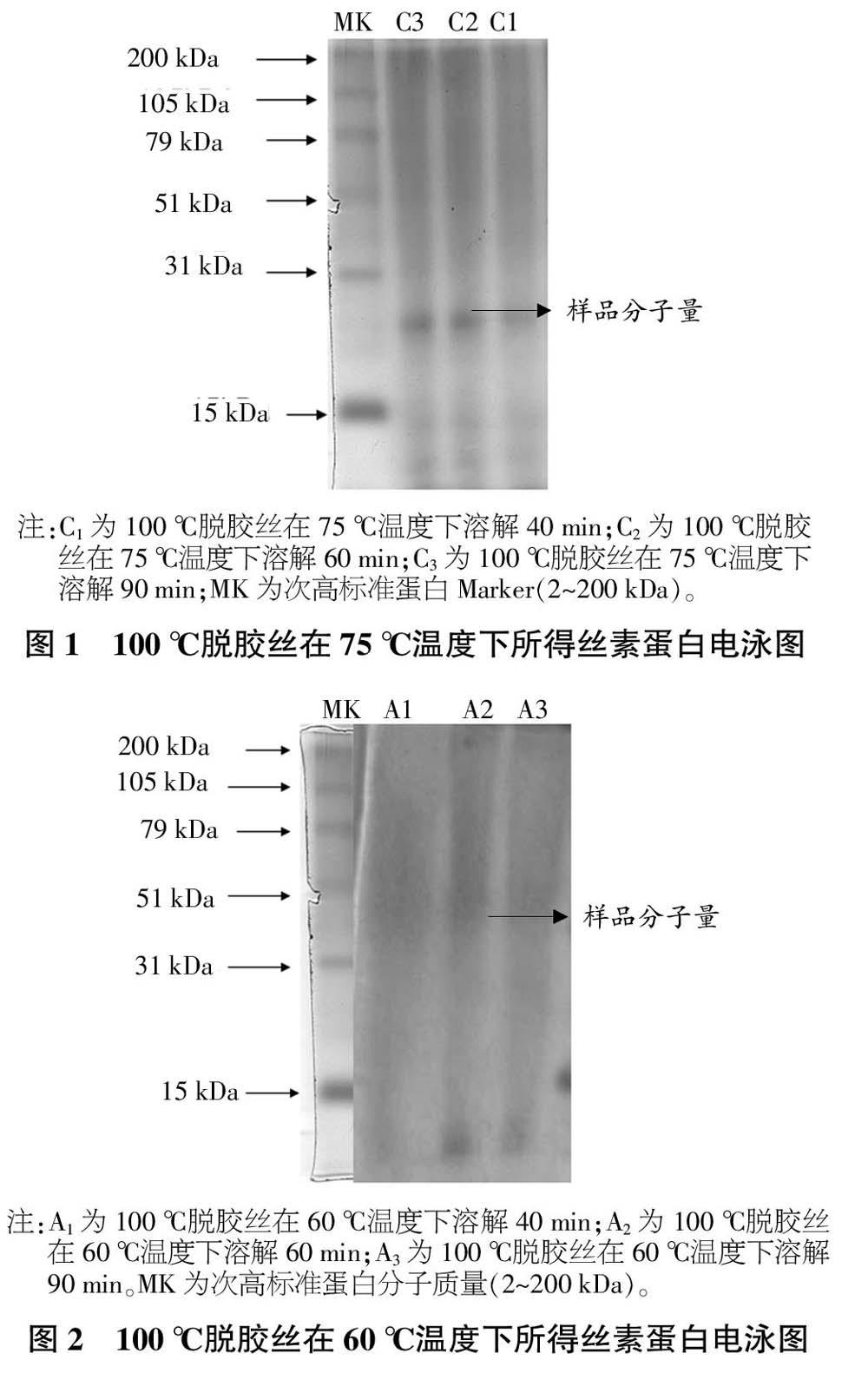
由图2可知,100 ℃脱胶蚕丝在60 ℃水浴下溶解,分子量在31~51 kDa之间,随着时间变化,对分子量大小的影响可忽略。
由图3可知,80 ℃脱胶蚕丝在60 ℃水浴下溶解,分子量在51~79 kDa之間,随着时间变化,对分子量大小的影响可忽略。
由图4可知,80 ℃脱胶蚕丝在75 ℃水浴下溶解,分子量在51 kDa处,随着时间变化,对分子量大小的影响变化可忽略。
从图1~4可以看出,脱胶蚕丝在不同的水浴温度下溶解,对分子量有影响,不论水浴温度高低,80 ℃脱胶蚕丝分子量比100 ℃脱胶蚕丝高;脱胶蚕丝在相同水浴温度、不同溶解时间下溶解,对分子量的影响可忽略。
3 结论与讨论
本文探讨了不同条件的脱胶蚕丝在脱胶时的优化条件及不同处理对丝素蛋白分子量的影响。试验结果表明,在采用碱脱胶法下,100 ℃脱胶蚕丝脱胶得率比80 ℃脱胶蚕丝高。而在相同的溶解液和相同的溶解温度下,100 ℃脱胶蚕丝比80 ℃脱胶蚕丝溶解快。100 ℃脱胶蚕丝溶解后,丝素蛋白溶液的颜色为浅黄色,80 ℃脱胶蚕丝溶解后,丝素蛋白溶液的颜色为乳白色。采用SDS-PAGE凝胶电泳测分子量,得出相同条件的脱胶蚕丝在不同的溶解温度下,对分子量有影响(溶解所得的丝素蛋白的分子量有所不同);而相同的溶解温度下,不同的溶解时间对分子量的影响不大。
由于时间和试验条件有限,本研究只是进行了初步试验,还可在溶解液、溶解温度梯度等方面进一步研究。蛋白分子量的大小是影响其应用范围及应用价值的重要因素,因而控制分子量对丝素蛋白产品的开发至关重要。
4 参考文献
[1] 朱正华,陆旋,朱良均.丝素蛋白溶液乳化性质的研究[J].蚕业科学,2007,33(2):250-254.
[2] 陆旋,朱正华,周晓红.促细胞生长再生复合丝素蛋白电纺丝非织布的性能[J].蚕业科学,2010,36(1):97-101.
[3] 谢瑞娟,李明忠,卢神州,等.丝胶及其溶解性能探讨[J].丝绸,2005(1):22-24.
[4] 王英健.几种脱胶方法的比较研究[J].安徽农业科学,2008,36(33):14623-14624.
[5] 李维贤,赵耀明,汪朝阳,等.蚕茧的高温高压水脱胶研究[J].纺织学报,2003,24(2):76-78.
[6] 张雨青.蚕丝脱胶方法的比较分析[J].蚕业科学,2002,28(1):75-78.
[7] 王洪,刘娜,邵惠丽,等.蚕腺体内和再生丝素蛋白水溶液的性能研究[J].化学通报,2005(8):613-617.
[8] 刘明,闵思佳,朱良均.冷冻干燥对丝素蛋白凝胶结构的影响[J].蚕业科学,2007,33(2):246-249.
[9] 田娟,杨华,马林,等.蚕丝不同溶解方法的研究[J].化学世界,2010(11):665-668.
[10] 吴章伟,冯新星,朱海霖,等.不同溶解体系的丝素蛋白分子质量及对再生丝素膜性能的影响[J].蚕业科学,2010,36(4):707-712.
[11] 郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,1999:132-140.

