一种三氮唑双席夫碱对N80钢在HCl介质中的缓蚀作用
(东营市环境保护局,东营 257000)
金属是现代社会中使用最广泛的工程材料,但金属易与周围介质发生反应从而导致腐蚀。多数情况下,腐蚀作用从金属局部表层开始,逐步延伸至金属的整体与内部。金属腐蚀不仅会给国民经济带来巨大损失,还会造成严重的安全隐患以及一系列环境污染等问题。添加缓蚀剂是众多金属防腐蚀的方法之一。缓蚀剂防腐蚀具有用量少、适应性强、使用方便等诸多优点[1]。缓蚀剂的种类繁多,常见的有咪唑啉类、曼尼希碱类、季铵盐类、炔醇类、吡啶类、席夫碱类等。其中,席夫碱类缓蚀剂分子中的亚胺基(RC=N)以及N、O等杂原子可以与金属形成配位键,使其吸附在金属表面从而形成致密的疏水分子膜,可有效抑制酸液对金属的腐蚀[2-5]。双席夫碱缓蚀剂分子中含有两个亚氨基,能够引入更多的官能团,从而含有更多的杂原子以及更强的离域π键,理论上能够更加有效地吸附在金属表面,具有相对更好的缓蚀性能[6-8]。目前,对于双席夫碱化合物用作缓蚀剂的报道并不多见[9]。3-氨基-1,2,4-三氮唑是一种用途广泛的有机合成中间体,属唑类有机物,对环境无害,但其作为缓蚀剂的研究报道并不多,将三氮唑席夫碱化合物作为缓蚀剂的研究报道则更少见[10]。本工作以对苯二甲醛和3-氨基-1,2,4-三氮唑为原料,合成了一种三氮唑双席夫碱化合物,并采用静态失重法、动电位极化曲线、电化学阻抗谱及扫描电镜等方法,探讨了该缓蚀剂在1 mol/L HCl溶液中对N80钢的缓蚀性能。
1 试验
试验用缓蚀剂三氮唑双席夫碱化合物(TSB)为实验室合成[11]。具体合成步骤如下:在500 mL三颈烧瓶中加入0.25 mol对苯二甲醛和250 mL甲醇以及少量乙酸,搅拌下加热至回流,待对苯二甲醛完全溶解后,加入0.5 mol 3-氨基-1,2,4-三氮唑,继续加热回流反应6 h;冷却后抽滤,滤饼用甲醇、乙醚洗涤,干燥后得浅黄色粉末即为TSB。TSB的分子结构及合成路线见图1。

图1 TSB的分子结构及合成路线图Fig.1 Chemical structure and synthetic route of TSB
试验钢为N80钢片,其化学成分(质量分数)为:0.036%C,1.55%Mn,0.16%Si,0.021%S,0.19%Mo,0.18%Cr,0.007%P,余量为Fe。将N80钢片切割成尺寸为30 mm×15 mm×3 mm的试样,用金相砂纸逐级(至1200号)打磨试样表面,随后用乙醇、丙酮擦洗干净,冷风吹干,真空干燥24 h后称量。然后将处理过的试样置于1 mol/L HCl溶液中浸泡6 h。采用失重法计算试验钢的腐蚀速率v,如式(1)所示,结果取3次试验的平均值,再根据腐蚀速率计算缓蚀率ηv,如式(2)所示。
(1)
(2)
式中:m0、m分别为试样腐蚀前后的质量,g;A为挂片的表面积;t为腐蚀时间;v0、v分别为溶液中未添加和添加缓蚀剂后试样的腐蚀速率,mg/(cm2·h)。
电化学试验在IviumStat电化学工作站上采用三电极体系进行。N80钢片为工作电极,工作面积为1 cm2,非工作面用环氧树脂密封;铂电极为辅助电极;饱和甘汞电极为参比电极。试验介质为不同温度且添加了不同量TBS缓蚀剂的1 mol/L HCl溶液。电化学阻抗谱测量时,初始电位为工作电极浸泡30 min后的开路电位,交流信号幅值为10 mV,频率范围为 10-2~105Hz;极化曲线测量时,扫描速率为0.3 mV/s,扫描范围为-250~+250 mV(相对开路电位)。
采用FEI Inspect F扫描电镜观察试片腐蚀前后的表面形貌。
2 结果与讨论
2.1 温度与缓蚀剂含量对缓蚀率的影响
由图2中可以看到:在1 mol/L HCl溶液中,缓蚀率随TSB含量的增加显著升高,但当TSB浓度达到2.0 mmol/L后,缓蚀率变化不明显。这是因为随着TSB含量的增加,其在钢片表面的吸附量增大,当吸附量达到饱和后,继续增加缓蚀剂的含量,吸附量基本保持不变,缓蚀率也就不再发生明显变化[12]。随温度升高,缓蚀率总体呈现出下降趋势,当温度为298 K,TSB浓度为2.0 mmol/L时,腐蚀速率为0.021 mg/(cm2·h),此时缓蚀率可达到96.0%。当温度从298 K升高到328 K,缓蚀率却依次下降,这是由于随着温度的升高,大量的金属离子在金属表面生成,加速进入溶液中,导致TSB在金属表面的脱附速率大于吸附速率,TSB难以在金属表面形成稳定的吸附膜,最终导致缓蚀率下降[13]。

图2 在1 mol/L HCl溶液中温度和TSB含量对N80钢缓蚀率的影响Fig.2 Effects of temperature and TSB concentration on inhibitor efficiency in 1 mol/L HCl solution
2.2 动力学分析
采用不同温度下得到的腐蚀速率,分析TSB对N80钢腐蚀反应动力学的影响。根据Arrhenius公式,lnv与1/T成如下关系[14]:
(3)
式中:v为腐蚀速率,mg/(cm2·h);Ea为表观活化能,kJ/mol;T为热力学温度,K;A为指前因子;R为理想气体常数,8.314 J/(mol·K)。
以1/T和lnv为横纵坐标作图,并对其进行线性拟合,结果见图3。由图3可看出:各拟合直线的斜率有所变化,这表明缓蚀剂在金属表面的吸附行为会受温度的影响。拟合直线斜率为-Ea/R,可通过直线斜率求得Ea,由直线的截距可以求得A,Ea与A值见表1。从表1可以看出,相对于不含TSB的空白HCl溶液,在添加TSB的HCl溶液中Ea明显增大,且Ea随着缓蚀剂含量的增加而增大,这表明吸附于N80钢表面的缓蚀剂提高了腐蚀反应的能垒,抑制了腐蚀反应的发生[15-17]。

图3 N80钢在含有不同量TSB的1.0 mol/L HCl溶液中的Arrhenius曲线Fig.3 Arrhenius plots for N80 steel in 1.0 mol/L HCl solution containing different concentrations of TSB

表1 N80钢在含不同量TSB的1.0 mol/L HCl溶液中的热力学参数Tab.1 Thermodynamic parameters of N80 steel in 1 mol/L HCl solution containing different concentrations of TSB
以1/T与ln(v/T)为横纵坐标作图,线性拟合后得图4。腐蚀反应过程中的活化焓和活化熵可由过渡态方程计算得到,如式(4)所示。
(4)
式中:h为普朗克常数,6.63×10-34J·s;N为阿伏伽德罗常数,6.02×1023;R为理想气体常数,8.314 J/(mol·K);ΔHa为活化焓,kJ/mol;ΔSa为活化熵,J/(mol·K)。
由ln(v/T)-1/T直线的斜率可以求得ΔHa,由该直线的截距可以求得ΔSa,结果见表1。由表1可知:在不同TSB含量下,ΔHa均为正值,这表明整个腐蚀过程是吸热过程[18-19];加入缓蚀剂后ΔHa值显著增大,说明随着HCl介质中TSB含量的升高,发生腐蚀反应的能量障碍增大,缓蚀率提高[15-16]。ΔHa与Ea的关系如图5所示。二者关系可由热力学方程[20]解释,见式(5)。
ΔHa=Ea-RT
(5)

图4 N80钢在含不同量TSB的1.0 mol/L HCl溶液中的过渡态方程Fig.4 Transition state equation for N80 steel in 1.0 mol/L HCl solution containing different concentrations of TSB

图5 活化焓与活化能的关系Fig.5 Relationship between activation enthalpy and activation energy
腐蚀反应过程中的熵变为负值,说明缓蚀剂分子与金属表面相互作用的活化络合反应由分离步骤决定,而不是缓蚀剂分子与金属表面的结合步骤[16,21-22]。添加缓蚀剂后,活化熵增大,意味着体系的混乱度增大。值得注意的是,在添加缓蚀剂后,指前因子A和活化熵的值同样是增大的,这说明除了受Ea和ΔHa的影响外,腐蚀反应还与A和活化熵有关[20]。
2.3 吸附模型
利用静态失重法所得数据,计算表面覆盖度θ,进一步研究TSB在钢片表面的吸附行为,表面覆盖度计算公式为
(6)
式中:Δm0,Δm分别为不加缓蚀剂和加入缓蚀剂时挂片的质量损失。将θ代入Langmuir吸附等温式
(7)
式中:c为缓蚀剂的浓度,mol/L;Kads为吸附平衡常数,L/mol。

(8)
式中:R为气体常数,8.314 J/(mol·K);T为热力学温度,K;55.5为水分子的浓度,mol/L。
(9)
(10)

图6 不同温度1mol/L HCl溶液中TSB在N80钢表面Langmuir吸附曲线Fig.6 Langmuir adsorption plots of TSB on surface of N80 steel in 1 mol/L HCl solution at different temperatures

表2 N80钢在不同温度含TSB的1mol/L HCl溶液中的热力学参数Tab.2 Thermodynamic parameters of N80 steel in 1 mol/L HCl solution containing TSB at different temperatures
2.4 电化学阻抗谱
由图7可见:N80钢在298 K含有不同量TSB的1 mol/L HCl溶液中的Nyquist图呈一个被压扁的容抗弧,这是由电极界面粗糙和不均一性等引起的弥散效应造成的[12];随着TSB含量的增加,容抗弧直径逐渐增大,容抗弧半圆与横轴的交点即电极表面的电荷传递电阻Rct也逐渐增大,这表明该缓蚀剂在钢片表面形成了有效的保护膜,有效抑制了金属的腐蚀[24]。通过电荷传递电阻计算体系的缓蚀率,计算公式见式(11)。
(11)

采用图 8 所示的等效电路对电化学阻抗谱进行拟合,拟合结果见表3。图8中Rs为溶液电阻;Rct为电荷传递电阻,反映了碳钢表面腐蚀电化学反应的难易程度,Rct越大,碳钢表面的腐蚀越难发生;Cdl为界面双层电容。由表3可以看出,在1 mol/L HCl溶液中TSB能够有效抑制N80钢的腐蚀。

图7 N80钢在含不同量TSB的1 mol/L HCl溶液中的Nyquist图(298 K)Fig.7 Nyquist plots of N80 steel in 1 mol/L HCl solution containing different concentrations of TSB (298 K)
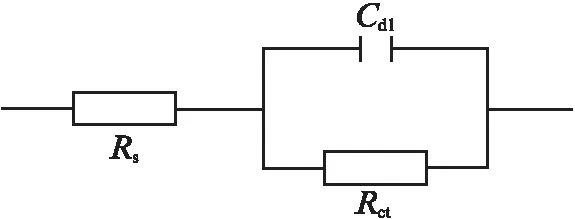
图8 N80钢在含不同量TSB的1 mol/L HCl溶液中电化学阻抗谱的等效电路Fig.8 Equivalent circuit of EIS of N80 steel in 1 mol/L HCl solution containing different concentrations of TSB

表3 N80钢在含不同量TSB的1 mol/L HCl溶液中电化学阻抗谱的拟合参数(298 K)Tab.3 Fitted parameters of EIS of N80 steel in 1 mol/L HCl solution containing different concentrations of TSB (298 K)
2.5 极化曲线
图9为N80钢在含不同量TSB的1 mol/L HCl溶液中的极化曲线,对极化曲线的弱极化区进行拟合,并根据自腐蚀电流密度计算缓蚀率ηJ,计算公式见式(12),结果见表4。
(12)

由图9和表4可以看出:随着TSB含量的增大,自腐蚀电位向正方向移动,自腐蚀电流密度明显降低,这说明缓蚀剂同时抑制了阴阳两极反应,所以TSB为混合抑制型缓蚀剂,推断其作用机理为“几何覆盖效应”[5,12];当TSB浓度为2.0 mmol/L时,缓蚀率达到最大(94.5%),显示了其良好的缓蚀性能。通过自腐蚀电流密度计算得到的缓蚀率结果与通过腐蚀速率、电荷转移电阻计算得到的缓蚀率变化趋势是一致的。

图9 N80钢在含不同量TSB的1 mol/L HCl溶液中的极化曲线(298 K)Fig.9 Polarization curves of N80 steel in 1 mol/L HCl solution containing different concentrations of TSB (298 K)

表4 N80钢在含不同量TSB的1 mol/L HCl溶液中极化曲线的拟合参数(298 K)Tab.4 Fitted parameters of polarization curves of N80 steel in 1 mol/L HCl solution containing different concentrations of TSB (298 K)
2.6 腐蚀形貌
由图10可见:在未添加TSB的HCl溶液中浸泡6 h后,N80钢表面变得粗糙不平整,有较多的腐蚀坑,腐蚀非常严重,呈现出典型的金属腐蚀形态;在含TBS的HCl溶液中浸泡6 h后,N80钢表面较平整,腐蚀程度较未加缓蚀剂的大幅度减轻,这是因为TSB在钢表面形成一层致密的保护膜,有效隔离了酸液与钢表面的接触,使得试片表面免受酸液的强烈腐蚀。

(a) 未添加

(b) 添加图10 在未添加和添加2.0 mmol/L TSB的1mol/L HCl溶液中浸泡6 h后N80钢的腐蚀形貌(298 K)Fig.10 Corrosion morphology of N80 steel immersed in 1 mol/L HCl solution without (a)and with (b)2.0 mmol/L TSB for 6 h (298 K)
3 结论
(1)TSB 能较好地抑制 N80 钢在 1 mol/L HCl 溶液中的腐蚀,随着TSB含量的增大,缓蚀率逐渐升高;随着酸性介质温度升高,缓蚀率减小。
(2)TSB为混合抑制型缓蚀剂,能同时抑制N80钢的阳极溶解和阴极析氢反应。
(3)TSB分子在 N80 钢表面吸附符合 Langmuir吸附模型,为单分子层吸附。
(4)TSB在N80钢表面的吸附是物理吸附和化学吸附共同作用的结果,且以化学吸附为主。

