云芝提取物对小鼠酒精性肝损伤的拮抗作用研究
冯耀培,曲正义,金银萍,李红钰,李渊,郑斯文,王英平
(中国农业科学院特产研究所,长春 130112)
酒精性肝病(Alcoholic liver disease,ALD)是通过饮用酒精类饮料所导致的肝损伤的一种疾病,其损伤程度与酒精摄入量和饮用时间呈正相关。酒精性肝损伤分为轻症酒精性肝病、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化,严重者可演化为肝癌[1]。近年来,我国酒精性所导致的肝损伤现象逐年上升,ALD已成为仅次于病毒性肝炎的第二大元凶[2]。酒精性肝损伤会导致肝硬化、肝衰竭等多种肝病的发生[3],因此,建立酒精性肝损伤模型,开展中药对肝损伤的保护性以及缓解或治疗急慢性肝病的研究意义深远。
云芝是多孔菌科真菌彩绒革盖菌〔Coriolusversicolor(L.ex Fr.)Quel〕的干燥子实体,全国各地均有分布,东北地区为主产区,是一种常用中药,收载于《中国药典》2015年版一部[4]。云芝的主要活性成分为云芝多糖,具有多种生物活性。已有研究表明,云芝多糖具有治疗实验性肝病的作用[5-6],但对于酒精性肝损伤的研究较少,王康乐等[7]初步探讨了云芝组分对酒精肝损伤小鼠的保肝活性。本试验通过给药云芝提取物(Coriolusversicolor extracts,CVE)对小鼠进行肝脏预防性保护,然后建立急性酒精肝损伤模型,评价肝脏损伤程度、肝脏功能、脂肪含量及抗氧化酶活性,并探讨CVE对酒精性肝损伤的预防作用。
1 材料与试剂
1.1 材料
SPF级雄性ICR小鼠,60只,6~8周,体重18~22g,购于长春市亿斯实验动物技术有限公司,许可证号SCXK(吉)-2015-0001;水飞蓟素(纯度≥98%,陕西森弗天然制品有限公司);云芝提取物由中国农业科学院特产研究所新药创制实验室提取(纯度≥85%)。
1.2 试剂
谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒、丙二醛(MDA)试剂盒、甘油三酯(TG)试剂盒、总胆固醇(T-CHO)试剂盒、低密度蛋白胆固醇(LDL-C)试剂盒、高密度蛋白胆固醇(HDL-C)试剂盒、超氧化物岐化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、过氧化氢酶(CAT)试剂盒(南京建成生物工程研究所);其他试剂(国药集团化学试剂有限公司)。
1.3 仪器
离心机(TGL-16K,湖南湘仪离心机厂);酶标仪(BioTek-Epoch,美国 BioTek公司);超声波清洗器(SK5200H,上海科导超声仪器有限公司);恒温水浴锅(HH-4,常州澳华仪器公司);电子天平(FA1004B、YP5002,上海越平科学仪器有限公司);包埋机(LEICA EG 1150H)、切片机(LEICA RM2255)(德国徕卡公司);摊片机(KD-T,浙江省金华市科迪仪器设备有限公司);组织匀浆破碎仪(Coyote-Bio G200,卡尤迪生物科技有限公司);光学显微镜〔BX53,奥林巴斯(中国)有限公司〕。
2 方法
将60只雄性小鼠适应性饲养5 d,充足饮食后随机分为正常对照组、模型组、CVE低〔50mg/(kg·d)〕、中〔100 mg/(kg·d)〕、高〔300 mg/(kg·d)〕剂量组和阳性对照组(50mg/kg水飞蓟素)。试验期间,保持动物饲养温度为(25±2)℃,自由饮食。给药前将小鼠称重,隔天称重1次,灌胃周期为30 d,末次给药后禁食、不禁水12h。除正常对照组外,其余各组均采用50%乙醇以14mL/kg的剂量,建立酒精性急性肝损伤模型[8]。24 h后解剖。摘眼球取血,测定血清相关生理生化指标。处死小鼠后进行解剖,取肝脏,用4℃生理盐水洗净,在滤纸上吸干水分,然后,将小鼠肝脏左叶剪下,置于10%中性福尔马林溶液中固定,以备病理学研究;将剩余肝组织置于液氮中,匀浆后检测肝组织相关指标。
2.1 血清生理生化指标的检测
血液样品4℃冰箱内静置2h,冷冻离心机3500r/min离心10min,吸取上清,将血清按照各指标所需样品量进行分装并标记,置于 20℃冰箱内,检测血清ALT、AST、MDA、T-CHO、TG、LDL-C、HDL-C 等生理生化指标,检测方法严格按照试剂盒说明书进行操作。
2.2 肝组织的病理变化
取固定的肝组织,切规则方形小块(0.5 cm 1.0 cm 0.5cm),置于包埋盒内,流水冲洗,脱水,透明,浸蜡,包埋。将切片苏木精-伊红(HE)染色,在光学显微镜下观察各组小鼠肝组织的病理变化。
2.3 肝组织相关指标的检测
取置于液氮内保存的肝组织样本,制成10%浓度的组织匀浆,检测蛋白质含量、MDA含量及SOD、CAT、GSH-Px活性等指标,检测方法严格按照试剂盒操作说明书进行。
2.4 数据统计与分析
采用SPSS22.0统计软件对试验数据进行统计与分析,结果均以表示,多组间比较采用单因素方差分析(One-way ANOVA),两组间比较采用T-test检验分析,P<0.05表示差异显著。
3 结果与分析
3.1 CVE对酒精性肝损伤小鼠肝脏组织病理变化的影响
HE染色结果显示,正常对照组小鼠中央静脉及其周围肝细胞圆润,细胞索清晰可见,细胞核呈现规则圆形,核质分布均匀,胞质丰富,肝细胞胞浆未见脂肪变性及气球样变,肝细胞无坏死、无炎性浸润等现象(图1A);模型组小鼠肝组织损伤严重,中央静脉周围可见细胞呈现碎片状坏死,坏死的细胞出现核固缩、溶解、消失现象(图1 B),表明急性酒精性肝损伤模型造模成功;CVE低、中剂量组出现轻微肝细胞脂变、炎性浸润现象(图1D、E);阳性对照组及CVE高剂量组小鼠肝组织细胞核清晰完整,肝细胞无坏死及炎性浸润现象,肝组织细胞损伤状况得到明显改善,且 CVE高剂量组小鼠部分肝细胞出现细胞再生现象(图1 F)。

图1 CVE对小鼠肝脏病理形态的影响(比例尺=40 m)Fig.1 Effects of CVEon the liver'spathological morphology in mice(scal bar=40 m)
3.2 CVE对酒精性肝损伤小鼠血清生理生化指标的影响
表1 CVE对小鼠血清AST、ALT活性的影响Table 1 Effects of CVEon AST and ALT activities in the serum of mice (,n=10)

表1 CVE对小鼠血清AST、ALT活性的影响Table 1 Effects of CVEon AST and ALT activities in the serum of mice (,n=10)
注:#.与正常对照组相比,差异显著(P<0.05);##.与正常对照组相比,差异极显著(P<0.01);*.与模型组相比,差异显著(P<0.05);**.与模型组相比,差异极显著(P<0.01)。Note:#.Significant differences with normal control group(P<0.05);##.Extremely significant differences with normal control group(P<0.01);*.Significant differences with model group(P<0.05);**.Extremely significant differences with model group(P<0.01).
组别Group剂量〔mg/(kg·d)〕Dose ALT活性(U/L)ALT activity AST活性(U/L)AST activity正常对照组 Normal control group 25.96±1.64 61.86±19.00模型组 Model group 45.25±21.25# 141.16±60.18##阳性对照组 Positivecontrol group 29.42±5.05* 88.80±26.24**CVE低剂量组 Low-dose of CVEgroup 50 24.95±5.94* 71.02±29.06**CVE 中剂量组 Medium-dose of CVEgroup 100 27.88±2.65* 66.22±17.77**CVE高剂量组 High-doseof CVEgroup 300 22.73±8.63* 61.77±17.55**
由表1可知,与正常对照组相比,模型组小鼠血清转氨酶ALT、AST活性均显著升高(P<0.05),说明CVE给药能显著降低血清转氨酶ALT和AST活性(P<0.05),且对二者的降低作用均呈现剂量依赖性,同时CVE高剂量组的效果强于阳性对照组。
表2 CVE对小鼠血清MDA、TG、TC、LDL-C、HDL-C含量的影响Table 2 Effects of CVEon the serum MDA and TGand TCand LDL-Cand HDL-Ccontents in mice (,n=10)
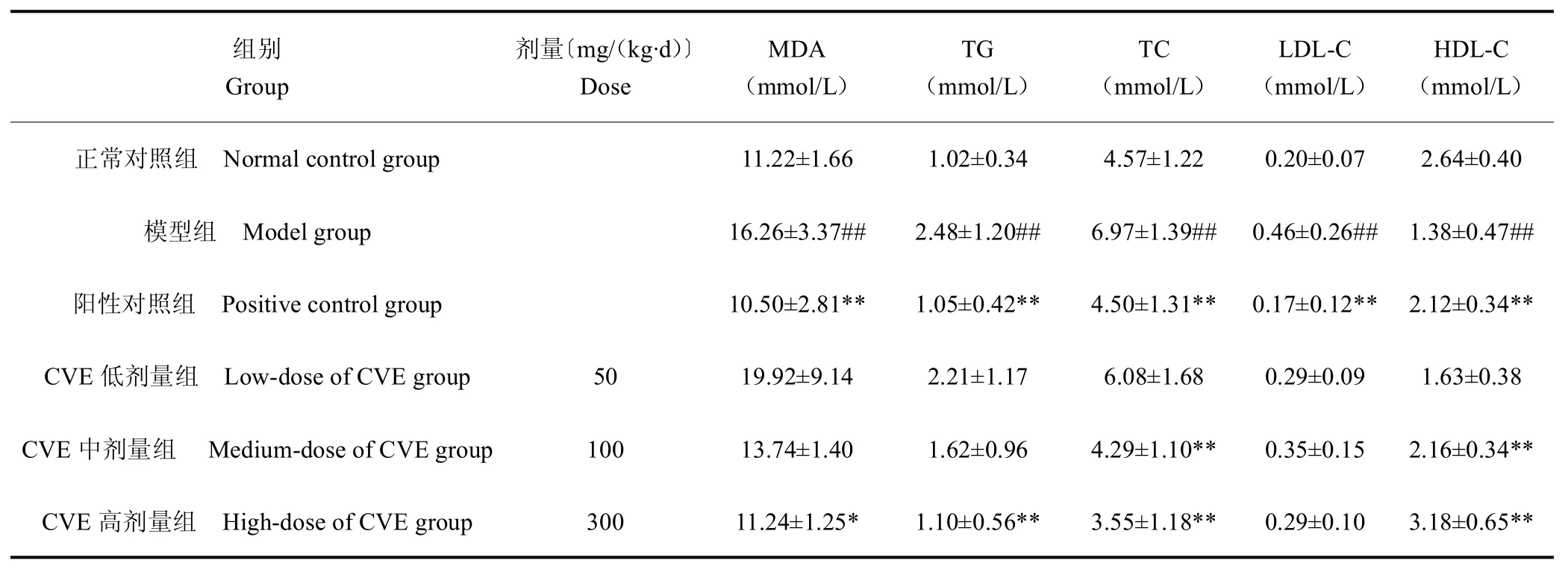
表2 CVE对小鼠血清MDA、TG、TC、LDL-C、HDL-C含量的影响Table 2 Effects of CVEon the serum MDA and TGand TCand LDL-Cand HDL-Ccontents in mice (,n=10)
组别Group剂量〔mg/(kg·d)〕Dose MDA(mmol/L)TG(mmol/L)TC(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)正常对照组 Normal control group 11.22±1.66 1.02±0.34 4.57±1.22 0.20±0.07 2.64±0.40模型组 Model group 16.26±3.37## 2.48±1.20## 6.97±1.39## 0.46±0.26## 1.38±0.47##阳性对照组 Positivecontrol group 10.50±2.81** 1.05±0.42** 4.50±1.31** 0.17±0.12** 2.12±0.34**CVE 低剂量组 Low-doseof CVEgroup 50 19.92±9.14 2.21±1.17 6.08±1.68 0.29±0.09 1.63±0.38 CVE 中剂量组 Medium-doseof CVEgroup 100 13.74±1.40 1.62±0.96 4.29±1.10** 0.35±0.15 2.16±0.34**CVE 高剂量组 High-doseof CVEgroup 300 11.24±1.25* 1.10±0.56** 3.55±1.18** 0.29±0.10 3.18±0.65**
由表2可知,与正常对照组相比,模型组小鼠血清中MDA、TG、TC、LDL-C含量极显著升高(P<0.01),HDL-C含量极显著降低(P< 0.01);阳性对照组MDA、TG、TC、LDL-C含量与模型组相比均显著降低(P<0.01),HDL-C含量明显升高(P<0.01);CVE中、高剂量组MDA含量均低于模型组,CVE各剂量组TG含量低于模型组,且CVE高剂量组MDA和TG含量极显著低于模型组(P<0.01);CVE各剂量组的TC含量均低于模型组,且中、高剂量组TC含量极显著低于模型组(P<0.01);CVE各剂量组HDL-C含量均高于模型组,且中、高剂量组HDL-C含量极显著高于模型组(P<0.01);CVE高剂量组小鼠血清各项指标均高于CVE中、低剂量组及阳性对照组。
3.3 CVE对小鼠酒精性肝损伤肝组织相关指标的影响
表3 CVE对小鼠肝组织SOD、GSH-Px、CAT活性及MDA含量的影响Table 3 Effectsof CVEon SOD ,GSH-Px and CAT activities and MDA content in the liver tissues of mice (,n=10)

表3 CVE对小鼠肝组织SOD、GSH-Px、CAT活性及MDA含量的影响Table 3 Effectsof CVEon SOD ,GSH-Px and CAT activities and MDA content in the liver tissues of mice (,n=10)
组别Group剂量 Dose〔mg/(kg·d)〕SOD(U/mgprot)GSH-Px(U/mgprot)CAT(U/mgprot)MDA(nmol/mgprot)正常对照组 Normal control group 40.40±10.25 3.70±1.04 142.15±23.03 12.53±8.65模型组 Model group 35.13±8.00 2.47±0.97# 111.55±29.80# 32.57±5.63##阳性对照组 Positivecontrol group 51.69±11.10** 2.99±0.72 174.17±40.40** 24.58±8.75*CVE 低剂量组 Low-doseof CVEgroup 50 43.74±22.13 2.76±0.72 205.59±43.60** 28.48±8.34 CVE 中剂量组 Medium-doseof CVEgroup 100 75.35±15.06** 2.43±0.45 210.54±20.94** 27.15±13.37 CVE 高剂量组 High-dose of CVEgroup 300 53.21±16.74** 3.31±0.84* 183.81±35.2** 21.14±7.36**
由表3可知,与正常对照组相比,模型组小鼠肝组织中SOD、CAT、GSH-Px活性降低,其中CAT和GSH-Px活性显著降低(P<0.05);与正常对照组相比,模型组小鼠肝组织中MDA含量极显著升高(P<0.01)。阳性对照组SOD、GSH-Px、CAT活性均高于模型组,其中,SOD、CAT活性极显著高于模型组(P<0.01);阳性对照组小鼠肝组织中MDA含量显著低于模型组(P<0.05)。CVE各剂量组SOD活性均高于模型组,中、高剂量组极显著高于模型组(P<0.01);CVE各剂量组CAT活性均极显著高于模型组(P<0.01);CVE高、低剂量组GSH-Px活性高于模型组,且CVE高剂量组GSH-Px活性显著高于模型组(P<0.05);CVE各剂量组MDA含量均低于模型组,CVE高剂量组MDA含量极显著低于模型组(P<0.01)。CVE高剂量组小鼠肝组织匀浆各项指标均高于CVE中、低剂量组和阳性对照组。
4 讨论
本研究通过酒精灌胃小鼠建立实验动物模型,该方法周期性短、重复性好、死亡率低、稳定性强、可行度高,建模方式与人类饮酒行为类似,对肝组织的损伤特点相似度高[9]。本试验通过观察肝脏病理组织切片发现,模型组肝脏组织细胞出现大量细胞溶解、脱落现象,表示酒精肝损伤模型造模成功。本研究发现,CVE能显著改善酒精造成的肝细胞脱落、溶解以及脂肪变性等现象,且高剂量效果最优。
肝脏损伤最敏感的检测指标是血清ALT、AST活性。在机体中,ALT和AST主要存在于肝细胞内。当肝细胞膜通透性增加时,即使没有出现细胞受损以及坏死现象,细胞内的转氨酶仍然会明显通过较高的浓度差而进入到血液中[10]。当肝细胞出现轻微坏死时,细胞内ALT、AST等就会大量游离出来,致使血清中ALT、AST活性急剧升高,并最终导致肝细胞的坏死。转氨酶活力的升高在一定程度上反映了肝细胞的损伤程度[11-14]。本研究发现,CVE可以显著降低ALT、AST活性,效果优于阳性对照组,且呈现剂量依赖性。
肝细胞内存在完善的抗氧化防御系统,主要由SOD、CAT、GSH-Px等组成的酶反应体系,可以有效清除机体产生的自由基。当产生的自由基超过自身防御系统的清除能力时,就会发生氧化损伤,最为严重的部位为肝脏[15]。当脂质过氧化发生时,会有MDA生成;当MDA含量增加时,会促进肝细胞膜的通透性,加大细胞中的可溶性酶进入血中,从而导致肝细胞膜功能发生改变,加重肝脏损伤,最终导致肝脏病变[16]。因此,SOD、CAT、GSH-Px活性及MDA含量可以作为评价肝脏受到损伤程度的检测指标。通过本试验发现,CVE能够显著增加SOD、CAT、GSH-Px等抗氧化酶活性,降低MDA含量,且整体来看,CVE高剂量组的效果优于CVE中、低剂量组以及阳性对照组。
氧化产物的增加导致机体的氧化还原系统失衡时,会造成MDA、TG、TC、LDL-C等的积累,导致血脂代谢发生紊乱。血脂代谢的紊乱与HDL-C含量异常降低以及LDL-C的含量异常升高有密切关系。马建林等[17]研究发现,当机体内TG含量升高时,常常伴随着HDL-C含量的降低,从而减弱胆固醇从周围组织转运到肝脏中的能力,导致肝脏动脉粥样硬化形成,这会导致TG在肝细胞内大量积聚,进而造成脂肪病变,迫使脂肪转变储脂器官,最终会导致酒精性脂肪肝的形成[18-19]。曹丹等[20]在大红袍水提物对小鼠酒精性肝损伤的研究中发现,灌胃大红袍水提物组小鼠外周组织细胞中胆固醇含量降低,说明大红袍水提物可以有效调节血脂代谢平衡。本试验发现,CVE可使小鼠血清中MDA、TG、TC、LDL-C含量显著降低,HDL-C含量显著升高,且CVE高剂量组的效果优于阳性对照组。
综上所述,云芝提取物可对酒精造成的急性肝损伤起到较好的保护作用,同时,能够维持正常的肝功能与肝内抗氧化酶活性。该研究为中药云芝的药理研究及其开发利用提供了科学依据。

