普罗布考对肾小管上皮细胞氧糖剥夺/复氧损伤的影响及其机制研究
任广伟,龚淼,李明明,牛哲莉,杨洪娟,孙利军*
氧糖剥夺/复氧(OGD/R)细胞模型多被用于在细胞水平上模拟急性缺血-再灌注(I/R)损伤的过程,应用此模型可进行药物保护作用与机制的研究和治疗靶向的探讨[1]。肾I/R 是导致急性肾损伤的常见原因[2],研究发现,肾I/R 损伤引起肾小管上皮细胞死亡的主要方式是坏死与铁死亡,其主要机制是细胞脂质过氧化[3-5]。普罗布考是具有很强抗氧化作用的降血脂药[6],多项研究表明,普罗布考可以通过提高细胞内抗氧化酶活性降低脂质过氧化水平,具有较好的组织或细胞保护作用[7]。目前,尚未见到关于普罗布考对OGD/R 引起的人肾小管上皮细胞株(HK-2)损伤影响的报道。为此,本研究通过建立HK-2 的OGD/R 模型模拟肾小管上皮细胞的I/R 损伤,研究普罗布考对HK-2 损伤的保护作用及机制,以期为寻找新的治疗方向提供实验基础。
1 材料与方法
1.1 实验时间 本实验时间为2017年12月—2018年9月。
1.2 细胞株与主要试剂 HK-2(中国科学院上海生科院细胞资源中心),普罗布考、凋亡抑制剂(Z-VADFMK)、铁死亡抑制剂(Fer-1)、坏死性凋亡抑制剂、自噬抑制剂(3-methyladenine)、丙二醛(MDA)检测试剂盒、谷胱甘肽(GSH)检测试剂盒、谷胱甘肽过氧化物酶(GPX)活性检测试剂盒(Sigma 公司),兔抗GPX4 单克隆抗体(sc-166120)、兔抗β-actin 单克隆抗体(sc-58673)(Santa Cruz 公司),噻唑蓝(MTT)细胞增殖活性检测试剂盒、乳酸脱氢酶(LDH)细胞毒性检测分析试剂盒和ECL 化学发光试剂盒(上海碧云天生物技术有限公司)。
1.3 OGD/R 模型的建立方法 参照WEI 等[1]的方法常规培养HK-2 至完全贴壁,用缺血模拟溶液(包括5.37 mmol/L KCl、136.89 mmol/L NaCl、0.44 mmol/L KH2PO4、0.338 mmol/L Na2HPO4、4.166 mmol/L NaHCO3和5 mmol/L D-葡萄糖,pH 值为6.8)代替常规培养液培养细胞,将细胞放入含5% CO2和95% N2的密闭容器,将密闭容器放入缺氧培养箱(5% CO2、1% O2和94% N2)于37 ℃培养2 h 模拟缺血缺氧条件,2 h 后用常规培养液替换缺血模拟溶液在37 ℃、5% CO2正常条件下培养3 h 模拟复氧过程。
1.4 预实验确定普罗布考最佳作用时间与浓度 取HK-2,胰酶消化后制成细胞悬液,调整细胞浓度达6×105/L,将细胞接种到96 孔板,每孔加入细胞悬液100 μl,待细胞完全贴壁后将其分为正常对照组、OGD/R 组、OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组。正常对照组不予处理,OGD/R 组、OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组进行OGD/R 模型的建立,之后OGD/R 组不予处理,OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组分别加入25、50、100 μmol/L 普罗布考。分别于12、24、48 h 时,采用噻唑蓝(MTT)细胞增殖活性检测试剂盒,每组设6 个复孔,利用酶标仪在570 nm 波长处测量各组吸光度值(A 值),计算细胞增殖活性〔细胞增殖活性(%)=实验组A 值/对照组A 值×100%〕,确定普罗布考最佳作用时间与浓度,用于后续实验。
本研究价值:
肾缺血-再灌注(I/R)损伤的主要病理生理基础是肾小管上皮细胞发生脂质过氧化损伤,而肾小管上皮细胞损伤直接影响尿液的形成。普罗布考曾经是临床上常用药,逐渐被新药所取代。本研究首次将普罗布考应用于肾小管上皮细胞急性I/R 模型的处理,观察普罗布考的作用靶点,不仅为肾I/R 损伤的治疗提供实验依据,也为其他器官的I/R 损伤治疗提供新思路。
1.5 正式实验分组 取HK-2,胰酶消化后制成细胞悬液,调整细胞浓度达3×105/L,将细胞接种到96 孔板,每孔加入细胞悬液200 μl,待细胞完全贴壁后将其分为正常对照组(不予处理)、OGD/R 组(建立OGD/R模型)、普罗布考组(给予最佳作用浓度的普罗布考)、OGD/R+普罗布考组(建立OGD/R 模型后给予最佳作用浓度的普罗布考)。
1.6 观察细胞形态 于普罗布考最佳作用时间,采用倒置显微镜观察各组细胞形态并拍照。
1.7 LDH 释放法检测LDH 活性 于普罗布考最佳作用时间,取出培养板400 r/min 离心5 min(离心半径15 cm),将各孔内上清液吸干净,加入150 μl 用PBS稀释10 倍的LDH 释放工作液,轻摇混匀,放入培养箱培养1 h 后取出,400 r/min 离心5 min(离心半径 15 cm),每孔取上清液120 μl 加入新的96 孔板,每孔加入60 μl LDH 检测工作液,轻摇混匀,室温避光孵育30 min,每组设6 个复孔,在490 nm 波长处测定各孔吸光度。检测的吸光度越大说明LDH 活性越强,故用吸光度表示LDH 活性。
1.8 MDA 试剂盒检测MDA 水平和酶促法检测GPX 活性 于普罗布考最佳作用时间,取各组细胞,胰酶消化后制成细胞悬液,放入不同离心管内冰上裂解细胞,裂解完成后将各组离心管放入低温离心机4 ℃ 1000 r/min离心20 min(离心半径15 cm),取各组上清液作为检测用细胞蛋白匀浆,一部分上清液严格按照MDA 试剂盒说明步骤进行MDA 水平检测,重复检测6 次;另一部分上清液放入96 孔板内,依次加入检测缓冲液和检测工作液,轻摇混匀后每孔加入5 μl 有机过氧化物试剂(t-Bu-OOH)溶液进行反应,每组设6 个复孔,立即在340 nm 波长处用酶标仪检测吸光度,随后室温下继续反应5 min,再次在340 nm 波长处上机检测吸光度,即GPX 活性。
1.9 生化法检测GSH 水平 于普罗布考最佳作用时间,用细胞刮收集各组细胞移入离心管中,1200 r/min 离心5 min(离心半径15 cm),离心2 次,去除上清液,向离心管内加入蛋白去除试剂溶液,1000 r/min 离心 5 min(离心半径15 cm),取上清液分别加入96 孔板,每组设6 个复孔,依次加入检测工作液,在410 nm 波长处用酶标仪检测各孔吸光度,即GSH 水平。
1.10 Western blotting 法检测GPX4 水平 于普罗布考最佳作用时间,取各组细胞,胰酶消化后制成细胞悬液,冰上裂解提取细胞总蛋白,测定蛋白浓度,蛋白上样量调整为50 μg,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜,加入3%牛血清清蛋白(BSA)室温封闭2 h,去除封闭液后分别加入Tris-HCl 缓冲液(TBS)稀释的GPX4(1∶200)、β-actin(1∶500)抗体,4 ℃孵育12 h,加入辣根酶过氧化物标记的羊抗小鼠IgG(1∶200),室温孵育1 h,应用ECL 化学发光试剂盒显色并显影。应用Quantity One 软件对条带进行定量分析,以GPX4/β-actin 表示GPX4 水平。
1.11 统计学方法 采用SPSS 22.0 统计学软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 预实验结果 正常对照组、OGD/R 组、OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组12、24、48 h 时细胞增殖活性比较,差异有统计学意义(P<0.05);OGD/R 组、OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组12、24、48 h 时细胞增殖活性低于正常对照组,差异有统计学意义(P<0.05);OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组24、48 h 时细胞增殖活性高于OGD/R 组、OGD/R+25 μmol/L 普罗布考组,差异有统计学意义(P<0.05)。OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组24、48 h 时细胞增殖活性高于本组12 h 时,差异有统计学意义(P<0.05,见表1)。由于用药原则为在相似的作用下,一般选择较低浓度及较短作用时间,因此采用50 μmol/L 普罗布考作用24 h 进行后续实验。
2.2 细胞形态 正常对照组细胞呈三角形或多边形,形态规则,细胞折光性良好,贴壁完全;OGD/R 组悬浮细胞增多,细胞皱缩体积减小,失去正常形态,折光性减弱;普罗布考组细胞形态结构正常,贴壁完整;OGD/R+普罗布考组悬浮细胞减少,细胞折光性较好(见图1)。
2.3 LDH 活性 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组LDH 活性比较,差异有统计学意义(P<0.05);OGD/R 组、OGD/R+普罗布考组LDH 活性高于正常对照组,差异有统计学意义(P<0.05);普罗布考组、OGD/R+普罗布考组LDH活性低于OGD/R组,差异有统计学意义(P<0.05);OGD/R+普罗布考组LDH 活性高于普罗布考组,差异有统计学意义(P<0.05,见表2)。
2.4 MDA 水平、GPX 活性 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组MDA 水平、GPX 活性比较,差异有统计学意义(P<0.05);OGD/R 组、OGD/R+普罗布考组MDA 水平高于正常对照组,差异有统计学意义(P<0.05);普罗布考组、OGD/R+普罗布考组MDA 水平低于OGD/R 组,差异有统计学意义(P<0.05);OGD/R+ 普罗布考组MDA 水平高于普罗布考组,差异有统计学意义(P<0.05);OGD/R组GPX 活性低于正常对照组,差异有统计学意义 (P<0.05);普罗布考组、OGD/R+普罗布考组GPX活性高于OGD/R 组,差异有统计学意义(P<0.05);OGD/R+普罗布考组GPX 活性低于普罗布考组,差异有统计学意义(P<0.05,见表2)。
2.5 GSH 水平 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组GSH 水平比较,差异有统计学意义(P<0.05);OGD/R 组GSH 水平低于正常对照组,差异有统计学意义(P<0.05);普罗布考组、OGD/R+普罗布考组GSH 水平高于OGD/R 组,差异有统计学意义(P<0.05,见表2)。
表1 正常对照组、OGD/R 组、OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组不同时间细胞增殖活性比较(±s,n=6)Table 1 Comparison of cell proliferation in normal control group,OGD/R group,OGD/R+25 μmol/L probucol group,OGD/R+50 μmol/L probucol group and OGD/R+100 μmol/L probucol group at different time points of intervention
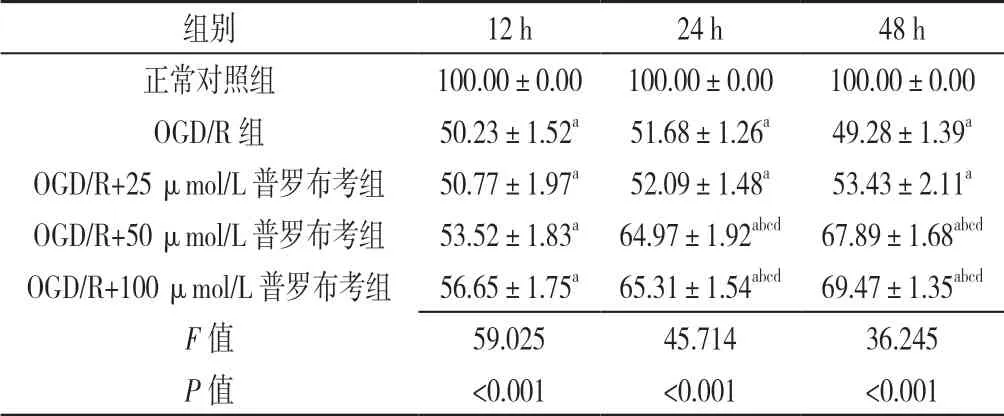
表1 正常对照组、OGD/R 组、OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组不同时间细胞增殖活性比较(±s,n=6)Table 1 Comparison of cell proliferation in normal control group,OGD/R group,OGD/R+25 μmol/L probucol group,OGD/R+50 μmol/L probucol group and OGD/R+100 μmol/L probucol group at different time points of intervention
注:OGD/R=氧糖剥夺/复氧;与正常对照组比较,aP<0.05;与OGD/R 组比较,bP<0.05;与OGD/R+25 μmol/L 普罗布考组比较,cP<0.05;与本组12 h 比较,dP<0.05
组别12 h24 h48 h正常对照组100.00±0.00100.00±0.00100.00±0.00 OGD/R 组50.23±1.52a51.68±1.26a49.28±1.39a OGD/R+25 μmol/L 普罗布考组50.77±1.97a52.09±1.48a53.43±2.11a OGD/R+50 μmol/L 普罗布考组53.52±1.83a 64.97±1.92abcd 67.89±1.68abcd OGD/R+100 μmol/L 普罗布考组56.65±1.75a 65.31±1.54abcd 69.47±1.35abcd F 值59.02545.71436.245 P 值<0.001<0.001<0.001
2.6 GPX4 水平 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组GPX4 水平比较,差异有统计学意义(P<0.05);OGD/R 组GPX4 水平低于正常对照组,差异有统计学意义(P<0.05);普罗布考组、OGD/R+普罗布考组GPX4 水平高于OGD/R 组,差异有统计学意义(P<0.05,见表2、图2)。
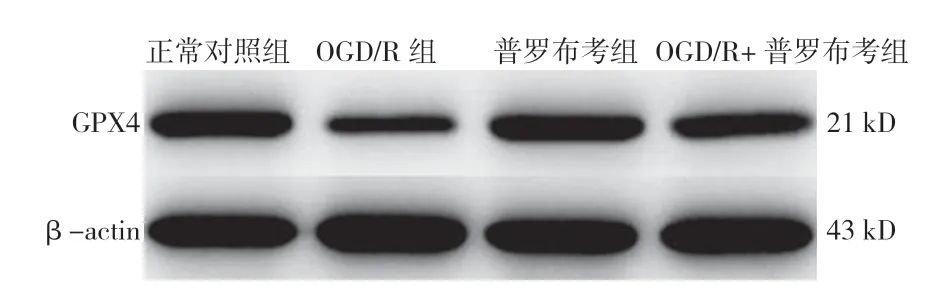
图2 Western blotting 法检测GPX4 水平的SDS-PAGE 图Figure 2 SDS-PAGE picture of GPX4 level detected by Western blotting
表2 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组LDH 活性、MDA 水平、GPX 活性、GSH 水平、GPX4 水平比较(±s,n=6)Table 2 Comparison of LDH activity,MDA level,GPX activity,GSH level and GPX4 level in normal control group,OGD/R group,probucol group and OGD/R+probucol group
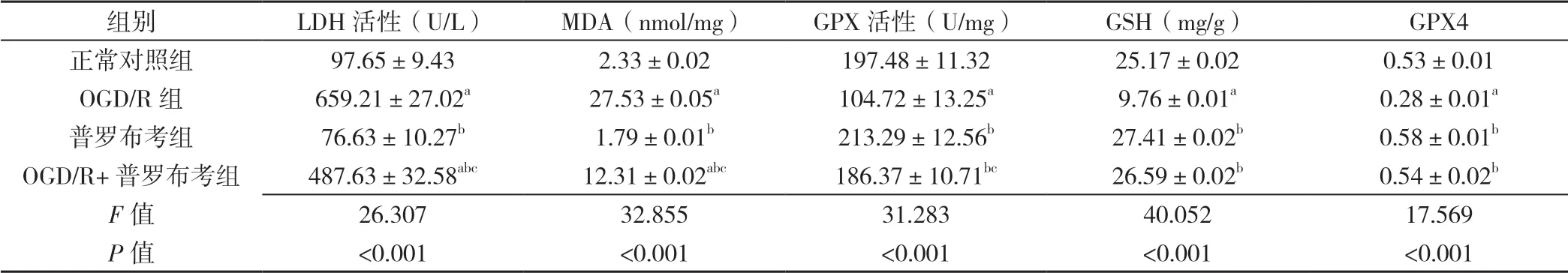
表2 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组LDH 活性、MDA 水平、GPX 活性、GSH 水平、GPX4 水平比较(±s,n=6)Table 2 Comparison of LDH activity,MDA level,GPX activity,GSH level and GPX4 level in normal control group,OGD/R group,probucol group and OGD/R+probucol group
注:LDH=乳酸脱氢酶,MDA=丙二醛,GPX=谷胱甘肽过氧化物酶,GSH=谷胱甘肽;与正常对照组比较,aP<0.05;与OGD/R 组比较,bP<0.05;与普罗布考组比较,cP<0.05
组别LDH 活性(U/L)MDA(nmol/mg)GPX 活性(U/mg)GSH(mg/g)GPX4正常对照组97.65±9.432.33±0.02197.48±11.3225.17±0.020.53±0.01 OGD/R 组659.21±27.02a27.53±0.05a104.72±13.25a9.76±0.01a0.28±0.01a普罗布考组76.63±10.27b1.79±0.01b213.29±12.56b27.41±0.02b0.58±0.01b OGD/R+普罗布考组487.63±32.58abc12.31±0.02abc186.37±10.71bc26.59±0.02b0.54±0.02b F 值26.30732.85531.28340.05217.569 P 值<0.001<0.001<0.001<0.001<0.001

图1 正常对照组、OGD/R 组、普罗布考组、OGD/R+普罗布考组细胞形态(×100)Figure 1 Cell morphology in normal control group,OGD/R group,probucol group and OGD/R+probucol group
3 讨论
临床上,肾I/R 损伤通过引起急性肾小管坏死导致急性肾衰竭,目前尚无有效治疗方法。已有研究证实,缺血后处理对肾I/R 损伤发挥一定保护作用[8],其可通过调节细胞凋亡信号途径中的某些相关蛋白抑制肾小管上皮细胞凋亡进而减轻肾脏损伤[9]。肾I/R 引起的正常肾小管上皮细胞的形态学改变除了细胞凋亡与坏死,还包括细胞铁死亡[10-12]。减轻肾I/R 损伤的治疗靶点主要包括对肾小管上皮细胞的保护和损伤改善作用。普罗布考最初的临床应用是作为降脂药物,越来越多的研究发现普罗布考还具有强抗氧化、抗炎与抗肿瘤活性,使其在临床上作为强抗氧化剂应用于防治心血管疾病[13]。因此,本研究将HK-2 细胞株作为研究对象,应用国际公认的OGD/R 细胞模型,探讨普罗布考对肾小管上皮细胞OGD/R 模型的作用及其可能机制。
本研究结果显示,正常对照组细胞呈三角形或多边形,形态规则,细胞折光性良好,贴壁完全;OGD/R组悬浮细胞增多,细胞皱缩体积减小,失去正常形态,折光性减弱;普罗布考组细胞形态结构正常,贴壁完整;OGD/R+普罗布考组悬浮细胞减少,细胞折光性较好;OGD/R 组12、24、48 h 时细胞增殖活性低于正常对照组。以上结果表明模型建立成功。OGD/R+25 μmol/L 普罗布考组、OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组12、24、48 h 时细胞增殖活性低于正常对照组,OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组24、48 h 时细胞增殖活性高于OGD/R 组、OGD/R+25 μmol/L 普罗布考组,OGD/R+50 μmol/L 普罗布考组、OGD/R+100 μmol/L 普罗布考组24、48 h 时细胞增殖活性高于本组12 h 时,说明细胞增殖活性对普罗布考具有剂量和时间依赖性,提示普罗布考可能对肾小管上皮细胞的损伤具有保护作用。OGD/R 组LDH 活性、MDA 水平高于正常对照组,表明OGD/R 引起HK-2 细胞发生脂质过氧化及LDH 活性升高,可能原因是肾脏急性缺血缺氧可引起活性氧簇(ROS)大量产生,超过细胞生物行为的需要,过量的ROS 作用于脂肪酸可以造成脂质过氧化,而脂质过氧化物可以改变细胞膜的通透性和流动性,引起细胞膜结构的破坏,导致LDH 的释放和活性增高。OGD/R+普罗布考组LDH 活性、MDA 水平高于正常对照组、普罗布考组,普罗布考组、OGD/R+普罗布考组LDH 活性、MDA 水平低于OGD/R 组,而OGD/R 组GSH 水平低于正常对照组,普罗布考组、OGD/R+普罗布考组GSH 水平高于OGD/R 组,提示普罗布考可能通过激活细胞内的抗氧化酶类降低细胞的脂质过氧化水平,进而降低脂质过氧化水平抑制LDH 的活性。OGD/R 组GPX 活性、GPX4 水平低于正常对照组,提示OGD/R 引起GPX4 活性降低,导致肾小管上皮细胞损伤加重;普罗布考组、OGD/R+普罗布考组GPX 活性、GPX4 水平高于OGD/R组,提示普罗布考可能直接或通过提高GPX 活性间接抑制脂质过氧化物的产生,发挥细胞保护作用。本结果与SANTOS 等[14]的研究结果一致,该研究指出普罗布考的抗氧化作用主要包括两方面:一是直接清除细胞内和细胞膜上的氧自由基,抑制脂质过氧化物的产生;二是直接或间接提高内源性抗氧化剂的储备或激活细胞内抗氧化酶系,发挥清除脂质过氧化物的作用,其中包括对GPX 的激活。
本研究结果还显示,普罗布考在处理细胞12 h 以内并未发现明显的保护作用,24 h 以后才逐渐提高细胞增殖活性,并呈时间依赖性,这一结果与普罗布考代谢缓慢的药理学特性一致,本研究结果与WANG 等[15]的结果一致,该研究表明普罗布考的t1/2长,其药理作用在停药后仍可维持数月,因此,在临床应用中普罗布考可作为预防用药。
由于肾I/R 引起的肾小管上皮细胞死亡是一个多因素作用的病理生理过程,普罗布考对肾小管上皮细胞的保护作用可能不仅限于抑制脂质过氧化,还有其他靶点和途径,本研究具有一定局限性。在今后的研究中,本研究将进一步探讨普罗布考对模型细胞死亡途径的影响,以期为肾小管上皮细胞I/R 损伤寻找更多的治疗 靶点。
综上所述,普罗布考对OGD/R 引起的HK-2 损伤具有保护作用,可能的机制是通过激活GPX,尤其是提高GPX4 水平,直接或间接抑制脂质过氧化物的过度产生。本研究不仅为普罗布考老药新用提供了实验依据,还为GPX4 作为肾小管上皮细胞I/R 损伤的治疗靶点提供了理论基础。

