新型二维纳米材料联合超声相关生物医学技术在肿瘤诊疗中的应用进展
杨微,马永宁,郝轶
0 引言
二维纳米材料是指一个维度具有限定尺寸,而在其他两个维度上可无限延伸的材料。从最初的石墨烯开始,二维纳米材料发展到现在已有20多种,包括石墨烯、黑磷、六方氮化硼、过渡金属二硫族化合物和过渡金属碳化物等[1]。二维材料中最具有代表性的材料是石墨烯(graphene),它是由碳原子以sp2杂化轨道组成的六角型,仅单层原子厚度的蜂巢晶格状平面结构。其基本结构单元为有机结构中最稳定的六元苯环,厚度仅0.35 nm,是目前已知最薄的二维纳米材料,最早于2004年由英国曼切斯特大学的Geim及Novoselov等利用微机械分离的方法获得,两人因此获得2010年诺贝尔物理学奖[2]。石墨烯可通过卷曲形成零维的富勒烯、一维的碳纳米管以及堆垛成三维的石墨。其特殊的结构使得石墨烯表现出许多优异的理化性质,如良好的导热性能,其热导率高达5×103W/(m.K),较大的比表面积(单片石墨烯的比表面积为2 630 m2/g)、优异的光学性能等,因此广泛应用于药物传递、抗肿瘤、临床检测、生物工程等生物医学领域。
2014年,复旦大学Li等[3]首次利用胶带机械剥离法制得厚度仅7.5 nm的二维黑磷纳米材料(black phosphorus, BP)。二维黑磷的成功制备使其成为二维材料的新成员。黑磷是一种由范德华力相互作用、将单个原子层叠加在一起的层状材料,每个磷原子与三个相邻的磷原子共价结合,形成二维波浪状结构,比石墨烯具有更多的褶皱,使得黑磷纳米材料具有更大的比表面积,在载药方面具有更大的优势。相比于石墨烯,作为二维半导体材料的黑磷具有较宽的可调节带隙(0.3~2.0 ev),使其在紫外、红外和可见光光谱中具有广泛的光吸收,这种独特的光学特性使黑磷在生物传感、光声成像、光动力学治疗、光热治疗领域具有更大的优势[4]。此外,石墨烯在体内需经功能化修饰后才能被降解,而黑磷在体内可直接在水和氧气的作用下直接降解,产生无毒的中间体,因此在体内应用更安全,尤其是在癌症治疗方面[5]。
1 石墨烯、黑磷的生物学性能
1.1 在药物载体方面的应用进展
国际上常用的化疗药物主要以细胞毒性药物为主,存在靶向性差、心肾毒副作用大、治疗效果不理想的问题。近年研究表明超声联合载药微泡可有效杀伤肿瘤细胞,但研究者发现微泡粒径较大,应用单层微泡脂质壳层的载药能力有限,往往难以达到疾病治疗的有效剂量,并且其靶向递送效果有限。
目前有学者认为利用纳米材料及技术研制生物相容性更好,能同时装载抗肿瘤药物及基因,且具有良好的控释功能,可实现肿瘤定点靶向治疗,在提高药物生物利用度的同时减少药物的毒副作用。最佳的药物载体应具备安全可靠、转染能力高、药物与载体的良好协同作用以及靶向性好等特点。由于比表面积大、易于修饰等特点,石墨烯、黑磷等新型二维纳米材料作为药物载体在生物医学领域受到了极大关注,现已成为国际上新型药物载体的研究热点。
目前,国内外学者已针对氧化石墨烯(graphene oxide, GO)载药方面做了很多的研究工作。2008年Liu等[6]首次将氧化石墨烯作为药物载体,其用聚乙二醇(polyethylene glycol, PEG)对纳米氧化石墨烯(nano-graphene oxide, NGO)进行表面修饰以增加石墨烯溶解性,同时通过π-π键堆积的方式将石墨烯与喜树碱SN38结合,利于药物在体内的释放。研究证实NGO-PEG-SN38作为药物载体具有可靠的生物安全性。但是,当前的GO体系主要通过非共价物理吸附来载药,存在载药量不稳定和肿瘤被动靶向的缺点。而正己酰羧甲基壳聚糖(CHC)表面具有氨基、羧基等化学基团,易于修饰,水溶性差,只有在酸性水溶液中才能溶解。CHC修饰后的GO可连接各种特异性靶向配体,在肿瘤酸性微环境中才能溶解释药。Bao等[7]将制备的氧化石墨烯共价接枝壳聚糖(GO-CS)作为抗癌药物喜树碱的纳米载体,实验发现该复合材料在72 h后对喜树碱(CPT)的负载量增长至17.5%,同时毒性测试表明,100 mg/L的GO-CS载体本身没有毒性,但是负载GO-CS-CPT的复合物的50%抑制浓度(IC50)仅为29 μmol/L。Wang等[8]也报道了将环形精氨酸-甘氨酸-天冬氨酸多肽(cyclic Arg-Gly-Asp, cyclic RGD, cRGD)壳聚糖/氧化石墨烯聚合物作为肝细胞癌靶向治疗的药物释放系统,该系统对阿霉素的负载能力高达1.00 mg/mg,在pH值较低时即肿瘤环境下能够很好地识别肝癌细胞并释放药物对其进行吞噬。
黑磷是继石墨烯之后的二维材料新宠,展现出卓越的光电特性,被视为新的超级材料[9],尤其是在生物医药领域具有巨大的应用价值。相对传统材料,黑磷主要在药物载体、肿瘤的光声成像、光热和光动力疗法新材料三大方面体现了它的潜力[10-11]。目前,本课题组两名成员(合作单位:深圳大学张晗教授千人课题组成员)在既往的研究中,采用优化的液态剥离法,首次将黑磷二维纳米薄片应用于诊断治疗制剂载体的制备以及功能化修饰,研发了一种负载化疗药物阿霉素的“黑磷纳米片载体系统”。其具有较大的表面积,很好的生物相容性,负载量和载药性能显著高于传统的聚合物纳米粒子载体,提高了化疗药物疗效。研究中联合采用聚焦超声控释的生物响应调节的化疗—光热联合治疗方法,载药效率可达95%。在体内外验证了强大的抑瘤效果,可精准靶向治疗癌症[12-14]。另一项研究[15]也证明黑磷纳米片可负载自身质量为其数十倍的阿霉素(载药重量约950%),且基于黑磷二维纳米材料的光热、光动力活性,成功将黑磷纳米薄片与光热、光动力治疗及化疗三种抗肿瘤模式结合,实现肿瘤多模式联合治疗。
1.2 在肿瘤光热治疗方面的应用进展
光热治疗(photothermal therapy, PTT)是在激光照射下,利用光热转换产生热量,进而引起局部高温来破坏、杀死肿瘤细胞,达到治疗癌症的目的。相较于传统的手术治疗、放疗和化疗,光热治疗具有副作用小、可控性好等优点。二维石墨烯、黑磷等新型纳米材料在近红外光区域(near-infrared light, NIR)具有优越的光吸收特性及高效的热传导性,其作为光热治疗剂在癌症的光热治疗中具有广泛的应用前景。
Yang等将花菁染料7(Cy7)作为荧光标记方法,探究了PEG修饰的纳米石墨片(PEG-NGS)的体内过程[16],将合成的PEG-NGS-Cy7复合材料静脉注射24 h后在肿瘤区域可见很强的荧光信号,可见该复合材料对肿瘤细胞具有较强的靶向性。随后,在808 nm近红外光照射后肿瘤组织达到100%消融,同时体内试验进一步证明PEGNGS的潜在体内毒性低且可有效增强PTT抗肿瘤效果。此外,石墨烯还可与用于光动力学治疗(photodynamic therapy, PDT)的光敏剂结合,实现多模式肿瘤治疗。例如,Li等[17]利用逐步共轭法将氧化石墨烯与光敏剂富勒烯(C60)结合,成功研制了GO-C60复合物,实验证实该复合物可在近红外光作用下同时进行光热及光动力学治疗,两者协同治疗肿瘤的效果优于PTT或PDT单独治疗。
黑磷较宽的可调节带隙使其在光热治疗中具有独特的优势。中科院深圳先进研究院Sun等[18]利用超声剥离黑磷晶体的方法,制备了超小的黑磷纳米粒(横径约2.6 nm,厚约1.5 nm),研究证实其对胶质瘤和乳腺癌细胞均具有良好的光热抗肿瘤效果。随后,又有学者将光敏剂修饰黑磷纳米材料,研制了能同时用于光热/光动力双重抗肿瘤作用的复合纳米材料。例如,Li等[19]开发了一种用于生物成像引导的光热/光动力协同治疗肿瘤的黑磷多功能纳米粒(black phosphorus nanoparticles,BPNP),通过体外和体内研究证实了聚乙二醇化BPNP协同PTT和PDT对癌症的治疗效果,并通过组织学分析证实BPNP具有低毒性。最近,Yang等[20]也成功研制了能进行PTT/PDT双重抗肿瘤作用的黑磷复合纳米材料,研究者利用黑磷纳米材料较高比表面积的特性将光敏剂chlorin e6修饰于黑磷纳米材料中,使得制备的BP@PEG/Ce6纳米复合材料不仅具有良好的生物相容性、生理稳定性和肿瘤靶向性,而且具有较高的光热转换效率(43.6%)。
2 联合超声相关生物医学技术在肿瘤治疗中的应用
超声相关生物医学技术是指运用超声或者超声与其他技术相结合所产生的医学原理和特性,对人类疾病进行研究、诊断和治疗的技术。如超声成像、聚焦超声、声动力学治疗等。光声成像(photoacoustic imaging, PAI)是结合了超声成像及光学成像的新技术,具有传统光学成像对比度高及超声成像组织穿透性强的优点。将超声成像与光热治疗相结合,可进行治疗前肿瘤位置及大小的确定、治疗过程中实时监测以及治疗后疗效的评估,以减少对周围组织的热损害,实现诊疗一体化[21]。
2.1 光声成像引导下光热治疗
光声成像利用组织内部光学吸收差异,将光能转换为热能,从而导致瞬态热膨胀所引起的声发射,然后由组织外的超声换能器转化为光声图像[22]。然而,激光较强的散射效应,导致光强和光声信噪比随生物组织深度增加呈指数级衰减,使得PAI主要局限于小型动物的成像,这也阻碍了其从临床前研究向临床应用的跨越[23]。目前,不少研究引入光声造影剂来克服这种散射效应[24]。石墨烯、黑磷等二维纳米材料具有近红外吸收能力,从而成为重要的光声造影剂[25],以及作为光敏剂,结合光声成像与光热治疗用于肿瘤的监测与治疗。
Sheng等报道的蛋白质辅助还原和表面功能化合成的纳米还原石墨烯(reduced graphene oxide,rGO)比未经修饰的GO具有更高的光声信号[26],在荷瘤小鼠静脉注射纳米rGO后,肿瘤区光声信号迅速增强,显示出其在被动靶向和光声成像方面的优势。同时,由于rGO的光热效应,使用连续波近红外激光照射可有效消融体内的癌细胞。结果表明,蛋白质辅助制备的纳米rGO适合于肿瘤的光声成像和光热治疗,在诊治一体化纳米医学中具有广阔的应用前景。此外,通过引入荧光剂等物质还可增强石墨烯的光声性能,Hu等[27]利用吲哚菁绿(indocyanine green, ICG)负载聚多巴胺还原石墨烯(PDA-rGO)制备了新型纳米复合材料(ICG-PDA-rGO),结果表明, ICG可有效增强PDA-rGO在780 nm处的光吸收。经PA成像引导的PTT治疗后,荷瘤小鼠的肿瘤被完全抑制,且未观察到治疗所致的毒性。
相较于石墨烯,黑磷在这方面的研究相对较少,Sun等报道了聚乙二醇(PEG)修饰的黑磷纳米粒(BPNP)在光声成像联合光热治疗在癌症治疗中的应用[28]。表面聚乙二醇涂层使其在水中具有良好的稳定性和溶解性。体内光声图像表明,PEG化BPNP可通过增强通透性滞留效应(EPR效应)在肿瘤中有效地积累,静脉注射聚乙二醇化BPNP 24 h后,肿瘤的光声信号强度高于肾脏和肝脏。与对照组小鼠相比,利用NIR在光声成像引导下对荷瘤小鼠行进一步光热消融治疗后,肿瘤明显缩小。说明功能化修饰的黑磷纳米粒在癌症监测及治疗一体化中有巨大潜力。然而,黑磷在生理条件下的不稳定性导致其光声信号的不稳定,因此,Sun等[29]利用表面配体的方法将钛配体的磺酸酯(TiL4)与黑磷量子点结合,以提高其作为光声成像剂的稳定性。与未经修饰的黑磷相比,TiL4配位黑磷量子点在水溶液中表现出更高的稳定性,并且由于其较大的近红外光吸收特性,表现出比金纳米粒子(AuNPs)更好的光声增强性能。
2.2 超声成像引导下光热治疗
超声(ultrasound, US)成像以其实时、低成本、安全性高和便携性好等特点而在成像引导光热治疗中具有独特的优势。不少研究将各种热敏剂,如金纳米粒、CuS纳米粒等,与超声造影剂复合物结合,制备了用于超声成像引导PTT治疗的纳米复合材料。
Li等[30]将氧化铁纳米粒子负载到聚乳酸(polylactic acid, PLA)微囊中,再用氧化石墨烯进行表面功能化,制备了生物相容性良好且可同时增强超声、磁共振和光声成像的复合微囊,在近红外光作用下,复合微囊能有效杀伤癌细胞。另一项研究[31]也成功制备了用于诊疗一体化的复合囊泡,研究者利用氧化石墨烯和钆螯合物对包裹液态氟碳的囊泡进行表面功能化,所制备的复合囊泡可在US及MRI引导下对肿瘤进行光热治疗。因此,将石墨烯纳米材料与超声及其他成像造影剂结合,可实现包括超声在内的多模态成像引导下的肿瘤光热治疗。
2.3 联合声动力疗法肿瘤治疗
声动力学疗法(sonodynamic therapy, SDT)是在光动力学疗法(photodynamic therapy, PDT)的基础上发展起来的崭新的肿瘤治疗手段。利用一定频率和强度的超声波激发聚集在肿瘤区域的声敏剂,产生具有细胞毒性的活性氧物质(ROS),包括羟基(OH·)、过氧自由基(HO2·)和非自由基单线态氧(1O2)的自由基,促使肿瘤细胞发生不可逆损伤,从而达到肿瘤治疗目的,最先由日本学者Yumita发现并提出[32]。
为提高SDT疗效,实现SDT/超声热疗协同治疗肿瘤的目的,研究学者利用还原石墨烯纳米片(nrGO)为载体,将介孔二氧化硅(MSN)包覆于其表面,最后在MSN层表面负载Rb-PEG共轭磁性氧化铁纳米粒(IONs),合成nrGO@MSNION-PEG-RB复合纳米系统[33]。nrGO和磁性氧化铁在超声诱导下的加热效应可促进SDT过程中ROS的产生,MSN可促进超声空化作用从而促进复合物的细胞内化。体内试验结果显示,在聚焦超声作用下,rGO、MSN和IONs可提高声敏剂Rb对SKBr3癌细胞的细胞毒性作用。此外,nrGO作为一种优良的导热基,在极低功率聚焦超声辐射时触发局部温度升高,从而导致深度定向热疗。该研究表明,基于nrGO@MSN-ION-PEG-RB复合纳米系统的SDT和聚焦超声诱导的热疗协同作用可明显抑制肿瘤的生长。最近,另一项研究也证明石墨烯与声敏剂的结合可提高SDT治疗效率。Dai等[34]开发了一种新型的纳米复合物(TiO2-GR),将二维还原氧化石墨烯(GR)与声敏剂二氧化钛(TiO2)结合,与单纯的TiO2纳米粒相比,GR高导电性使TiO2-GR在体内产生较多的ROS。随后,研究者将磁性MnOx作为MRI造影剂负载于复合物表面,为MnOx/TiO2-GR协同SDT与PTT肿瘤治疗提供成像引导。
与石墨烯协同声敏剂进行SDT治疗不同,黑磷作为二维半导体材料与氧发生作用可产生1O2,有望成为新的声纳增敏剂用于SDT癌症治疗。最近,中南大学Ouyang等[11]首次证实超声辐照黑磷的抗肿瘤效果比近红外激光有效很多,即使在深层组织中也能产生较高的ROS,见图1。该研究利用金纳米粒子(Au NPS)负载于黑磷表面,进一步增强黑磷的声动力学性能,制备的Au@BP纳米杂化物与传统的有机超声波增敏剂相比,在超声辐照下表现出更好的稳定性。体内荷瘤小鼠的研究表明,Au@BP纳米杂合体可以有效抑制肿瘤生长,且副作用小,为开发安全高效的纳米声敏剂开辟了新的研究方向。
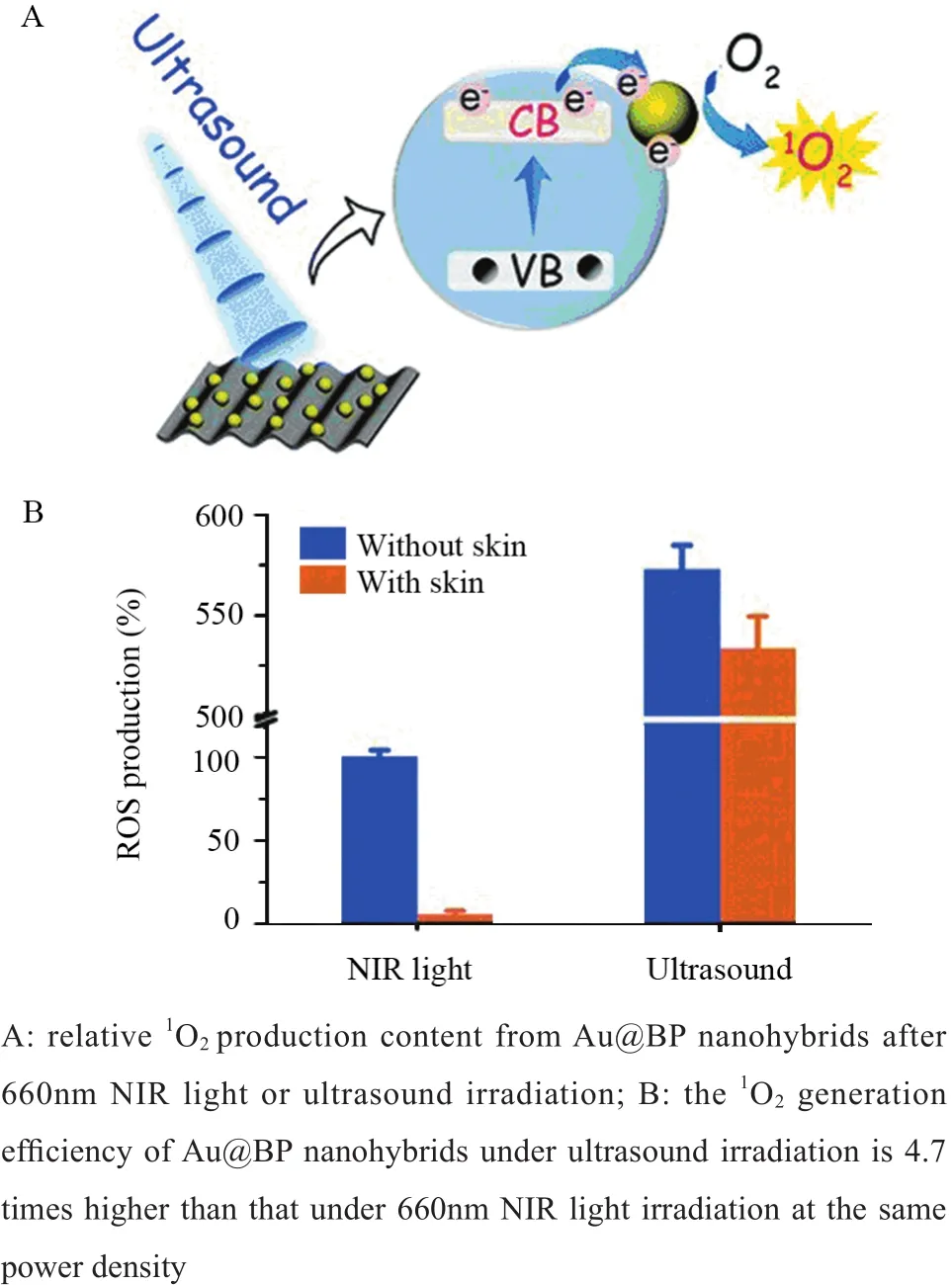
图1 超声辐照下Au@BP纳米杂合体产生1O2机制图[11]Figure1 Mechanism of 1O2 generation by Au@BP nanohybrids under ultrasound irradiation[11]
3 结语
新型二维纳米材料与超声相关生物医学技术结合,展现出的良好生物医学特性使其成为肿瘤治疗学领域新的研究方向。但新型二维纳米材料的研究仍处于初步阶段,要在人体中应用仍面临一些挑战。首先,这些纳米材料在人体内环境中所产生的毒性及生物稳定性尚不明确,目前的相关研究仍处于体外及小型动物实验阶段,在大型动物体内的实验研究鲜见报道。其次,纳米载体实现临床应用必然面临材料规模化生产的技术问题及成本问题,目前虽然纳米载体在实验室的制备技术日趋稳定和成熟,但仍存在制备步骤复杂、成本高及效率低等问题。第三,协助纳米材料用于肿瘤诊疗的超声及光声医学设备大多还处于实验室研究阶段,如目前使用的光声成像设备成像深度仅数十毫米,仅适用于小型动物的研究。因此,设备硬件与软件的创新从而实现临床应用至关重要。
尽管目前的研究存在一定局限性,但我国科学研究者在竞争激烈的国际材料科学领域仍然取得了许多重要的突破,尤其在药物载体方面。近年来的实验研究肯定了石墨烯、黑磷等二维纳米材料作为药物载体用于肿瘤诊疗的可行性,超声相关生物医学技术因实时、便捷等优点,不断用于疾病的诊断与治疗。未来或许还可将黑磷等纳米载体负载于超声成像微泡,在超声辐照下对其载药系统进行可视化定向载药控释并进行疗效评估。相信随着生物医学工程及分子生物学的不断发展,新型二维纳米材料结合超声相关生物医学技术在肿瘤诊疗的应用研究会有突破性的进展。

