口服胰岛素肠溶聚合物脂质杂化纳米粒的制备与评价
林 霞,李 娜,李金蔚,杨子毅,金 坚
(江南大学药学院,无锡 214122)
糖尿病已成为目前全球最严重的健康问题之一,根据国际糖尿病联合会的数据,全球成年糖尿病患者人数在2017年已经达到4.25亿,预计到2045年将达到6.29亿。而中国是糖尿病患者最多的国家,约有1.14亿糖尿病患者[1]。胰岛素(INS)是一种广泛应用于糖尿病患者的生物大分子药物,其半衰期短,脂溶差,不易穿透生物膜,长期以来一直以注射给药为主。这种给药方式不仅顺应性差,还会出现一些不良反应(如耐药和注射部位炎症、硬结等)[2]。
为此,许多国内外学者致力于INS非注射剂型的研究与应用,如口服制剂、鼻用制剂、肺部给药系统等[3-6]。自诺和诺德公司宣布放弃口服胰岛素研发后,目前仅有Diasome公司的HDV-I和Oramed公司的ORMD-0801胰岛素胶囊进入Ⅲ期临床试验[7-8]。目前,关于胰岛素口服给药系统的研究主要集中于脂质体、纳米粒、胶囊、微球、乳剂等[9]。其中,纳米粒作为蛋白多肽类药物的口服给药载体时,由于其不仅能防止药物被消化道内的强酸和消化酶降解,而且在肠道中纳米粒可以以整体形式被Peyer淋巴结上的M细胞吞噬,通过肠黏膜上的淋巴系统吸收,或者通过细胞间通道吸收[10],已成为胰岛素口服给药系统的研究热点之一。近年来,研究发现将胰岛素包载于聚合物-脂质杂化纳米粒中,可有效控制药物释放,且可获得较高的包封率[10]。Sun等[11]以胰岛素-油酸钠复合物和聚乳酸羟基乙酸共聚物(PLGA)制备的纳米粒口服生物利用度为37.7%。但当以亲水性载体材料制备纳米粒时,载体易溶解于组织液中,无法控制蛋白药物在胃肠道中缓慢释放;以疏水性材料为载体时,由于胰岛素的高度亲水性,二者相容性差、包封率低,且很容易引起突释,仍无法控制药物在胃肠道中缓慢释放[12]。因此,研究一种可在胃肠道中稳定缓慢释放并有效吸收的口服胰岛素制剂仍是目前多肽蛋白药物口服给药系统亟需解决的问题。
本研究拟以两亲性高分子载体PEG-PLA为聚合物载体材料,以磷脂s75为脂质材料、制备胰岛素聚合物脂质杂化纳米粒(INS-NPs),再将INS-NPs与肠溶材料Eudragit L100混合,制备胰岛素口服肠溶聚合物脂质杂化纳米粒(INS-NPs L100);以包封率、粒径和体外释放为评价指标进行处方优化,并对最优处方进行健康大鼠降血糖作用评价,旨在探索出一种在胃肠道中可缓慢释放、生物利用度较高的胰岛素口服给药系统,为口服胰岛素提供新的研究思路。
1 材 料
1.1 药品与试剂
胰岛素(insulin,INS,江苏万邦生化医药有限公司,效价27 IU/mg,批号1806A11);胆酸钠(sodium cholate,SC,上海阿拉丁生化科技股份有限公司);单甲氧基聚乙二醇聚乳酸共聚物(mPEG5000-PLA14808,PEG-PLA,山东济南岱罡生物科技有限公司);单、双硬脂酸甘油酯(geoleol mono and diglycerides NF,GMD,批号158661法国Gattefosse公司);磷脂s75(德国Lipoid公司);泊洛沙姆188(Poloxamer 188,德国巴斯夫公司);聚丙烯酸树脂L100 (Eudragit®L100,德国Evonik公司);邻苯二甲酸羟丙甲基纤维素酯55(HP-55,信越化学工业株式会社);胃蛋白酶和胰酶(上海麦克林生化科技有限公司);乙腈为色谱纯,其他试剂均为市售分析纯。
1.2 仪 器
高效液相色谱系统(Agilent 1260,美国安捷伦公司);JY92-Ⅱ型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);T18高速剪切分散机(德国IKA公司);超速冷冻离心机(天美科学仪器有限公司);SU-1510扫描电子显微镜(日本日立株式会社);NICOMPTM380ZLS动态光散射粒度测定仪(美国PSS公司);冷冻干燥机(北京四环科学仪器厂有限公司);MX-S涡旋仪(美国Scilogex公司);BSA24S电子天平(德国赛多利斯公司);pH计(瑞士Mettler Toledo公司);血糖仪(三诺生物传感股份有限公司)。
1.3 动 物
SPF雄性SD大鼠,(250±20) g,购于昭衍(苏州)新药研究中心有限公司,动物生产许可证号SCXK(苏)2018-0006,动物质量合格证编号No.201806730,伦理审核编号JN.No20180430S0250531[71]。
2 方 法
2.1 胰岛素经口肠溶聚合物脂质杂化纳米粒(INS-NPs L100)的制备
2.1.1 胰岛素聚合物脂质杂化纳米粒(INS-NPs)的制备 采用W/O/W复乳-溶剂挥发法制备INS-NPs。称取适量胰岛素和胆酸钠,溶解于0.01 mol/L盐酸溶液作为内水相。精密称取适量PEG-PLA和脂质超声溶解于乙酸乙酯中作为油相。另配制1% Poloxamer 188水溶液作为外水相。将内水相边涡旋边注入油相中,涡旋0.5 min,然后冰水浴探针式超声3 min,功率40%,形成W/O初乳。再将初乳在高速搅拌下注入外水相中,8 000 r/min搅拌0.5 min,然后常温水浴探针式超声6 min,超声功率60%,形成W/O/W的复乳。37 ℃下将所得复乳减压旋转蒸发至乙酸乙酯挥发完全,即得胰岛素聚合物脂质杂化纳米粒 (INS-NPs)。
2.1.2 INS-NPs L100的制备 将INS-NPs与10%肠溶材料水溶液等体积混匀,再加入适量2 mol/L盐酸溶液使之沉淀,12 000 r/min离心10 min,收集沉淀,冷冻干燥,即得INS-NPs L100。
2.2 INS-NPs的粒径、多分散系数(PDI)及Zeta电位的测定
将INS-NPs用去离子水稀释至适当浓度,采用动态光散射粒度测定仪测定粒径、PDI及Zeta电位。
2.3 载药量和包封率的测定
2.3.1 色谱条件 C18色谱柱(250 mm×4.6 mm,5 μm,美国安捷伦公司),流动相:0.2 mol/L无水硫酸钠溶液(pH 2.3)-乙腈(73∶27),检测波长:214 nm,流速:1 mL/min,柱温:40 ℃,进样量:20 μL,胰岛素的浓度采用外标法以峰面积定量。
2.3.2 载药量的测定 精密称取适量INS-NPs L100于10 mL量瓶中,加入pH 6.8磷酸盐缓冲液1 mL使包衣材料溶解,再加入乙腈2 mL超声使纳米粒溶解,用0.01 mol/L 盐酸稀释至刻度。15 000 r/min离心10 min,取上清液,进样,测定峰面积。按外标法计算出胰岛素的浓度,按公式(1)计算载药量:
载药量=(胰岛素浓度×10 mL)/INS-NPs L100的质量×100%
(1)
2.3.3 包封率的测定 取新制备的INS-NPs溶液6 mL,超高速离心机离心1 h,转速30 000 r/min,以分离未游离的胰岛素,收集上清溶液。胰岛素含量用HPLC法测定,按公式(2)计算纳米粒包封率(encapsulation efficiency,EE):
包封率(%)=(投入胰岛素总量-上清液中游离胰岛素量)/投入胰岛素总量×100
(2)
2.4 INS-NPs L100的体外释放
将冻干的INS-NPs L100 20 mg分散于pH 1.0的介质45 mL中,于37 ℃、100 r/min水浴摇床中释放,2 h时加入0.2 mol/L磷酸钠溶液15 mL,调pH为6.8。即溶出条件为37 ℃,100 r/min,0~2 h在pH 1.0盐酸介质中,2~8 h在pH 6.8的溶出介质中,分别于5 min和1、2、2.25、2.5、2.75、3、4、6、8 h取出溶出介质200 μL,并补充等体积的新鲜溶出介质200 μL,采用HPLC测定游离胰岛素含量,绘制累积药物释放曲线。
2.5 INS-NPs的表面形态
将少量冻干后的纳米粒和包裹肠溶材料的纳米粒涂在导电硅胶黏性面,然后真空喷金,在扫描电子显微镜下观察粒子的外貌形态。
2.6 INS-NPs L100在人工胃液中的稳定性试验
参照《中华人民共和国药典》(2015年版)四部0921附注,配制人工胃液(SGF)。
分别称取INS NPs和INS-NPs L100 50 mg各3份,分别分散于装有人工胃液5 mL的离心管中,再将离心管置37 ℃、100 r/min水浴摇床孵育。分别于5 min、1 h和2 h,采用HPLC法测定人工胃液中INS-NPs和INS-NPs L100的胰岛素浓度,计算胰岛素百分含量。
2.7 INS-NPs L100在人工肠液中的稳定性试验
参照《中华人民共和国药典》(2015年版)四部0921附注,配制人工肠液(SIF)。
分别称取INS NPs、INS-NPs L100和INS-NPs+Eudragit®L100物理混合物50 mg各3份,分别分散于装有人工肠液5 mL的离心管中,再将离心管置于37 ℃、100 r/min水浴摇床孵育。分别于5 min、3 h和6 h测定人工肠液中INS-NPs和INS-NPs L100的胰岛素浓度,计算胰岛素百分含量。
2.8 健康大鼠经口给药降血糖试验
将24只雄性SD大鼠随机分成4组,实验组每组6只,给药前禁食不禁水12 h。阳性对照组:皮下注射胰岛素注射液,参考文献[11]给药剂量设定为1 IU/kg;阴性对照组:灌胃给予复溶后的空白纳米粒(NP L100);实验组A:灌胃给予复溶后的INS-NPs,参考文献[11]给药剂量设定为38 IU/kg;实验组B:灌胃给予用1%的羧甲基纤维素钠(CMCNa)混悬的INS-NPs L100,20 IU/kg。于给药前0 h和给药后0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、8和10 h尾静脉取血,采用血糖仪测定大鼠的血糖浓度。
以血糖浓度下降百分比绘制血糖下降百分比-时间曲线,血糖下降百分比=t时血糖浓度/0时血糖浓度×100%。
3 结 果
3.1 INS-NPs L100处方优化
前期试验研究显示内水相与油相体积比为1∶5,油相与外水相体积比为1∶8时,所制备的纳米粒粒径最小。因此,确定W/O/W体积比为1∶5∶40条件下进行其他处方因素的优化。
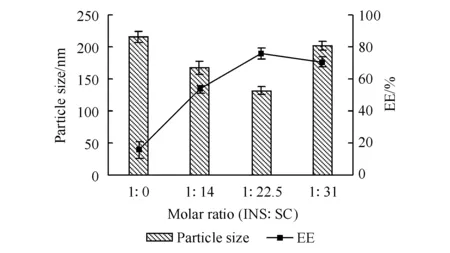
3.1.1 胰岛素与胆酸钠物质的量比的确定 胰岛素具有高度亲水性,脂溶性差,采用传统的W/O/W法所制备的纳米粒EE很低,不足20%。据文献报道,将胰岛素与胆酸钠制备成脂质复合物,能显著改善胰岛素的脂溶性,从而能提高纳米粒的EE[13-14]。因此,本研究以胆酸钠为脂质复合物材料,制备胰岛素-胆酸钠脂质复合物,以提高EE。对胰岛素与胆酸钠的物质的量比进行了考察,胰岛素与胆酸钠的物质的量比对INS-NPs的粒径和EE的影响如图1所示。结果显示,随着胆酸钠比例的增加,纳米粒的EE逐渐增加,粒径逐渐减小,当胰岛素与胆酸钠的物质的量比为1∶22.5时,所制备的纳米粒EE最高为75.98%,粒径最小。继续增加胆酸钠比例时,EE不再增加,粒径反而增大。因此,确定胰岛素与胆酸钠的物质的量比为1∶22.5。
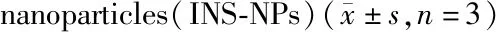
3.1.2 PEG-PLA质量浓度的确定 对PEG-PLA在油相中的质量浓度(20、30、40 mg/mL)进行了考察,PEG-PLA对纳米粒的粒径和EE的影响如图2所示。由图2可知,随着PEG-PLA质量浓度增加,EE无明显增加的趋势,尽管PEG-PLA质量浓度为20 mg/mL时EE较高,但粒径较大。综合考虑EE和粒径,优选PEG-PLA质量浓度为30 mg/mL。


3.1.3 胰岛素质量浓度的确定 对内水相中胰岛素质量浓度(10、15、20 mg/mL)进行考察,其对INS-NPs粒径及EE的影响如图3所示,随着胰岛素质量浓度的增加,EE逐渐增加。但由于胰岛素在0.01 mol/L HCl中的质量浓度大于20 mg/mL后便不易迅速溶解,因此确定内水相中胰岛素质量浓度为20 mg/mL。
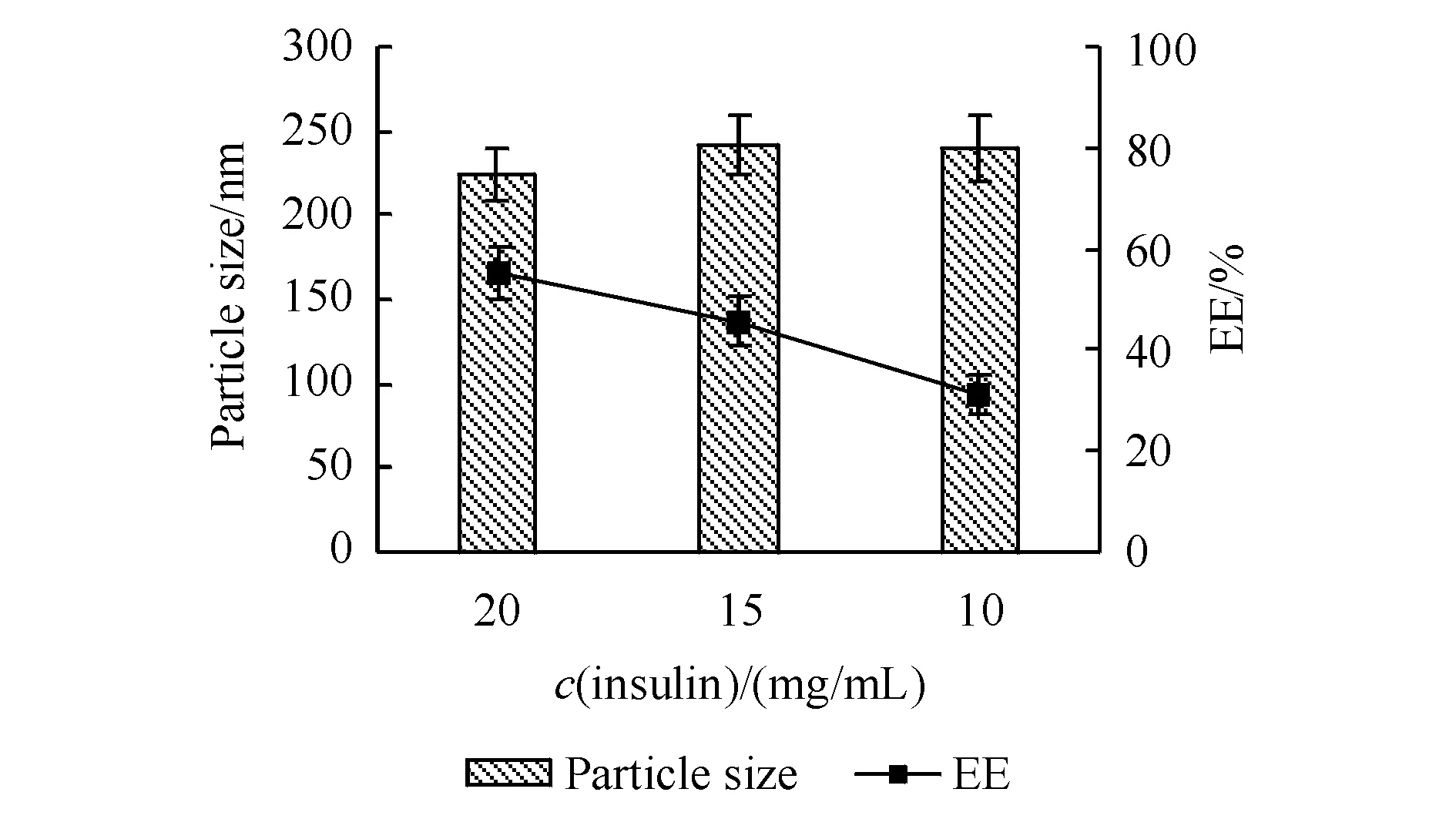
3.1.4 脂质材料的确定 比较了磷脂s45、s75和GMD 3种脂质对INS-NPs的EE和粒径的影响,结果如图4-A所示。结果显示,由GMD制备的纳米粒EE最高,粒径最小。将所制备的3种INS-NPs参照“2.1.2”项下方法以Eudragit L100为肠溶材料分别制备成INS-NPs L100肠溶制剂后,对其体外药物释放进行评价,结果如图4-B所示。结果显示,以磷脂s75为脂质材料所制备的INS-NPs L100在人工肠液(pH 6.8磷酸盐缓冲液)中药物释放速度最慢,以GMD为脂质材料所制备的INS-NPs L100在人工肠液(pH 6.8磷酸盐缓冲液)中药物释放速度最快。因此确定以磷脂s75为脂质材料制备INS-NPs L100。



GMD:Geoleol mono and diglycerides NF
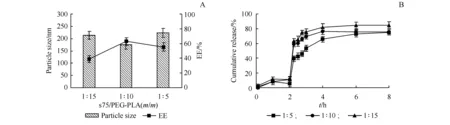
3.1.5 磷脂s75与PEG-PLA质量比的确定 由于脂质材料与聚合物材料的比例不同,导致载体与胰岛素的相互作用不同,有机相黏度也不同,进而影响INS-NPs的粒径、EE和药物释放速度。因此,本研究考察了磷脂s75与PEG-PLA的质量比对INS-NPs的EE和粒径影响,结果如图5-A所示。由图5-A可知,随着磷脂s75与PEG-PLA的质量比的增加,EE呈现先增加后不变或微降的趋势。当磷脂s75与PEG-PLA的质量比为1∶10时EE最高,为70.24%,粒径最小,为153.3 nm。
以Eudragit L100为肠溶材料,将上述INS-NPs制备成INS-NPs L100肠溶制剂,进一步评价磷脂s75与PEG-PLA的质量比对药物释放的影响,结果如图5-B所示。图5-B显示,随着脂质比例的增加,释放减慢。当磷脂s75与PEG-PLA的比例为1∶5时,释放最为缓慢,pH 1.0盐酸溶液中2 h的累积释放量小于10%,pH 6.8磷酸盐缓冲液8 h的累积释放为67.31%。由于纳米粒在体内释放越慢越有利于提高胰岛素在胃肠道中的稳定性,进而提高其生物利用度,故确定脂质材料为磷脂s75及其与PEG-PLA的质量比1∶5。
根据上述研究结果,最终确定胰岛素与胆酸钠的物质的量比为1∶22.5,PEG-PLA的质量浓度为30 mg/mL,胰岛素质量浓度为20 mg/mL,脂质材料为磷脂s75与PEG-PLA的比例为1∶5,即磷脂s75的质量浓度为6 mg/mL。
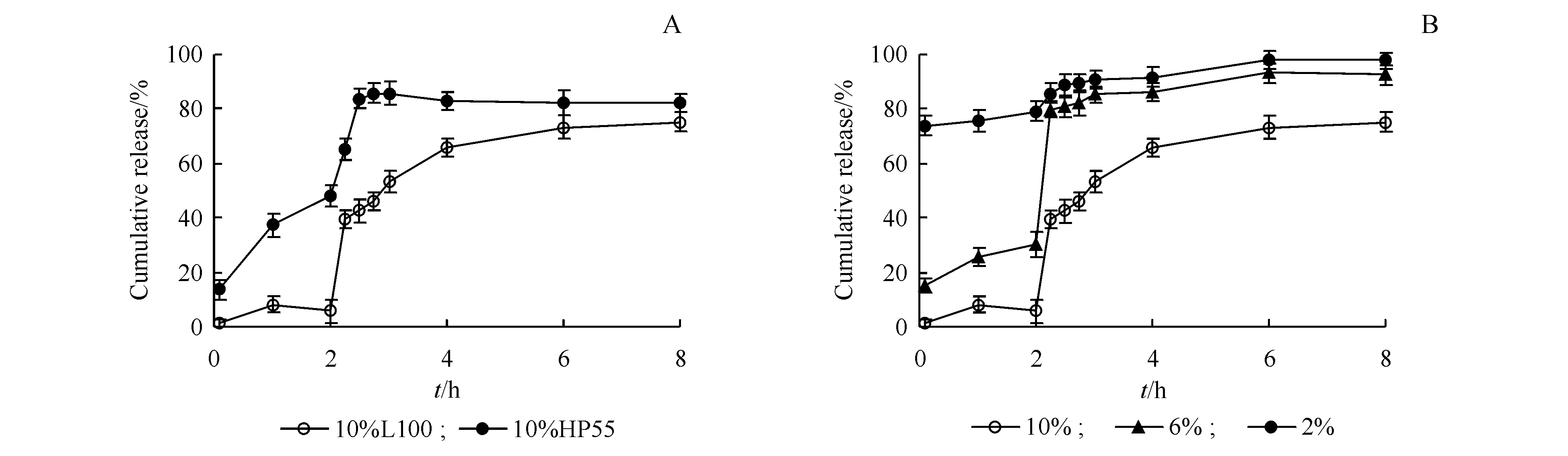
3.1.6 肠溶材料的确定 本研究选用肠溶制剂常用的两类肠溶材料,包括纤维素酯类HP-55和聚丙烯酸树脂类Eudragit L100,分别制备胰岛素肠溶制剂(INS-NPs HP55和INS-NPs L100),评价肠溶材料种类对胰岛素肠溶制剂药物释放的影响,结果如图6-A所示。结果显示,INS-NPs HP55在pH 1.0盐酸水溶液中,2 h时累积释放量高达50%;而INS-NPs L100在pH 1.0盐酸水溶液中2 h的累积释放量仅为8.01%,释放速度显著低于INS-NPs HP55。在pH6.8磷酸缓冲液中1 h时,INS-NPs HP55药物累积释放量已达80%以上,INS-NPs L100的释放速度显著低于INS-NPs HP55。由此可见,INS-NPs L100在人工胃液和人工肠液中的药物释放速度均显著低于INS-NPs HP55。因此,确定以Eudragit L100为肠溶材料,制备胰岛素肠溶制剂。
3.1.7 Eudragit L100浓度的确定 由于Eudragit L100浓度(即肠溶材料与INS-NPs的质量比)可直接影响肠溶材料对INS-NPs的包载作用,因此,本研究以药物释放速度为评价指标,对Eudragit L100浓度进行了考察,结果如图6-B所示。结果显示,当Eudragit L100浓度为2%时,所制备的INS-NPs L100在pH 1.0盐酸水溶液中5 min时的药物累积释放已达到70%以上,几乎无肠溶作用。随着Eudragit L100浓度的增加,INS-NPs L100在人工胃液和人工肠液中的药物释放速度逐渐降低。当Eudragit L100浓度增加至10%时,在pH 1.0盐酸水溶液中2 h时的药物释放量不足8%,在pH 6.8缓冲液中也具有明显的缓释效果。因此,最终确定Eudragit L100浓度为10%。


3.2 INS-NPs L100的表征
采用优化后的处方制备INS-NPs L100,并对其粒度分布、EE、体外药物释放进行系统评价。
3.2.1 粒度分布及Zeta电位的测定 采用动态光散射粒度测定仪测定最优处方制备的Ins-NPs和INS-NPs L100复溶后的粒度分布及其Zeta电位,结果显示,Ins-NPs的平均粒径为225.2 nm,PDI为0.191,Zeta电位为-14.84 mV。INS-NPs L100经人工肠液复溶后的平均粒径为278.0 nm,多分散系数为0.596,Zeta电位为-13.21 mV,均较新制备的INS-NPs略有增加。
3.2.2 载药量与包封率的测定 采用HPLC测得冻干后的INS-NPs L100载药量为8.34 μg/mg,EE为62.18%。
3.2.3 形态学观察 采用扫描电镜对INS-NPs经肠溶衣包裹前后的表面形态进行观察,如图7所示。图7-A为按最优处方制备的INS-NPs的外观形态,呈现为淡蓝色胶体体系。图7-B为经冻干后INS-NPs的表面形态,可明显观察到大量球形粒子,且分散性良好。而上述INS-NPs经Eudragit L100肠溶材料包裹后所制备的INS-NPs L100肠溶制剂,呈片块状,表面仅可观察到少量球形纳米粒子(图7-C箭头所示)。上述结果表明,经Eudragit L100肠溶材料包裹后,可将大部分INS-NPs包裹于肠溶制剂内部。

Figure7 Photo pictures of INS-NPs solution (A),and the morphology of INS-NPs (B) and INS-NPs L100 (C) observed by scanning electron microscope
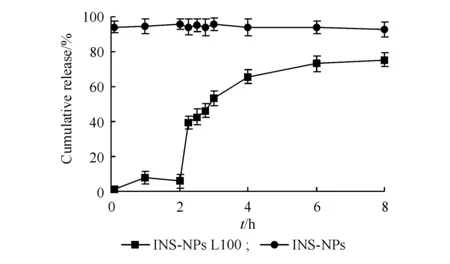
3.2.4 INS-NPs L100体外释放 为模拟药物口服给药后在胃中及从胃进入小肠中的释放,分别考察了INS-NPs和INS-NPs L100在pH 1.0盐酸水溶液(0~2 h)和pH 6.8磷酸盐缓冲液(2~8 h)的药物释放,释放曲线如图8所示。结果显示,INS-NPs在pH 1.0盐酸水溶液中,5 min时已释放94.2%,最大累积释放量为95.83%;INS-NPs L100在pH 1.0的盐酸水溶液中2 h的累积释放量为8.01%,在pH 6.8的磷酸盐缓冲液8 h的累积释放量为67.31%,较INS-NPs有明显的肠溶缓释效果。

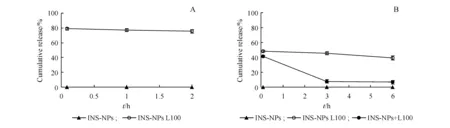
3.2.5 INS-NPs L100在人工胃液和人工肠液中的稳定性 为进一步确证INS-NPs L100能提高在胃肠道中的稳定性,本研究对INS-NPs L100和INS-NPs在SGF和SIF中的稳定性进行了评价,结果如图9所示。
图9-A显示,INS-NPs在人工胃液中5 min后胰岛素浓度已低于检测限,表明INS-NPs中的胰岛素可迅速被胃蛋白酶降解,胃稳定性差。而INS-NPs L100在37 ℃的人工胃液中孵育2 h后仍未溶解,胰岛素百分含量高达75.36%,胰岛素降解百分比不足25%。与INS-NPs相比,INS-NPs L100在SGF中的稳定性显著提高,这是由于INS-NPs在人工胃液中胰岛素释放速度快,5 min时已释放大部分药物,导致所释放的胰岛素迅速被胃蛋白酶降解,稳定性差;而INS-NPs L100在人工胃液中药物释放速度慢,大部分胰岛素被包载于肠溶制剂内部,可有效避免胃蛋白酶的降解,稳定性显著提高。
图9-B显示,INS-NPs在人工肠液中稳定性差,5 min后胰岛素浓度已低于检测限。而INS-NPs L100在人工肠液中37 ℃孵育5 min后胰岛素含量约为50%,6 h后胰岛素含量仍为39.28%,稳定性显著提高。此外,研究发现,INS-NPs与Eudragit L100的物理混合物在人工肠液中初始稳定性较好,孵育5 min时胰岛素含量约为40%;但3 h时,胰岛素含量已降至10%以下,这可能是由于Eudragit L100可以抑制胰酶活性,从而提高胰岛素稳定性。与INS-NPs相比,INS-NPs L100可显著提高胰岛素在人工肠液中的稳定性,这可能是由于以下两方面原因:一方面是由于Eudragit L100可能会抑制胰酶活性,使稳定性提高;另一方面可能是由于将INS-NP制备成肠溶制剂后,粒径增大,在人工肠液中药物释放速度明显变慢,进而提高了胰岛素的稳定性。
上述结果表明,与INS-NPs相比,INS-NPs L100可显著提高胰岛素在人工胃液和人工肠液中的稳定性,有望提高胰岛素口服降血糖作用。

3.3 INS-NPs L100对健康大鼠的降血糖作用
以皮下注射胰岛素溶液为阳性对照组,对INS-NPs、INS-NPs L100、空白肠溶纳米粒(NPs L100)经口给予健康大鼠后的降血糖作用进行了评价,结果如图10所示。结果显示,经皮下注射给予大鼠胰岛素溶液后,血糖浓度迅速下降,1.5 h降至最低水平,4 h后恢复至正常血糖浓度,降血糖作用约持续了4 h。经口给予大鼠空白肠溶制剂(NPs L100)后,无明显降血糖作用,表明本研究所使用的载体材料对血糖无明显作用。经口给予INS-NPs的大鼠在给药后2 h血糖浓度出现略微降低,在2.5 h血糖浓度降至最低,为初始血糖浓度的94%,几乎无明显降血糖作用;经口给予INS-NPs L100的大鼠在2 h血糖浓度开始降低,2.5 h血糖浓度为初始浓度的91%,于3.5 h降至最低,为初始浓度的76%,具有明显的降血糖作用,且降血糖作用约持续了8 h。此外,经口给予INS-NPs和NPs L100后0.5 h血糖浓度均出现异常升高现象,可能是由于在大鼠尾静脉取血时对动物造成一定的刺激所导致的应激反应。
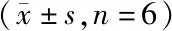
上述结果表明,与皮下注射胰岛素溶液相比,INS-NPs L100降血糖作用持续时间更久,具有明显的缓释效果。与INS-NPs相比,INS-NPs L100降血糖作用更优。这与体外释放结果及在人工胃液和人工肠液中的稳定性结果相一致。将胰岛素制备成INS-NPs,直接灌胃后,由于药物在胃中释放速度极快,5 min即可达到90%以上,导致所释放的胰岛素在胃蛋白酶作用下快速失活,从而导致无明显的降血糖作用。而对于INS-NPs L100,其在胃液中释放速度极慢,2 h时释放量不足8%,从而使胰岛素在胃中稳定性大幅度提高;经胃排空作用进入肠段后,肠溶载体逐渐溶解,释放出INS-NPs,由于其粒径增大,药物释放速度减慢,肠中稳定性提高,可保证部分在胰岛素INS-NPs凭借脂质材料的亲脂性,以整体形式进入体循环,逐渐释放胰岛素,发挥持续降血糖作用。
4 讨 论
胰岛素与其他大分子蛋白质多肽类药物一样,受到细胞间紧密连接(1~5 nm)的限制,不能穿透细胞旁通路。INS-NPs在肠道的吸收主要有两种基本机制,一种是纳米粒黏附于肠上皮黏液层(由杯状细胞产生)通过细胞间通道吸收;另一种是通过跨细胞途径的渗透(M细胞内吞作用;被动扩散通过肠细胞、纤毛细胞)[11]。
本研究使用安全无毒的两亲性聚合物载体材料PEG-PLA和脂质材料磷脂s75作为胰岛素纳米粒的载体。这种杂化系统具备两种载体材料的优势:一方面高分子载体PEG-PLA的亲水性链段PEG可提高载体与胰岛素的相容性和分散性,疏水性链段PLA则控制胰岛素的释放速率,从而可有效地调控载体的亲疏水性、药物释放速率和载药率[15];另一方面,脂质材料磷脂s75能增加纳米粒药物的脂溶性,提高纳米粒在小肠黏膜上的吸收和转运[16];同时,由于胰岛素与胆酸钠形成脂溶性复合物可使胰岛素脂溶性增加,显著提高了纳米粒的EE与稳定性[11]。在此基础上,本研究以Eudragit L100为肠溶载体,将纳米粒包载于肠溶载体中,进一步避免胃液对纳米粒或胰岛素的破坏作用,使纳米粒在小肠段释放,以提高口服胰岛素的生物利用度[11]。本研究制备的INS-NPs L100在pH 1.0的盐酸中的释放明显低于INS-NPs,降血糖效果也较INS-NPs更为显著,作用时间更长,生物利用度更高。
5 结 论
本研究采用乳化溶剂挥发法制备了一种基于聚合物(PEG-PLA)-脂质(磷脂)杂化纳米粒的口服胰岛素肠溶制剂(INS-NPs L100)。当胰岛素与胆酸钠物质的量比为1∶22.5,脂质材料为磷脂s75与PEG-PLA质量比为1∶5时,所制备的INS-NPs L100经复溶后平均粒径为278.0 nm,EE为62.18%;在可显著降低人工胃液中药物释放量,2 h仅释放8.01%,显著提高胰岛素胃中稳定性;在人工肠液环境中可缓慢释药。健康大鼠经口给予INS-NPs L100后,与INS-NPs相比,具有明显的持续降血糖作用。本研究结果表明,本研究所设计的基于聚合物-脂质杂化纳米粒的口服肠溶制剂在蛋白多肽类药物的口服递送中具有良好的应用前景。

