细菌脂多糖对肠道病毒71型感染影响的初步研究
周昕,龙健儿
复旦大学上海医学院基础医学院病原生物学系, 教育部、卫健委、医科院医学分子病毒学重点实验室, 上海 200032
肠道病毒71型(enterovirus 71, EV71)为小RNA病毒科肠道病毒属(Enterovirus)成员,是单股正链RNA病毒[1]。EV71主要感染5岁以下的婴幼儿,可导致婴幼儿手足口病(hand, foot and mouth disease, HFMD)。重症患者可表现为无菌性脑膜炎、脑炎、脊髓灰质炎样麻痹,甚至神经源性肺水肿和肺出血[2-3]。目前EV71的致病机制尚不清楚,也没有针对EV71感染有效的抗病毒药物[4-5]。
肠道病毒主要通过粪-口途径和密切接触传播,在其传播和感染环境中存在着数量巨大的细菌群体[6]。有研究表明细菌可影响多种肠道病毒的感染和传播,菌体脂多糖(lipopolysaccharide, LPS)被认为起着非常重要的作用[7]。
LPS又称为内毒素,是革兰阴性细菌细胞壁的结构组分,主要由疏水性的脂质A和亲水性的多糖(包括核心多糖和O特异性多糖)组成。已有研究报道,LPS可影响多种肠道病毒的稳定性,如脊髓灰质炎病毒、鼠乳腺肿瘤病毒、呼肠孤病毒等[7-8]。在EV71的感染和传播的环境中也存在大量细菌,因此,本研究对细菌LPS是否影响EV71的稳定性和感染能力进行了初步探究。
1 材料与方法
1.1 材料
横纹肌肉瘤(rhabdomyosarcoma, RD)细胞、人结肠癌细胞(HT-29细胞)细胞购自中国科学院上海生命科学研究院。EV71病毒株(GenBank 登录号:HQ891927, 064-Shanghai)由本实验室分离并保存。反转录试剂盒PtimeScript RT reagent Kit购自TaKaRa公司,Hieff qPCR SYBR Green Master Mix (No Rox)购自上海翊圣生物科技有限公司,LPS(#L2880)购自Sigma公司,EV71-VP1(#MAB1255-M05)抗体购自Abnova公司,β-actin(#8H10D10)抗体购自Cell Signaling Technology公司,抗大肠埃希菌(Encherichiacoli,E.coli)抗体(anti-E.coli抗体)(#ab68450)购自Abcam公司,辣根过氧化物酶(horseradish peroxidase, HRP)标记山羊抗鼠Ig(H+L)(#WB0177)购自上海威奥生物科技有限公司。
1.2 方法
1.2.1 细胞培养RD细胞用含10%胎牛血清的DMEM/HG培养基培养,HT-29细胞用含10%胎牛血清的 McCOY 5A培养基培养。细胞均置于5% CO2、37 ℃恒温细胞培养箱中培养,当细胞生长融合至95%~100%单层时进行传代。
1.2.2 病毒TCID50的测定病毒液处理:①等量EV71与相同浓度LPS(1 000 μg/ml)在42 ℃分别热处理0、0.5、1、2、4、6 h;②等量EV71与不同浓度LPS(0、50、100、500、1 000 μg/ml)在42 ℃分别热处理2 h;③等量EV71与相同浓度灭活E.coli(OD=0.5)在42 ℃分别热处理0、0.5、1、2、4、6 h;④等量EV71与不同浓度灭活E.coli(OD=0、0.1、0.5、1)在42 ℃分别热处理2 h。RD细胞以1×104个/孔的密度接种于96孔板中,将上述处理后的病毒液分别以10倍梯度进行稀释,不同稀释度的病毒感染RD细胞,72 h后通过MTT法测定细胞活力。定义细胞活力<50%认为有明显的CPE且超过半数感染,通过细胞活力变化检测病毒TCID50[9]。
1.2.3 实时聚合酶链反应检测病毒基因的拷贝数为检测LPS对EV71黏附、侵入及复制过程的影响,将EV71(MOI=0.5)与不同浓度LPS(0、50、100、500、1 000 μg/ml)在37 ℃温育1 h,然后①黏附阶段,EV71与LPS的混合液在4 ℃分别温育RD细胞和HT-29细胞2 h,弃病毒液,TRIZOL收集细胞;②侵入阶段,EV71与LPS的混合液在37 ℃分别感染RD细胞和HT-29细胞2 h,弃病毒液,TRIZOL收集细胞;③复制阶段,EV71与LPS的混合液在37 ℃分别感染RD细胞和HT-29细胞12 h,弃病毒液,TRIZOL收集细胞。为检测LPS对EV71释放过程的影响,将EV71(MOI=0.5)与LPS(500 μg/ml)的混合液在37 ℃温育1 h后,分别感染HT-29细胞0、24、48、72、96 h,TRIZOL分别收集感染不同时间点的细胞和培养上清液。抽提RNA,按TaKaRa反转录试剂盒PtimeScript RT reagent Kit说明书进行cDNA合成,按上海翊圣生物科技有限公司Hieff qPCR SYBR Green Master Mix (No Rox)说明书进行聚合酶链反应,并用2-ΔΔCt方法计算mRNA的相对表达量。病毒蛋白VP1和内参基因β-actin的mRNA引物设计如下:
VP1-F(5′-AGGAGATAGCGTGAGCAGAG-3′);
VP1-R(5′-G C T G G A A C C T T G C C T G T A T-3′);
β-actin-F(5′-GAAGTACCCCATCGAGCACG-3′);
β-actin-R(5′-GGATAGCACAGCCTGGATAG-CA-3′)。
1.2.4 病毒纯化① RD细胞接种于75 cm2细胞瓶中,用MOI=1的病毒液感染细胞2 h,弃病毒液,PBS洗涤细胞3次,加入含4% FBS的DMEM培养基,待细胞完全病变后收集培养上清液;② 取适量HFMD患者粪便,研钵研磨粪便并用PBS稀释,离心后收集上清液。在①、②收集的上清液中分别加入终浓度10% 的聚乙二醇,4 ℃放置过夜。离心,弃上清液,4 ℃溶解。离心,弃沉淀物,收集上清液。离心管底部加30%的蔗糖溶液作垫层,将收集的病毒液加于垫层上,超速离心。弃上清液,用适量PBS重悬沉淀物,4 ℃溶解后于 -80 ℃ 保存。
1.2.5 蛋白斑点杂交将EV71(总质量为100 ng)和不同浓度LPS(0、50、100、500、1 000 μg/ml)的混合液(总体积为10 μl)在37 ℃温育1 h,然后尼龙膜上点样,并使液体自然风干。尼龙膜在室温封闭 2 h,与相应的一抗4 ℃孵育过夜,再与相应的辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗在室温孵育1 h,用化学发光液(enhanced chemiluminescence, ECL)检测。
1.2.6 蛋白免疫印迹法收集的细胞样品蛋白定量后,用含十二烷基硫酸钠(sodium dodecyl sulfate, SDS)的缓冲液处理,煮沸10 min。将上述制备好的蛋白样品经10%十二烷基磺酸钠 -聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,电转移法转印到聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜上,在室温封闭2 h,与相应的一抗4 ℃孵育过夜。次日,与相应的HRP标记的二抗在室温孵育1 h,用化学发光液检测。
1.3 统计学分析
统计分析采用Graphpad Prism 6软件,数据以均数±标准差(SD)表示,用两独立样本均数t检验,P<0.05为差异有统计学意义。
2 结果
2.1 LPS对EV71热稳定性的影响
为研究LPS对EV71热稳定性的影响,将相同浓度LPS与等量EV71温育后,再经42 ℃热处理,分别测定不同时间的热处理后残留的病毒活力。结果显示,随着热处理时间延长,病毒活力逐渐丧失,但经LPS处理过的与未经LPS处理的相比,病毒活力丧失速度减缓(图1A)。将不同浓度LPS与等量EV71温育后再经42 ℃热处理2 h,以不加LPS且未热处理的病毒活力定义为100%。结果显示,不加LPS的病毒被热处理后活力丧失50%,而经LPS处理的病毒残留活力与LPS浓度呈正相关:用低浓度LPS处理,残留病毒活力较低;而以高浓度LPS处理,残留病毒活力较高(图1B)。
由于LPS是细菌菌体的重要组分,为确认细菌菌体对EV71热稳定性的影响能力,将热灭活的E.coli与EV71温育,再经热处理后测定残留病毒活力。结果显示,热处理2 h后,病毒的活力显著丧失,但经E.coli处理后的病毒,活力丧失速度减缓(图1C);且残留病毒活力与加入E.coli的剂量呈正相关(图1D)。上述结果表明,LPS及灭活的E.coli菌体均可增强EV71的热稳定性。
2.2 LPS对EV71感染过程的影响
EV71对细胞的感染包括黏附、侵入、胞内复制、释放过程。为确认LPS对EV71感染过程的影响,将不同浓度LPS与等量EV71温育,并以不加LPS的病毒作为对照。在黏附阶段,混合液与细胞在4 ℃作用2 h。结果显示,经LPS处理后,黏附在细胞表面的病毒基因拷贝数较对照组均降低(图2A、B)。在侵入阶段,混合液在37 ℃感染细胞2 h。结果显示,经LPS处理后,细胞内病毒基因拷贝数较对照组均显著降低(图2C、D)。在细胞复制阶段,混合液在37 ℃感染细胞12 h。结果显示,经LPS处理后,细胞中病毒基因拷贝数较对照组均降低(图2E、F)。在释放过程阶段,等量EV71与相同浓度LPS温育,然后感染HT-29细胞0、24、48、72、96 h,并以未加LPS的病毒作为对照。结果显示,经LPS处理后,细胞内病毒基因拷贝数均低于对照组,在感染72 h后释放于培养上清液中的病毒滴度也显著低于对照组(图2G、H)。以上结果表明,LPS可抑制EV71的黏附、侵入、胞内复制及释放过程。
2.3 LPS与EV71的结合可能性分析
LPS可以增强EV71的热稳定性并抑制EV71的感染过程,推测其可能与EV71相结合。为检测LPS能否与EV71相结合,将等量EV71与不同浓度LPS温育,然后用不同的抗体进行蛋白斑点杂交实验。结果显示,当抗体为anti-E.coli时,斑点印迹的深浅与LPS浓度呈正相关;当抗体为anti-VP1时,斑点印迹的深浅与LPS浓度呈负相关(图3A)。
为进一步检测HFMD患者体内的EV71能否与肠道中菌体LPS结合,将从病毒感染细胞后增殖产生的上清液及HFMD患者粪便中分离纯化的EV71,用免疫印迹试验检测纯化病毒液与anti-VP1和anti-E.coli抗体的结合情况。结果显示,上清液和粪便中纯化出的病毒液均可被anti-VP1抗体识别(图3B),但只有粪便中纯化出的病毒液可被anti-E.coli抗体识别(图3C)。上述结果提示,LPS可能与EV71结合。
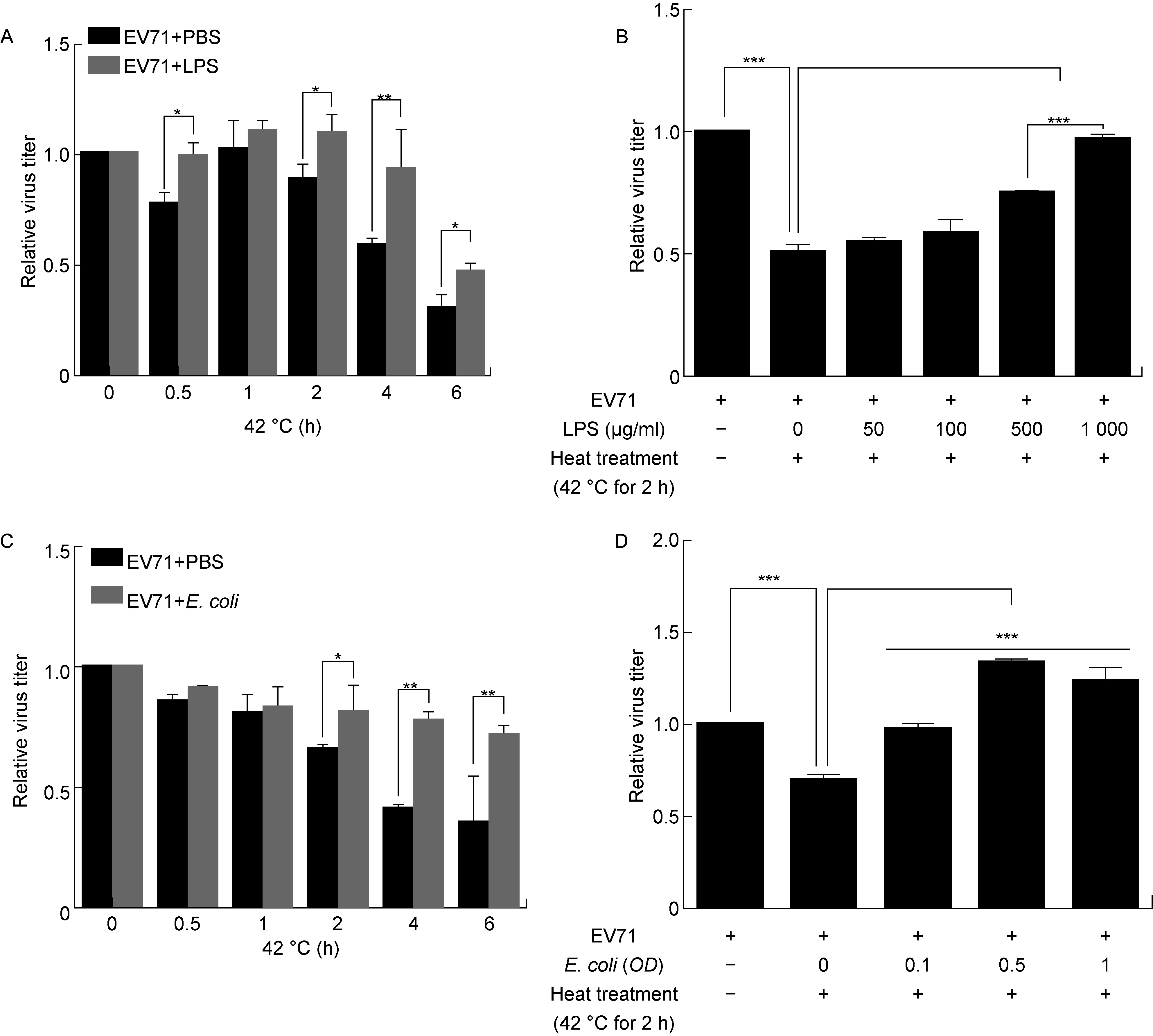
A:LPS increased the thermal stability of EV71. Mixture of EV71 and LPS (1 000 μg/ml) or PBS was heated at 42 ℃ for the indicated hours, then the virus TCID50was detected. B: LPS increased the viral thermal stability in a LPS concentration-dependent manner. EV71 was treated by LPS at indicated concentrations, then incubated at 42 ℃ for 2 h, then the virus TCID50were detected. C: The inactivatedE.coliincreased the thermal stability of EV71. The inactivatedE.coli(OD=0.5) were mixed with EV71 and heated at 42 ℃ for the indicated hours, then the virus TCID50was detected. D: The thermal stability of EV71 was dependent onE.coliODvalues. EV71 was treated by inactivatedE.coliat indicated concentrations, then incubated at 42 ℃ for 2 h, then the virus TCID50were detected. Data showed as the relative folds in comparision with that of input virus without treatment by heat and LPS orE.coli.*P<0.05;**P<0.01;***P<0.001.
图1 LPS可增强EV71的热稳定性
Fig.1 LPS increased the thermal stability of EV71

A:Effect of LPS on the attachment of EV71 to RD cells. B: Effect of LPS on the attachment of EV71 to HT-29 cells. C: Effect of LPS on the entry of EV71 into RD cells. D: Effect of LPS on the entry of EV71 into HT-29 cells. E: Effect of LPS on EV71 replication in RD cells. F: Effect of LPS on EV71 replication in HT-29 cells. G: Relative viral genome copies in HT-29 cells. H: Relative viral genome copies in HT-29 cell culture supernatant.The data showed the relative folds of viral genome copies normalized by β-actin.*P<0.05;**P<0.01;***P<0.001.
图2 LPS抑制EV71的感染过程
Fig.2 LPS inhibited the infection process of EV71

A:LPS binding to virus detected by dot-blot. Purified EV71 (100 ng in each dot) were incubated with LPS at indicated concentrations for 1 h to the protein dot blot hybridization. B: Western blot to detect the viruses from HFMD patients and the cell culture supernatant by anti-VP1 antibodies. C: Western blot to detect the viruses from HFMD patients and the cell culture supernatant by anti-E.coliantibodies.
图3 LPS与EV71结合的分析
Fig.3 Analysis of the combination of LPS and EV71
3 讨论
肠道病毒传播和感染时,会接触到大量的细菌[6, 10]。研究表明,细菌可影响多种肠道病毒的稳定性和感染能力,其菌体组分LPS被认为在此过程中起着非常重要的作用[7]。
细菌LPS可影响多种肠道病毒的稳定性。在正常生理条件下,病毒可保持结构稳定;当温度升高时,病毒的稳定性遭到破坏,活力下降,感染能力降低。研究显示,LPS可通过直接与脊髓灰质炎病毒结合,增强病毒的热稳定性及对氯漂白剂的抵抗能力[11-13]。LPS还可增强其他小RNA病毒(如埃可病毒30、柯萨奇病毒A21和B5)的耐热性,对氯漂白剂、紫外线(UV)等的耐受性,使病毒能够稳定存在[14]。LPS和革兰阳性菌的成分肽聚糖也可增强呼肠孤病毒的热稳定性,但是具体的分子机制并不清楚[8]。由于在极端生理条件下,哺乳动物体温有可能达到42 ℃;在实验条件下,42 ℃处理病毒,病毒活性丧失速度减缓,容易检测出病毒的活性变化,因此我们选择了42 ℃进行实验来检测LPS对EV71热稳定性的影响。在本研究中,通过将LPS处理过的病毒再进行热处理,测定残留病毒活力,发现LPS处理组病毒活力丧失速度更慢,且残留病毒活力与LPS浓度呈正相关,提示LPS可增强EV71的热稳定性。利用灭活的E.coli处理病毒也得到相似的结果,这与上述研究报道的结果一致[7-8, 11-14]。
LPS还可影响多种肠道病毒的感染过程。如脊髓灰质炎病毒进入细胞由细胞表面的脊髓灰质炎病毒受体(poliovirus receptor, PVR)介导,LPS能够促进病毒与靶细胞表面的PVR结合,使病毒黏附在靶细胞表面,从而促进病毒感染细胞[12];鼠乳腺肿瘤病毒通过结合LPS后激活TLR4信号通路,刺激细胞产生IL-6,然后诱导B细胞产生IL-10,建立一个免疫抑制的微环境,从而使病毒能够持续性感染[15-17]。在本研究中,我们用LPS处理的病毒感染不同类型的细胞,观察在病毒黏附、侵入、胞内复制、释放过程中病毒基因拷贝数的变化,发现LPS处理组病毒基因拷贝数在病毒感染过程中较对照组均有不同程度的降低,提示LPS可以抑制EV71的感染过程,这与已经报道的LPS对其他病毒感染影响的结果不同[12, 15-17]。LPS抑制EV71感染的机制尚不明确,我们分析有以下可能的原因:第一,LPS与EV71的结合阻止了EV71黏附在靶细胞上,从而抑制病毒的感染。由于EV71黏附细胞需要病毒VP1与细胞受体结合,而我们通过蛋白斑点杂交和免疫印迹试验检测发现LPS可以竞争性抑制anti-VP1抗体与病毒的结合似乎也表明了这一点。第二,LPS被Toll样受体(Toll like receptor, TLR)识别后,可能通过激活TLR4信号通路,进一步激活下游的核转录因子(nuclear factor kappa B, NF-κB)信号通路,诱导产生多种抗病毒细胞因子,例如TNF-α和IFN,阻止病毒的感染。LPS影响EV71感染的作用机制还需进一步的研究。
综上所述,本研究发现细菌LPS可增强EV71的热稳定性,抑制EV71的感染过程,推测LPS可能与EV71相结合。该结果可以加深我们对EV71感染及其致病过程的理解,对临床防治EV71感染具有一定的指导意义。

