门静脉高压症对伴门静脉癌栓肝癌患者术后生存的影响
李清华,崔龙久,刘双海
(1.东南大学医学院附属江阴医院/江阴市人民医院 肝胆胰外科,江苏 江阴 214400;2.东方肝胆外科医院胆道四科一病区,上海 201805)
肝细胞肝癌(hepatic carcinoma,HCC,以下简称肝癌)是全球常见的恶性肿瘤之一,HCC侵犯门脉系统是影响患者预后最重要因素之一;而门静脉高压是导致门静脉癌栓患者预后差的重要原因之一[1-2]。欧洲肝脏协会临床指南把门静脉高压及门静脉癌栓均列为HCC的手术禁忌证[3]。但随着手术技术及围手术期护理的不断改善,经过严格的术前评估后,手术切除也能明显改善这类患者预后。有报道称伴门静脉癌栓的HCC患者术后5年生存率为4%~42%,伴门静脉高压的肝癌患者术后5年生存率为28.9%~57.1%[4]。目前对伴门静脉高压及门静脉癌栓的HCC患者治疗选择仍存争议,本研究为此探讨门静脉高压对合并门静脉癌栓的HCC患者术后预后的影响。
1 资料和方法
1.1 一般资料
回顾性分析2008年1月至2010年12月在东南大学医学院附属江阴医院和东方肝胆外科医院行有效性肝切除的674例肝癌患者临床资料,诊断均经术后病理证实。纳入标准:(1)肝细胞癌伴门静脉癌栓;(2)肝功能Child-Pugh A或B级;(3)残肝体积大于50%,具有可切除性。排除标准:(1)有肝外远处转移;(2)伴有其他恶性肿瘤者;(3)术前接受其他抗肿瘤治疗;(4)合并其他疾病,无法耐受手术。根据纳入、排除标准最终68例纳入该研究,按照是否出现门静脉高压分为门静脉高压组(35例)和非门静脉高压组(33例)。有效性切除定义为肿瘤完全切除且显微镜下切缘明确阴性,癌栓全部取净或切除。临床显著性门静脉高压症(clinically significant portal hypertension,CSPH)定义为:上消化道内镜检测到食管静脉曲张,或脾脏肿大(最大直径>12 cm)同时伴血小板减低(PLT<1 011/L)。
1.2 随访及研究终点
所有患者定期门诊复查,复查内容包括:每月检查血清AFP和B超,每3个月行CT或者MRI检查。复发诊断标准:术后TACE显示有肿瘤血管影;B超、CT或MRI检查发现新病灶并伴有AFP升高。若AFP升高,但影像学检查显示病灶不典型或者未见新病灶,必要时可行穿刺活检。主要研究终点为患者死亡,次要研究终点为复发。总体生存时间定义为手术时间至患者术后死亡时间或随访终止时间的间隔。复发时间(time to recurrence,TTR)定义为手术时间至复发时间的间隔。
1.3 统计学分析
对分类变量的比较用Pearsonχ2检验或Fisher精确概率法,对连续性数值变量用Student'st检验(变量满足正态分布)或Mann-WhitneyU检验(非正态分布变量)。单因素分析采用Kaplan-Meier法绘制曲线、Log-Rank检验比较差异性,单因素P<0.1的变量纳入多因素分析。用Cox比例风险模型进行多因素分析。生存率及复发率计算采用寿命表法。所有数据均采用SPSS 23.0软件分析。P<0.05表示差异有统计学意义。
2 结果
2.1 两组术前术中情况比较
本组68例患者的基本临床病理特点,详见表1,其中男57例(83.8%),女11例(16.2%),中位年龄47.5(24~67)岁。60例患者(88.2%)乙肝表面抗原阳性。11例患者(16.2%)门静脉癌栓属于III~IV型。两组中,Child-Pugh A级均占80%以上,肿瘤直径均大于5 cm,约85%以上的患者有子灶。患者肿瘤分化均较差,中低分化占80%以上。术前临床资料,除CSPH组男性比例及术前血小板值和非CSPH组比稍低外(P<0.05),其余变量组间比较无统计学差异(P>0.05)。术中情况,与非CSPH组比,CSPH组的手术切缘R0比例较低,肝硬化比例较高(P<0.05),其余变量组间无统计学差异(P>0.05)。见表1。
2.2 两组总体生存中位时间和1、3年总体生存率比较
CSPH组和非CSPH组的总体中位生存时间(mediate survival time,MST)分别为12.43个月和13.62个月,两组比较无统计学差异(P=0.349,图1)。两组的1、3年总体生存率分别为51%、26%和68%、38%(P=0.349)。在随访中,有53例术后出现复发,总体1、3、5年复发率分别为71%、80%、85%,中位TTR为4.24个月(表2)。CSPH组和非CSPH组的1、3年复发率分别为86%、95%和56%、64%,差异有统计学意义(P=0.004,图2)。
2.3 预后因素分析
将基本表中的变量纳入复发的Cox单因素分析中,单因素结果显示:CSPH(P=0.005)、术前血小板小于1011/L(P=0.012)、HBeAg阳性(P=0.012)、肝硬化(P=0.017),这些变量有统计学意义,纳入多因素分析示:CSPH(HR=2.13,P=0.009)、HBeAg阳性(HR=1.89,P=0.024)是影响肿瘤复发的独立危险因素(见表3)。
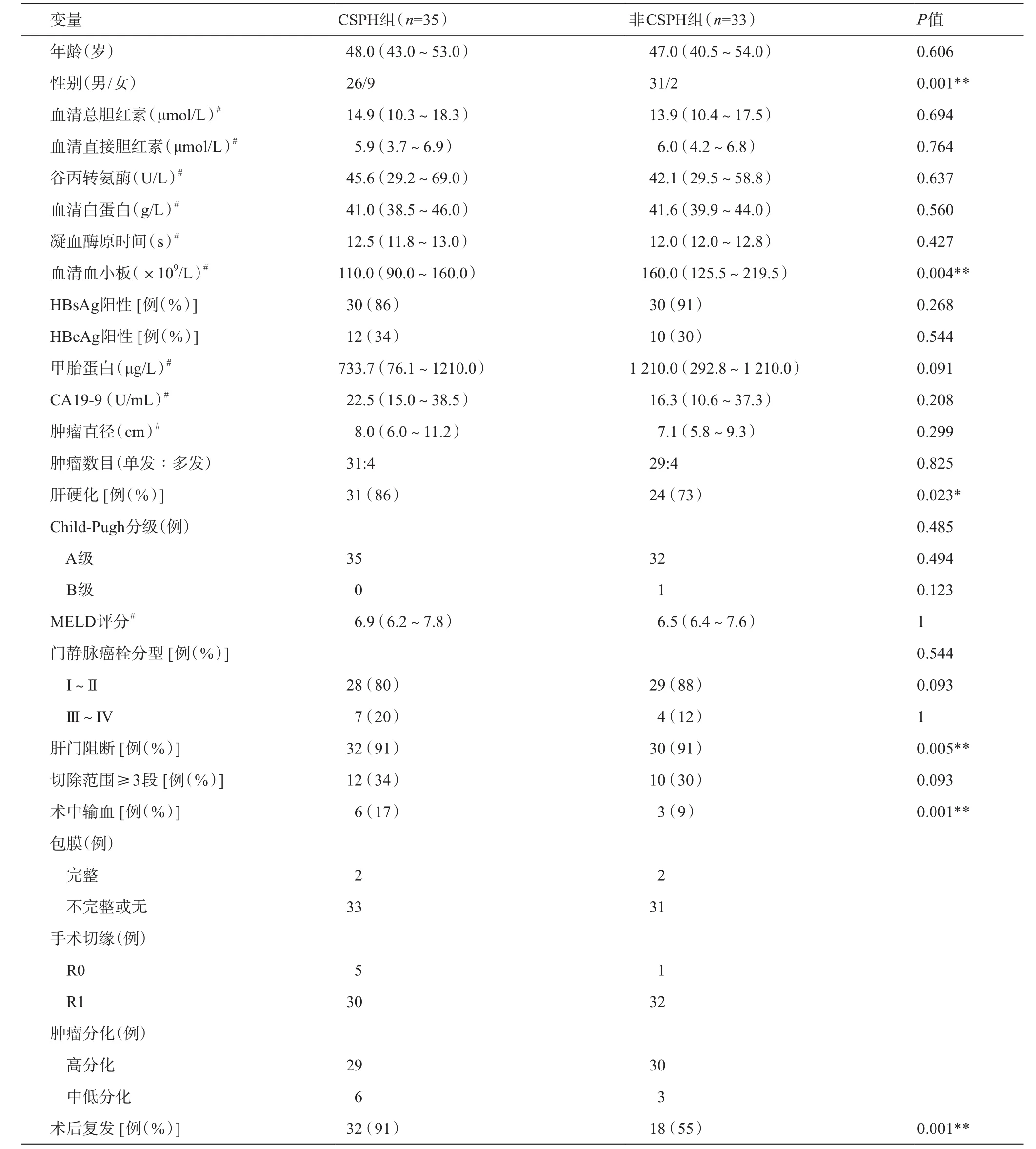
表1 两组基本资料及手术情况
CSPH和HBeAg与伴门静脉癌栓的肝癌患者术后复发密切相关依据。与非CSPH组比,伴CSPH组的中位TTR从5.76个月降至2.85个月,1、3年复发率从56%、64%升至86%、95%(HR2.13,P=0.009) (见图2);与HBeAg阴性的患者相比,HBeAg阳性患者的中位TTR从4.73个月降至2.80个月,1、3年复发率从63%、72%升至87%、94%(HR1.89,P=0.024) (见图3)。
我们制定了一个简单复发评分系统来对比CSPH和HBeAg对伴门静脉癌栓的肝癌复发的影响。根据每个危险因素记为1分,我们将患者分为3组(0分组、1分组、2分组),分别作Kaplan-Meier生存曲线和Cox来分析各组间的差异。我们发现1分组或2分组对肿瘤复发的影响有统计学意义,但与1分组相比,2分组不会增加肿瘤复发机会(P=0.283) (见图4和表4)。
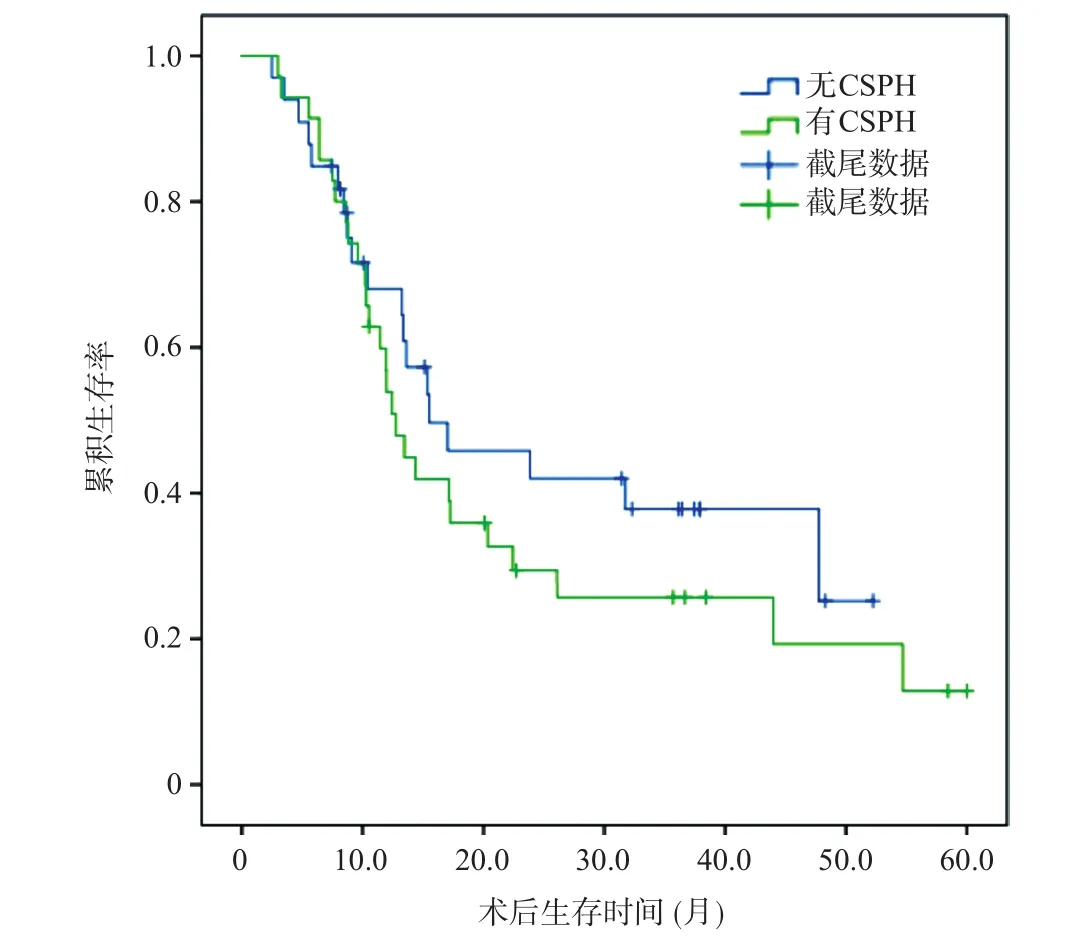
图1 CSPH组与非CSPH组总体生存率的比较(P=0.349)

图2 CSPH组与非CSPH组累积复发率的比较(P=0.004)
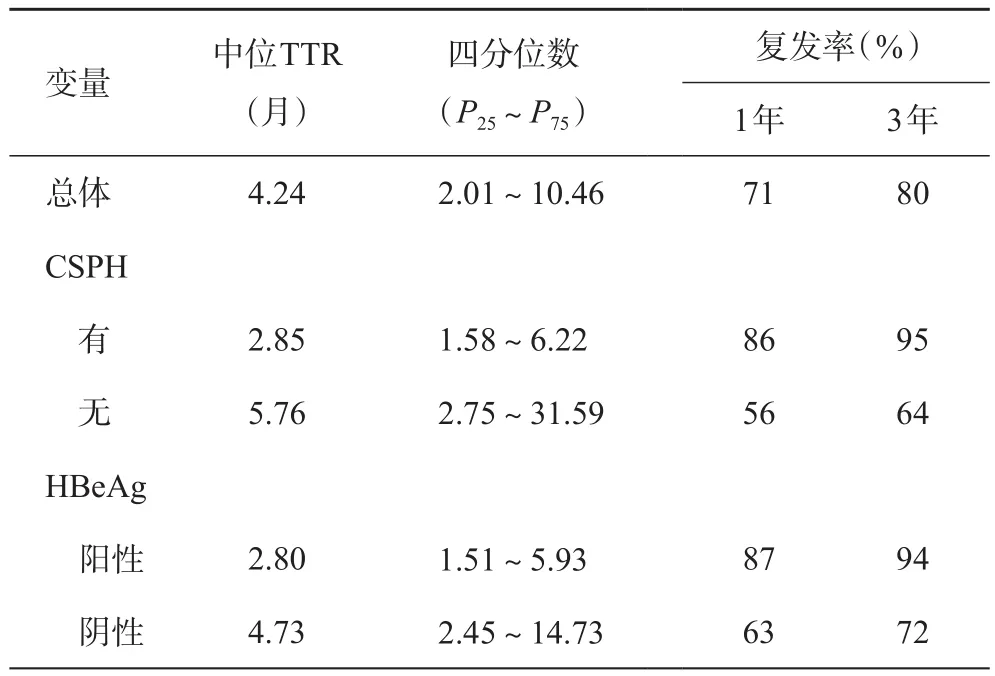
表2 总体肝癌复发情况

表3 影响伴门静脉癌栓的肝癌患者术后复发的单因素及多因素分析
3 讨论
门静脉高压是导致术后肝衰的最重要的因素之一,门静脉癌栓易形成肝内转移,有报道称应列为手术禁忌证[3]。近年来也有研究称在肝功能良好情况下,伴门静脉癌栓或伴门静脉高压,做好术前评估和手术规划,也可行手术治疗[5-6]。目前对此类患者的治疗选择还存争议。Berzigotti等[7]报道称伴门静脉高压增加患者术后病死率和术后并发症发生率。而吴孟超等[1]研究称手术能明显改善伴门静脉癌栓的患者生存预后,不应作为手术禁忌证。中国专家共识指出:肝癌合并PVTT首选手术切除,手术切除病灶可降低门静脉压力,进而改善患者的肝功能和生活质量[8]。以外科手术为主的多学科综合治疗仍然是患者条件允许下肝癌合并门静脉癌栓最好的治疗方法[9]。我们旨在研究CSPH对伴门静脉癌栓的肝癌患者术后的影响。

表4 总体复发评分统计
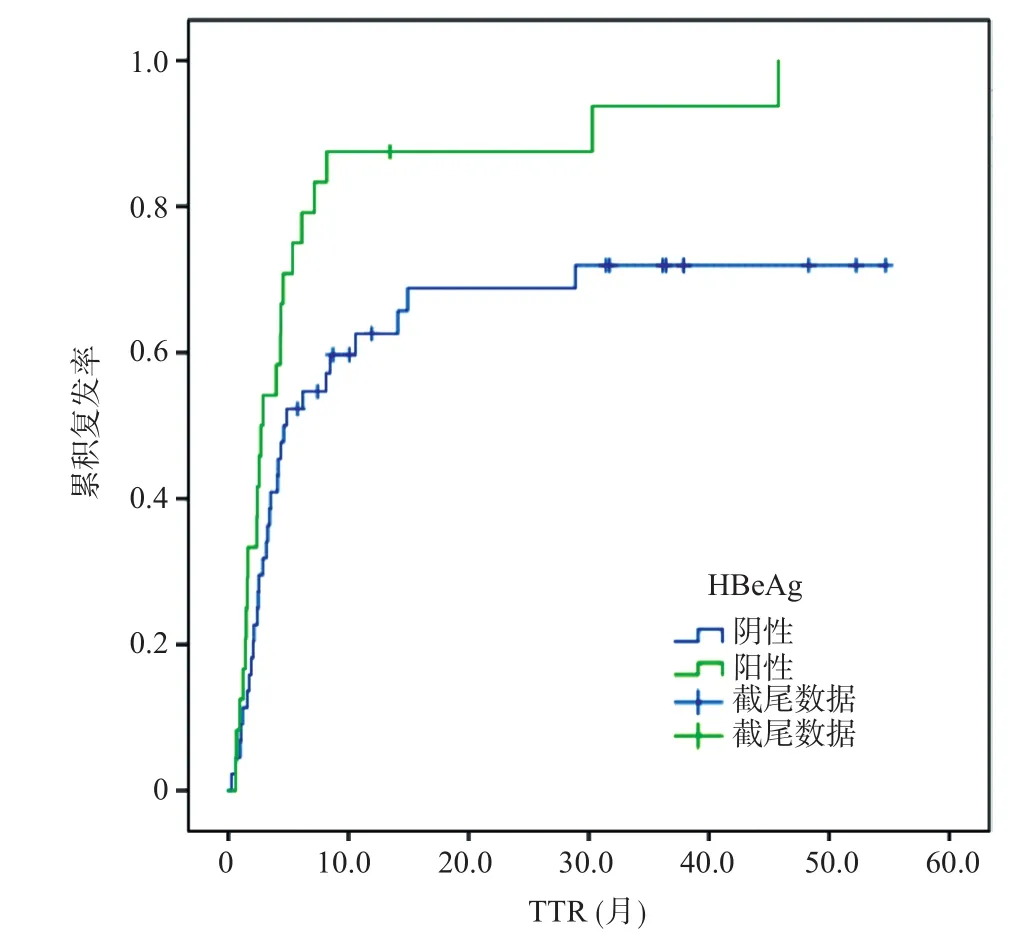
图3 HBeAg阳性与HBeAg阴性的患者累积复发率比较(P=0.01)

图4 复发评分系统中不同分值组累积复发率的比较
本研究发现CSPH对伴门静脉癌栓的肝癌患者术后总体生存无影响,MST达12.43个月,与以往报道结果相一致,明显高于非手术治疗的MST(3.9~9.5个月)。这表明在伴肝功能良好情况下,CSPH不会降低伴门静脉癌栓的肝癌患者的术后生存率,可行手术治疗。但我们发现CSPH影响此类患者的复发率。这可能是因为:(1)门静脉高压推进了门静脉癌栓的癌细胞向肝内扩散速度;(2)门静脉高压常合并肝硬化,储备功能较差,手术切除范围较保守。我们还发现HBeAg阳性也会增加复发率。樊嘉等[10]研究发现年纪较轻,肝硬变较重,HBeAg阳性是影响术后肿瘤复发的独立危险因素。原因可能有:(1)增加肝癌的侵袭性,因为活动性肝炎其肿瘤局部的炎症因子多,可能增加肿瘤的侵袭性;(2)增加肿瘤再发的机会,活动型肝炎可能伴有活跃的肝细胞损伤/修复,因此肝癌发生的机会增加。当我们用简单复发评分系统对CSPH、HBeAg两个因素分析,合并两种因素与合并其中一种因素相比,没有明显增加伴门静脉癌栓的肝癌术后复发率。结果显示两组性别有差异,CSPH组女性较对照组较多,可能原因:(1)有研究称雌激素能够明显的促进大鼠肝纤维化模型血清中抗内皮细胞抗体滴度的升高,导致血管内皮细胞和微血管系统破坏加重,可进一步促进肝纤维化的发展[11],人体是否有类似作用?(2)样本量太少,存在误差。本研究尚有不足之处,病例数太少,其内在机制还待进一步研究。
总之,对伴门静脉癌栓的肝癌患者,临床显著性门静脉高压不应列为绝对手术禁忌证,但需做好术前评估和手术规划,术后密切随访复发情况。

