壳聚糖复合保鲜对草鱼肌肉蛋白质变化的影响
陈 赛,刘永乐,俞 健,李向红,黄轶群,王建辉,王发祥*
(长沙理工大学化学与食品工程学院,湖南省水生资源食品加工工程技术研究中心,湖南 长沙 410114)
草鱼(Ctenopharyngodon idellus)是我国“四大家鱼”之一,在我国各地均有分布,其肉质鲜美、价格实惠,是我国重要的淡水经济鱼类,2017年全国养殖产量为534.56万 t,居淡水鱼之首[1]。然而,草鱼肉水分含量高、组织蛋白酶活性高,保鲜难度较大,宰后贮藏过程中极易腐败,资源浪费严重[2]。目前,国内外研究淡水鱼保鲜技术的报道[3-8]较多,新的保鲜方法也层出不穷,但仍无法突破冷藏过程中鱼肉鲜度迅速下降和货架期短的瓶颈。深入研究保鲜处理对宰后贮藏过程中鱼肉品质和生理变化的影响,有助于揭示鱼肉腐败机制和针对性制定鱼肉保鲜策略。
关于鱼肉的腐败变质,目前普遍认为是由内源酶催化引起的肌肉组织内部生理生化变化和微生物的生长繁殖共同作用引起的[9],在此过程中,鱼肉发生蛋白质降解、脂肪酸败和糖类发酵。在前期研究中,本课题组通过冷杀菌、复合涂膜等技术将草鱼肉冷藏货架期(以二级鲜度为限)延长至10~12 d[10],但冷藏期间鱼肉软化、汁液流失问题仍然十分严重,表明冷藏过程中肌肉蛋白质的变性、降解等变化是草鱼品质下降的一个重要原因。草鱼肌肉中蛋白质是其肌肉组织的最重要组成部分,其含量和完整性(分子质量分布)都与鱼肉的质构、弹性、持水力等品质指标密切相关[11-12]。目前,国内外对淡水鱼的冷藏保鲜研究基本都是对鱼肉鲜度等综合品质进行评价[4-8],对于鱼肉蛋白质在贮藏过程中的变化研究也多集中在其变性、降解和氧化规律,而鲜有单纯从蛋白质视角对比分析保鲜和未保鲜处理鱼肉在冷藏过程中蛋白质变化规律的研究报道。
本研究以新鲜草鱼为对象,利用前期实验筛选到的最优复合保鲜剂(10 mg/mL壳聚糖+5 mg/mL茶多酚+2 000 U/mL溶菌酶)对草鱼片进行保鲜处理,分析冷藏过程中保鲜组肌肉蛋白质的分子质量分布、活性巯基含量、表面疏水性等基本性质与未保鲜对照组的差异,为揭示肌肉蛋白质变化与鱼肉品质下降的关系补充新的生物学证据,也为更有效的保鲜方法及相关产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
新鲜草鱼购于长沙本地菜市场,每尾质量为(1.5±0.2)kg。
壳聚糖(生化试剂)、茶多酚(生化试剂) 上海笛柏化学品技术有限公司;溶菌酶(活力≥20 000 U/mg)国药集团化学试剂有限公司;巯基含量测定试剂盒南京建成生物工程研究所;蛋白Marker 美国Thermo Scientific公司。
1.2 仪器与设备
LC-20A高效液相色谱仪 日本岛津公司;UV 2000紫外分光光度计 上海精宏实验设备有限公司;5430R型高速冷冻离心机 德国Eppendorf公司;T10 basic手持式均质机 德国IKA公司;DYY-12型电泳仪 北京市六一仪器厂。
1.3 方法
1.3.1 鱼肉样品制备
新鲜草鱼于4 ℃水中暂养1~2 h,致死后去头、尾、鳞和内脏,以预冷的无菌水清洗干净后剔除鱼骨并切成鱼片(5.0 cm×3.0 cm×0.2 cm)。分别用无菌水(对照组)和复合保鲜剂(10 mg/mL壳聚糖+5 mg/mL茶多酚+2 000 U/mL溶菌酶)浸泡10 min,沥水3 min后用自封袋包装,置于4 ℃ 冰箱中保藏。样品分别于第0、3、6、9、12天取出,测定其蛋白质相关指标。
1.3.2 挥发性盐基氮含量测定
挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中半微量定氮法测定。
1.3.3 草鱼肌肉蛋白的提取
将鱼肉样品取出后绞碎,准确称取约10 g,加入100 mL 20 g/L的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液,均质30 s后于25 ℃水浴浸提30 min,8 000 r/min离心10 min,收集上清液即为肌肉总蛋白质提取液,备用。
1.3.4 SDS-聚丙烯酰胺凝胶电泳分析
准确吸取1.3.3节中蛋白质提取液0.2 mL于1.5 mL EP管中,加入等体积的2×上样缓冲液(每10 mL含2.5 mL 0.5 mol/L Tris-HCl、2.0 mL甘油、4.0 mL 10 g/100 mL SDS、0.5 mL 0.1 g/100 mL溴酚蓝、1.0 mL β-巯基乙醇),沸水浴5 min,12 000 r/min离心3 min,所得上清液即为待电泳分析样品,参考李强等[13]的方法,以质量分数12%的分离胶进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electropheresis,SDS-PAGE)分析。
1.3.5 高效液相体积排阻色谱分析
将1.3.3节中制备的蛋白质提取液进行真空冷冻干燥,得草鱼肌肉蛋白质冻干粉。称取蛋白质冻干粉,配制成质量浓度为5 mg/mL的蛋白液溶液,8 000 r/min离心20 min,上清液用0.45 μm的微孔过滤膜过滤,参考Liu Yongle等[14]的方法,采用高效液相体积排阻色谱(size-exclusion chromatograghy-high performance liquid chromatograghy,SEC-HPLC)法测定其分子质量分布;同时以甲状腺球蛋白(669 kDa)、醛缩酶A(158 kDa)、牛血清白蛋白(67 kDa)、卵清白蛋白(43 kDa)、辣根过氧化物酶(40.2 kDa)、腺苷酸激酶(32 kDa) 、肌红蛋白(17 kDa)、核糖核酸酶(13.7 kDa)、抑肽酶(6.5 kDa)和VB12(1.35 kDa)为标准品,同样条件下进行SEC-HPLC分析,根据保留时间和分子质量绘制标准曲线,根据标准曲线(回归方程y=-0.570 6x+10.596)估算样品中蛋白质峰的分子质量,将保留时间换算成分子质量的对数(lg Mw),重新绘制SEC-HPLC谱图。
1.3.6 活性巯基含量的测定
准确称取350 mg 1.3.5节制备的草鱼肌肉蛋白质冻干粉,定容至50 mL,参考巯基含量测定试剂盒说明书测定其活性巯基含量。
1.3.7 表面疏水性的测定
称取1.3.5节制备的草鱼肌肉蛋白质冻干粉,配制成质量浓度为10 mg/mL的蛋白质溶液,12 000 r/min离心10 min,上清液用0.45 μm的微孔过滤膜过滤后备用。参考曾茂茂等[15]的方法,采用反相高效液相色谱法进行分析,以15 min之后的峰面积与总峰面积的比值作为疏水性指数,其值越大代表样品的表面疏水性越强。
1.4 数据处理
每组实验进行3~5 个平行,采用Excel软件进行数据处理,数据以平均值±标准差表示,采用Origin 9.0软件作图;SDS-PAGE图谱采用Gel-Pro Analyzer软件辅助分析。
2 结果与分析
2.1 壳聚糖复合保鲜对草鱼肉冷藏过程中TVB-N含量的影响
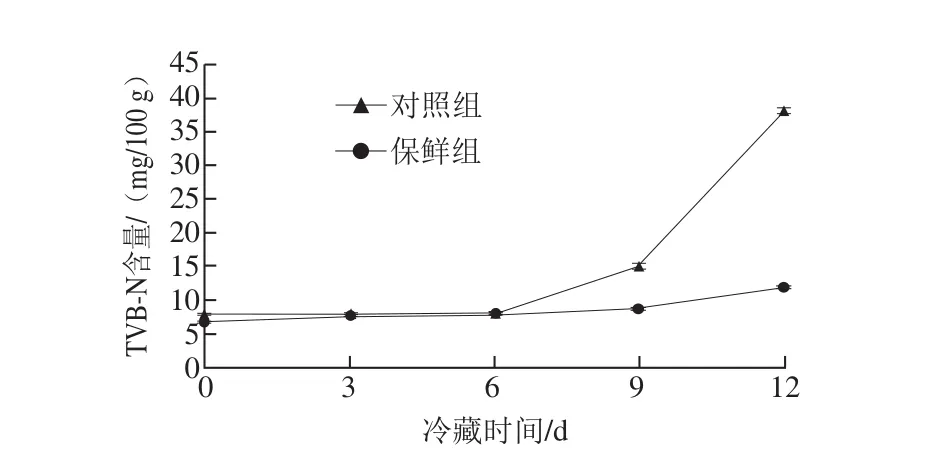
图1 草鱼冷藏过程中TVB-N含量的变化Fig. 1 Change in TVB-N content of grass carp muscle proteins during cold storage
TVB-N是指肉类食品腐败过程中蛋白质分解而产生的氨(NH3)和胺(R-CH2NH4)等碱性含氮物质的统称,其含量越高则表明蛋白质分解越严重,间接地反映了鱼肉品质的变化,是评价鱼肉品质的重要鲜度指标[16-17]。由图1可知,冷藏过程中鱼肉中TVB-N含量呈逐渐上升趋势,冷藏前6 d,TVB-N含量上升缓慢,且保鲜组和对照组无明显差异。冷藏6 d后,对照组TVB-N含量急剧上升,第12天时已达到38.09 mg/l00 g,与贮藏初期相比增加了382%;保鲜组TVB-N含量上升稍缓,第12天时仅为11.82 mg/l00 g,仍在二级鲜度范围[16](不超过20 mg/100 g),这与李凯风等[18]研究涂膜剂对鲫鱼冷藏过程中TVB-N含量变化的结果相似。TVB-N主要是在酶和微生物的作用下产生,杨胜平等[19]研究发现带鱼冷藏过程中TVB-N含量变化与菌落总数变化有很好的相关性,而复合保鲜剂中的壳聚糖、茶多酚、溶菌酶均具有良好的抑菌性[20-23],从而能有效抑制微生物对蛋白质的分解,减缓TVB-N含量的增加。
2.2 壳聚糖复合保鲜对草鱼肉冷藏过程中蛋白质SDS-PAGE图谱的影响

图2 冷藏过程中草鱼肌肉总蛋白SDS-PAGE图谱Fig. 2 SDS-PAGE pattern of total muscle proteins in grass carp during cold storage
如图2所示,图谱上第0天的泳道中清晰可辨的蛋白条带有20~30 条,其中MHC、肌动蛋白以及3 种MLC条带均较为明显,与李强等[13]的研究结果一致。冷藏前6 d,各泳道蛋白条带分布基本相似,保鲜组与对照组也未见明显差异。冷藏超过6 d后,SDS-PAGE图谱开始出现明显变化,保鲜组与对照组可分辨出明显差异:对照组MHC粗条带信号明显降低,伴随着分子质量约130、55~72、18~22 kDa蛋白条带信号的增加,说明大分子蛋白逐渐被降解成小分子蛋白质;而保鲜组蛋白条带变化也有相同趋势,但程度明显较轻;对照组样品的3 条MLC条带基本消失,但保鲜组中这些条带仍清晰可辨,说明保鲜延缓了其降解,这与郑红等[24]的研究结果相似。此外,对照组样品在第9天新增了一条约20 kDa和一条约37 kDa的蛋白条带(图2中箭头所示),但保鲜组中该20 kDa条带在第12天才可分辨,而37 kDa条带直到第12天仍未发现。上述结果进一步证实了冷藏过程中草鱼肌肉蛋白逐步降解的事实,而壳聚糖复合保鲜能有效降低肌肉中特定蛋白质的降解速率。Delbarre-Ladrat等[25]认为鱼体解僵与自溶期的蛋白质分解和内源酶的作用有关;Yu Dawei等[26]以20 mg/mL壳聚糖处理草鱼片,发现冷藏组样品的组织蛋白酶B与B+L活力分别降至初始值的58%与65%,蛋白水解和鱼片软化程度也相应降低。因此,壳聚糖复合保鲜延缓草鱼肌肉蛋白质的降解,除了其抑菌作用外,也可能与其抑制酶活力有关。
2.3 壳聚糖复合保鲜对草鱼肉冷藏过程中蛋白质分子质量分布的影响
SEC-HPLC是测定聚合物结构和分子质量分布最有效的手段之一,可以通过谱图对试样之间分子质量分布进行直观比较。如图3所示,新鲜草鱼肌肉蛋白质(0 d)在SEC-HPLC图谱中有3 个主要的洗脱峰,其中峰1、峰2对应组分的分子质量分别约为5、40 kDa,峰3对应组分的分子质量大于1 000 kDa(色谱柱洗脱极限),说明一部分蛋白质分子以超大聚集体的形式存在。冷藏前6 d,保鲜组和对照组的图谱变化均不明显,这与SDS-PAGE分析的结果相符;冷藏第9天,对照组的峰3面积明显变小,至第12天时几乎完全消失,表明原有蛋白质聚集体逐渐解体,可能与冷藏过程中肌肉蛋白质的不断氧化、降解有关;然而,保鲜组峰3的变化明显滞后很多,冷藏第12天时峰面积占比仍为37.35%,较第0天(39.60%)仅下降了5.68%,表明壳聚糖复合保鲜延缓肌肉蛋白质变化的作用非常明显。此外,随着冷藏时间的延长,对照组峰1的面积比也在不断增加,至第12天时已增加至31.95%,比第0天(18.68%)增加了71.03%,而保鲜组在12 d内几乎无明显变化,这进一步证实了壳聚糖复合保鲜抑制鱼肉蛋白质降解的作用。
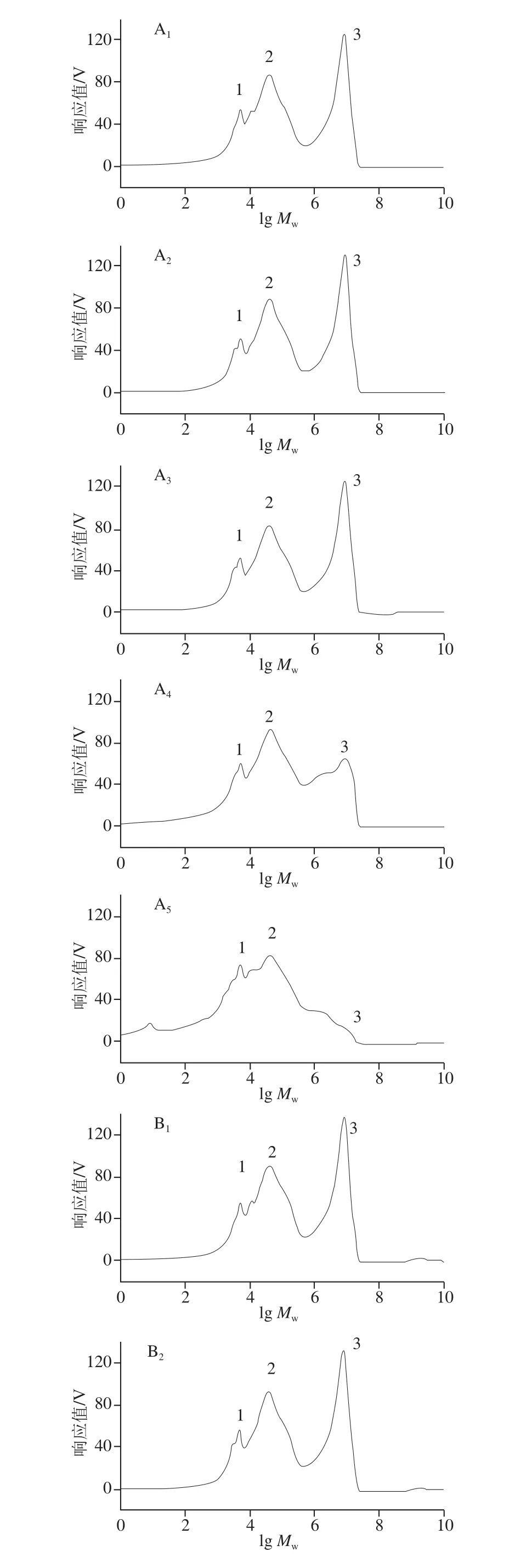

图3 冷藏过程中草鱼肌肉蛋白质分子质量分布变化Fig. 3 Molecular mass distribution of muscle proteins in grass carp at different cold storage times
2.4 壳聚糖复合保鲜对草鱼肉冷藏过程中活性巯基含量的影响

图4 冷藏过程中草鱼肌肉蛋白活性巯基含量变化Fig. 4 Changes in active sulfhydryl group content in muscle proteins of grass carp during cold storage
巯基是蛋白质分子中最具反应活性的功能基团之一,其含量的变化一定程度上反映了蛋白质结构的变化[27-28]。如图4所示,冷藏过程中草鱼肌球蛋白活性巯基含量呈逐渐下降趋势,表明草鱼肌肉蛋白质总体上在不断变化,可能是游离巯基氧化生成二硫键,这与Lu Han等[29]的研究结果一致。相对于对照组,保鲜组活性巯基含量的下降趋势比较平缓,冷藏9 d两组差异尤为明显;冷藏第12天时,对照组活性巯基含量较第0天下降了21.39%,而保鲜组仅下降了9.89%。Ramirez等[30]报道抗氧化剂可与蛋白质结合,从而减缓蛋白质的降解和氧化;而茶多酚具有抗氧化作用,将多酚化合物与壳聚糖混合使用能有效提升壳聚糖的抗氧化活性[31]。因此,壳聚糖复合保鲜能有效减缓肌肉蛋白质的氧化等不利变化。
2.5 壳聚糖复合保鲜对草鱼肉冷藏过程中表面疏水性的影响

图5 冷藏过程中草鱼肌肉蛋白表面疏水性变化Fig. 5 Changes in surface hydrophobicity of muscle proteins in grass carp during cold storage
蛋白质表面疏水性与蛋白质的功能性质密切相关,可反映蛋白质的变性程度,表面疏水性增加表明蛋白的变性程度增加[32-33]。如图5所示,随冷藏时间的延长,保鲜组和对照组草鱼肌肉蛋白质的疏水性指数均呈现先增后降低的趋势,表明冷藏前期表面疏水性逐渐增加,冷藏过程中蛋白质变性伸展,埋藏在蛋白质内部的疏水性基团暴露[13];冷藏后期表面疏水性逐渐下降,可能与蛋白质的过度变性、降解、氧化重折叠和聚合等变化有关[34]。上述变化规律与Benjakul等[35]的研究结果基本一致。尽管保鲜组和对照组草鱼肌肉蛋白质表面疏水性的变化趋势一致,但保鲜组的变化幅度明显较小,表明其蛋白质氧化、变性程度相对较小,说明壳聚糖复合保鲜能使冷藏过程中草鱼肌肉蛋白质的结构和性质维持相对稳定。
3 结 论
冷藏过程中草鱼肌肉蛋白质逐渐发生变性、氧化和降解等变化,但壳聚糖复合保鲜处理能明显减缓其变化程度,在冷藏6 d后对抑制TVB-N含量升高、鱼肉蛋白降解、活性巯基含量下降、表面疏水性变化等蛋白质相关指标变化的作用尤为明显。保鲜能在一定程度上延长鱼肉的货架期,但其对草鱼肌肉蛋白质变化的影响尚缺乏深入探讨,本研究为壳聚糖复合保鲜剂能通过延缓冷藏过程中草鱼肌肉蛋白质的结构和性质变化发挥鱼肉保鲜作用提供了证据,也为今后根据蛋白质理化特征开发更有效的保鲜技术提供了理论依据。

