仿生磷酸钙缓释涂层改性三维支架异位成骨的实验研究
刘 宁,刘昌奎,郭 芳,黄 硕,李 芳
(1 西安医学院口腔医学院口腔颌面外科学教研室,西安 710021;2 军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔医学重点实验室,空军军医大学口腔医院修复科;*通讯作者,E-mail:ningliu@xiyi.edu.cn)
近年来随着种植治疗患者的逐年增多,种植体周围炎的发生率急速增加。种植体周围炎成为影响种植治疗效果,导致种植体脱落失败的重要病因[1]。北京大学口腔医学院对种植修复效果10年回顾性研究结果表明,因种植体周围炎骨吸收导致种植体脱落的种植体数占总脱落种植体数的97.06%[2],种植体周围炎的有效治疗成为亟待解决的关键问题。去蛋白牛骨无机材料(deproteinized bovine bone,DBB)是目前临床广泛应用的治疗种植体周围骨缺损的骨替代材料,但是缺乏成骨诱导能力,限制其成骨效果[3]。淫羊藿苷(icariin,ICA)是一种良好的骨性诱导因子[4],课题组前期通过仿生磷酸钙涂层技术将ICA负载到DBB上,检测改性DBB的生物相容性和体外成骨诱导能力[5]。本研究将改性DBB材料移植入大鼠背部皮下,检测改性DBB在动物体内异位成骨的能力。
1 材料和方法
1.1 实验动物
健康雄性SD大鼠6只,体质量180-220 g,由空军军医大学(原第四军医大学)实验动物中心提供。
1.2 主要试剂和仪器
PBS缓冲液(Hyclone公司,美国),戊巴比妥钠(Sigma公司,美国),多聚甲醛固定液(上海化学试剂厂,中国),淫羊藿苷(源叶生物有限公司,中国),青霉素、氯化钠、碳酸氢钠、二水合磷酸氢钠、二水合氯化镁、二水合氯化钙、TRIS base(国药集团化学试剂有限公司,中国)。超净工作台(Thermo公司,美国),显微镜及照相系统(Nikon公司,日本)。
1.3 仿生矿化磷酸钙涂层的制备
将0.1 g DBB材料浸泡在10 ml 5倍SBF溶液(684 mmol/L NaCl;21 mmol/L NaHCO3;5 mmol/L Na2HPO4·2H2O;7.5 mmol/L MgCl2·2H2O)中24 h,冷冻干燥,则在材料表面形成一层无定型CaP涂层。然后将其浸泡在1 ml饱和SBF溶液(2 mmol/L Na2HPO4·2H2O;40 mmol/L HCl;4 mmol/L CaCl2·2H2O;50 mmol/L TRIS base)中48 h,冷冻干燥,则在无定型CaP涂层表面形成结晶状CaP涂层。如饱和SBF溶液中含有5 mg/L的ICA,ICA会随着结晶状CaP涂层的形成沉积到CaP晶体中。
1.4 实验分组及动物模型制备
实验分为三组:DBB组,未经处理的DBB;CaP组,CaP涂层改性的DBB;ICA-CaP组,CaP涂层内含有ICA的DBB。将各组材料置于96孔板中,每孔放入0.05 g材料(n=6),用PBS润湿材料。1%戊巴比妥钠腹腔注射麻醉大鼠,剃除背部手术区毛发,75%酒精消毒术区。用剪刀于每只大鼠背部做3个5 mm长纵形切口,将三组材料分别小心植入形成的盲袋内。用缝线缝合切口,注意缝合时不要对植入材料形成外在压力,并做好标记,大鼠腹腔注射青霉素。术后观察大鼠精神状态、活动、饮食、切口愈合等一般情况。手术8周后过量戊巴比妥钠腹腔注射处死大鼠,取出背部皮下的植入材料。
1.5 样本组织学染色
1.5.1 样本固定及切片制备 分离样本外包筋膜等多余组织,将样本用PBS漂洗。将组织块浸泡于4%多聚甲醛,4 ℃条件下放置24 h。流水冲洗样本,去除多聚甲醛。将组织块浸泡于EDTA脱钙溶液中脱钙,每3 d更换一次溶液,持续14 d。常规脱水石蜡包埋,样本10 μm切片,每个标本切片4张,分别用于HE染色和Masson染色。
1.5.2 HE染色 常规脱蜡至水:二甲苯30 min,二甲苯30 min,无水乙醇5 min,无水乙醇5 min,95%乙醇5 min,85%乙醇5 min,75%乙醇5 min,PBS 5 min。样本上滴加苏木素染色液,染色1 min,PBS中浸泡5 min。样本上滴加伊红染色液,染色1 min,自来水冲掉染液。无水乙醇脱水,晾干,二甲苯中处理5 min,中性树胶封片。
1.5.3 Masson染色 常规脱蜡至水同1.5.2。样本上滴加苏木素染色液,染色5 min,PBS中浸泡5 min。样本上滴加复合染色液,染色5 min,自来水冲掉染液。样本上滴加亮磷钼酸,染色1 min,甩干。样本上滴加亮绿色染色液,染色3 min,自来水冲掉染液。晾干,二甲苯中处理5 min,中性树胶封片。
1.6 组织学观察分析新生骨
每组选取6张HE染色切片,每张切片随机选取3个视野,由2位双盲实验者(对实验分组不了解的实验者)观察,采用Image Pro Plus软件对数据进行半定量分析新生骨面积百分比。新生骨面积百分比=新生骨面积/切片截面总面积×100%。
1.7 统计学分析
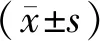
2 结果
2.1 实验动物一般情况观察
所有大鼠均顺利完成手术。大鼠术后饮食、活动良好,背部切口无红肿、无渗出及裂开、愈合良好。到8周取材期大鼠全部存活,背部植入材料无丢失,各组植入材料均成近似圆形的硬性组织,中间厚,周边薄。
2.2 HE染色观察
HE染色切片结果显示,DBB组的材料周围包绕着纤维组织,少量新生骨样组织存在(见图1A)。CaP组的材料表面可见新生骨,散在分布(见图1B)。ICA-CaP组的材料表面可见多处新生骨生成(见图1C)。
2.3 Masson染色观察
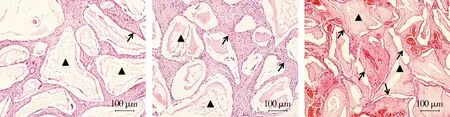
Masson染色切片结果显示,DBB组的材料周围包围着绿色的纤维组织,少量新生骨存在(见图2A);CaP组的材料表面可见紫红色的新生骨(见图2B);ICA-CaP组的材料表面可见多处紫红色的新生骨生成(见图2C)。
A. DBB组 B. CaP组 C. ICA-CaP组黑色三角:各组植入材料;黑色箭头:新生骨图1 大鼠背部异位成骨HE染色 (×100)Figure 1 HE staining of subcutaneous ectopic bone formation in the back of rats (×100)
A. DBB组 B. CaP组 C. ICA-CaP组黑色三角:各组植入材料;黑色箭头:新生骨图2 大鼠背部异位成骨Masson染色 (×100)Figure 2 Masson staining of subcutaneous ectopic bone formation in the back of rats (×100)
2.4 组织学半定量分析
HE染色切片半定量分析结果显示,ICA-CaP组的新生骨面积百分比显著高于DBB组和CaP组,各组间差异均具有统计学意义(P<0.05,见图3)。
3 讨论
DBB是目前口腔临床上广泛应用的商品化骨替代材料,商品名称是Bio-Oss®。DBB的优点是具有较高的亲水性、三维立体的多孔结构、与人体骨组织相似的晶体结构,然而其缺乏成骨诱导能力,不能促使多潜能间充质干细胞向成骨细胞方向分化,限制其成骨效果[3,6]。ICA是从淫羊藿中提取的一种黄酮类化合物,分子式为C33H40O15,相对分子质量为676.65。ICA是一种良好的成骨诱导因子,实验证实ICA能够促进骨髓、脂肪、牙周膜等组织来源的间充质干细胞成骨分化[7-9]。仿生磷酸钙涂层技术是一种简便、高效的涂覆方法。在生理温度和pH条件下,通过共沉积使具有生物活性的作用因子结合到矿化涂层的晶状结构中,从而赋予涂覆材料新的性能。并且通过仿生磷酸钙涂层沉积结合在材料表面的成分将会缓慢释放,从而达到作用效果[10,11]。本研究前期运用仿生磷酸钙涂层技术将ICA负载到DBB上,检测其生物相容性和体外成骨诱导能力[5]。本研究将改性DBB材料移植入大鼠背部皮下,检测改性DBB在动物体内异位成骨的能力。

与其他两组比较,* P<0.05图3 大鼠背部异位成骨HE染色半定量分析Figure 3 Semi-quantitative analysis of HE staining of subcutaneous ectopic bone formation in the back of rats
异位成骨动物模型相对于原位成骨可以减少实验中影响成骨的变量,能评估材料的成骨诱导效果,大鼠皮下异位成骨模型操作方法简单,应用最为广泛[12]。大鼠背部皮肤空间大,且鼠不易触碰伤口的缝线,有利于伤口的愈合。本研究将三组实验材料植入大鼠背部皮下,8周后取材。对异位成骨样本进行HE和Masson染色,结果显示DBB组材料的周围被纤维组织包裹,少量新生骨形成;CaP组的材料表面可见散在分布的新生骨;ICA-CaP组的材料表面可见多处新生骨生成。半定量分析结果表明ICA-CaP组的新生骨面积百分比显著高于DBB组和CaP组,各组间差异均具有统计学意义(P<0.05)。
本研究运用仿生磷酸钙涂层技术将ICA负载到DBB表面的磷酸钙涂层中,检测改性DBB在大鼠体内异位成骨的能力,结果显示负载ICA的改性DBB材料具有较好的异位骨诱导能力,有望为临床骨再生手术提供理想的骨替代材料。

