卡介菌-多糖核酸对哮喘小鼠淋巴细胞CD4+CD25+调节性T细胞的影响
姜华 赖克方 南岩东 金发光
1空军军医大学唐都医院呼吸与危重症医学科,西安710038;2广州医科大学第一附属医院 广州呼吸健康研究院510120
卡介菌多糖核酸 (bacillus calmette-guerin polysaccharide nucleotide,BCG-PSN)是BCG经过灭活后制成的一种免疫制剂,具有多种免疫活性[1-2],通过动物模型及临床观察均证实其对支气管哮喘 (哮喘)有一定的防治作用[3-5],但其具体作用机制尚不清楚。CD4+CD25+调节性T细胞(CD4+CD25+Treg)具有免疫无能性和免疫抑制性的一类细胞,尤其是CD4+CD25+foxp3+T细胞与哮喘诱导免疫耐受密切相关[6],本研究通过观察BCG-PSN对哮喘小鼠脾脏淋巴细胞中CD4+CD25+Treg细胞数量及功能的影响,为其防治哮喘提供详实的理论依据。
1 材料和方法
1.1 材料 Balb/c小鼠 (购自广东省实验动物中心)5~6周龄,体质量16~18 g,雌性。饲养在广州呼吸疾病研究所SPF级动物房。卵清白蛋白(ovalbumin,OVA)为美国Sigma公司产品,佐剂Al(OH)3为美国Sigma公司产品。BCG-PSN购自医院药房 (国药准字92S020100,中国湖南斯奇生物制药有限公司生产)。小鼠有创肺功能仪为美国Buxco公司产品。
1.2 主要试剂 RPMI 1640培养基、胎牛血清FCS均购自GIBCO公司,EZ-SepTMMouse 1×淋巴细胞分离液购自深圳达科为公司,FITC标记的抗CD4抗体、PE标记的抗CD25抗体、PE-cy5标记的抗foxp3抗体、PE标记的抗CTLA-4抗体及同型对照均购自美国eBioscience公司,IL-10、转化生长因子 β (transforming growth factor-β,TGF-β)酶联免疫吸附试验 (enzyme linked immunosorbent assay,ELISA)试剂盒购自德国Bender公司,Trizol抽提试剂购自美国Invitrogen公司,real-time试剂盒 (DDR037,DDR041)购自日本Takara公司。
1.3 试验方法
1.3.1 动物致敏、激发 研究分为对照组、哮喘组和BCG-PSN干预组。每组各10只小鼠,以OVA首次致敏为第0天,在第0、7、14天时腹腔注射OVA(0.01%OVA,0.2 ml/只)致敏,第28、29、30天给予OVA(0.4%OVA,50μl/只)滴鼻激发,1次/d。正常组在每次给药时间点给予相应剂量的生理盐水。BCG-PSN干预剂量为20μg/只,体积为60μl,首次致敏前7 d腹腔注射干预,动物造模干预流程见图1。
1.3.2 气道反应性检测 气道反应性检测各组在末次激发后48 h,用美国Buxco公司的有创气道阻力与肺顺应性检测系统检测小鼠的肺阻力 (lung resistance,RL),测定10μl倍增浓度的乙酰甲胆碱 (methacholine,Mch)雾化激发后RL的变化,激发浓度由低到高,依次为0、3.12、6.25、12.50、25.00和50.00 g/L,记录各浓度级Mch激发下的RL平均值。当前激发浓度肺阻力/生理盐水时肺阻力的比值 (RL/NS)作为小鼠气道反应性的评价指标。Han 等[7]报道,本研究评价气道反应性包括以下两个方面:(1)与哮喘组相比可以显著降低气道反应性 (P<0.05)的激发浓度;(2)气道反应性升高为基值2 倍时的 Mch 激发浓度,值越小,气道敏感性越高。
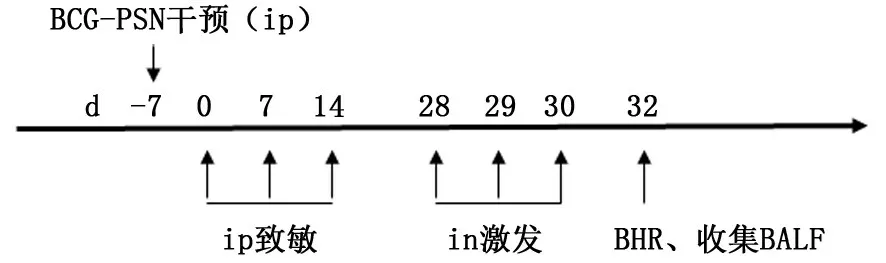
图1 研究中动物致敏、激发、BCG-PSN 干预流程
1.3.3 BALF 中EOS%分析 在实验流程第32天,小鼠行气道反应性检测后麻醉,仰卧位,行气管插管,以0.8 ml PBS灌洗3次,回收率在80%以上。4℃,1 500×g离心10 min,沉淀涂片并行HE染色,连续计数200个细胞并计其中EOS的个数,计算EOS百分比。
1.3.4 小鼠脾淋巴细胞悬液的制备 小鼠无菌取脾,在60 mm 培养皿中加入3 ml EZ-SepTMMouse 1×淋巴细胞分离液,按照说明书制备脾脏淋巴细胞悬液,加入RPMI1640 培养液,台盼蓝染色证实活细胞>95%,计数约为2×107/ml,37 ℃,5%CO2孵箱孵育72 h。
1.3.5 ELISA 检测脾淋巴细胞悬液CD4+CD25+Treg细胞/CD4+T 细胞比例 取上述悬液200μl(细胞总数约1×106个),加入 CD4-FITC 及CD25-PE 同型对照及抗体,室温,避光孵育30 min,加入2 ml 1×PBS,重悬混匀,2 000×g离心10 min,4℃避光孵育30 min,洗涤后缓冲液重悬细胞后ELISA 上机检测。
1.3.6 Realtime-PCR 检测 脾脏淋巴细胞中foxp3 m RNA 及CTLA-4 mRNA 的表达 取前述所得脾淋巴细胞,按照Trizol说明书提取RNA,稀释50倍后经紫外分光光度计测260 nm OD 值,计算RNA 浓度,按照说明书采用一步法进行逆转录反应,获得cDNA,以此为模板进行real-time-PCR 反应,各个反应物引物:按参考文献 [8-9],foxp3 上 游 引 物:5'-CCCAGGAAAGACAGCAACCTT-3',下游引物:5'-TTCTCACAACCAGGCCACTTG-3';CTLA-4 上游引物:5'-GGGCTGGGTCTTTACACTCATTTT-3',下游引物:5'-CTTCCTGTGGCATTAACTTTGTGT-3'。 反应体系:以94 ℃ 10 min,94 ℃ 15 s,56 ℃ 20 s,72 ℃15 s的方式循环45次,最后55 ℃记录熔解曲线,采用2ΔCt方法计算foxp3、CTLA-4 基因的表达水平。
1.3.7 ELISA 检测脾淋巴细胞上清液中IL-10和TGF-β的含量 具体操作见相应说明书。
2 结果
2.1 气道反应性
2.1.1 RL/NS 哮喘组在 Mch 各个激发浓度3.12、6.25、12.50、25.00和50.00 g/L RL/NS均明显高于正常组,说明该模型小鼠具备气道高反应性,BCG-PSN干预组在 Mch 激发浓度为3.12、6.25、12.50 g/L时可显著降低RL/NS,见图2、表1。
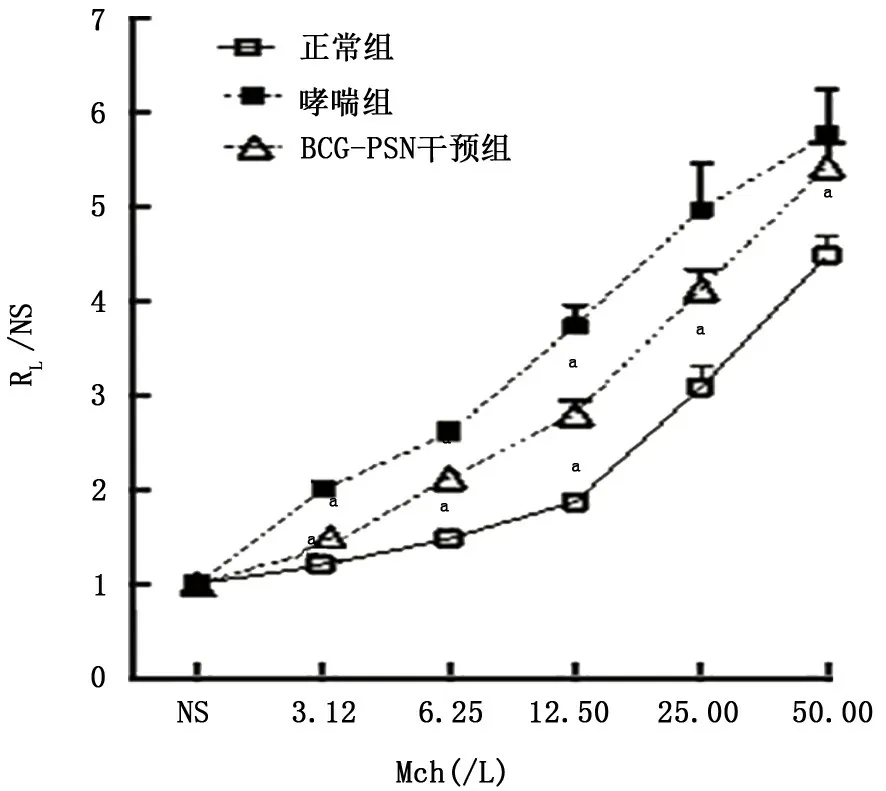
图2 BCG-PSN 腹腔注射干预对哮喘小鼠RL/NS的影响
2.1.2 气道反应性升高为基值2倍时的Mch激发浓度 正常组明显高于哮喘组,说明造模小鼠气道敏感性高,BCG-PSN 干预组 Mch 激发浓度为(12.61±5.33)g/L,与哮喘组 (7.73±2.69)g/L相比,差异有统计学意义 (P<0.01),见图3。
表1 BCG-PSN 腹腔注射干预对哮喘小鼠RL/NS的影响 (g/L,±s)

表1 BCG-PSN 腹腔注射干预对哮喘小鼠RL/NS的影响 (g/L,±s)
注:RL/NS为当前激发浓度肺阻力与生理盐水激发时肺阻力的比值;Mch为乙酰甲胆碱;BCG-PSN 为卡介菌多糖核酸;与哮喘组比较,a P <0.05
组别 鼠数Mch激发浓度3.12 6.25 12.50 25.00 50.00正常组 10 119.34±8.45a 148.10±17.56a 186.54±21.96a 309.06±72.26a 447.84±70.21a哮喘组 10 199.76±29.13 259.10±35.91 373.24±71.56 497.24±153.68 576.24±153.57 BCG-PSN 干预组 10 136.44±12.73a 212.59±26.56a 280.26±45.11a 411.94±68.56 542.89±81.30

图3 各组气道反应性升高为基值2倍时的Mch激发浓度
2.1.3 气道炎症 哮喘小鼠BALF中EOS(47.61±6.91)%,明显高于正常组 (0.19±0.03)%,说明造模小鼠具备高EOS 为特征的气道炎症。BCGPSN 干预组BALF中EOS占 (36.28±10.01)%,与哮喘组相比,差异有统计学意义 (P<0.01),见图4。

图4 BCG-PSN 对哮喘小鼠BALF中EOS%的影响
2.1.4 BCG-PSN 对哮喘小鼠脾脏淋巴细胞CD4+CD25+Treg 细胞数量的影响 哮喘组CD4+CD25+Treg 细 胞/CD4+T 细 胞 比 例 (3.71±2.19)%明显低于正常组 (6.44±1.16)% (P<0.01),BCG-PSN 干预组为 (6.75±1.63)%与哮喘组相比差异有统计学意义 (P<0.01),见图5。
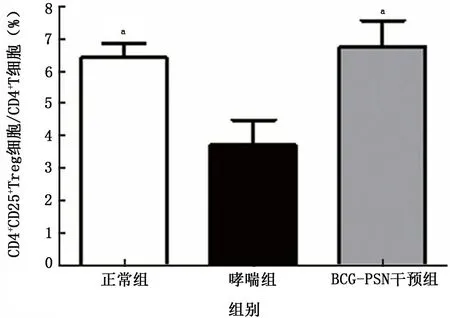
图5 BCG-PSN 对哮喘小鼠脾脏淋巴细胞CD4+CD25+Treg细胞/CD4+细胞比例的影响
2.1.5 BCG-PSN 对哮喘小鼠脾脏淋巴细胞foxp3 m RNA 及 CTLA m RNA 的 影响
2.1.5.1 哮喘组foxp3 m RNA 及CTLA m RNA的相对表达量 哮喘组小鼠脾脏淋巴细胞foxp3 m RNA 的表达量仅为正常组的 (0.23±0.21)倍,而CTLA-4m RNA 的表达量为正常组 (0.65±0.31)倍,提示哮喘组小鼠脾脏淋巴细胞foxp3 m RNA 及CTLA m RNA 表达明显降低,见图6。
2.1.5.2 BCG-PSN 干预对哮喘小鼠脾脏淋巴细胞foxp3 m RNA、CTLA-4 mRNA 的影响 BCGPSN 干预组小鼠脾脏淋巴细胞foxp3 m RNA 表达量是哮喘组的 (1.82±0.76)倍,差异有统计学意义 (P<0.05),CTLA-4 m RNA 表达量是哮喘组的 (1.66±0.57)倍,差异有统计学意义 (P<0.05),见图7。
2.1.6 BCG-PSN 干预对哮喘小鼠脾淋巴细胞上清液IL-10、TGF-β的影响 哮喘小鼠脾脏淋巴细胞上清中IL-10、TGF-β 的含量明显少于正常组。BCG-PSN组IL-10含量为 (210.32±88.23)ng/L,显著高于哮喘组 (114.41±73.58)ng/L (P<0.05)。BCG-PSN 组 TGF-β 含量 为 (487.66±32.57)ng/L, 显著高于哮喘组(97.76 ±23.58)ng/L (P<0.01),见表2。
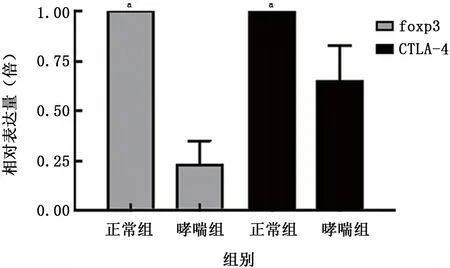
图6 哮喘组与正常组小鼠脾脏淋巴细胞Foxp3 mRNA 及CTLA-4 mRNA 的表达
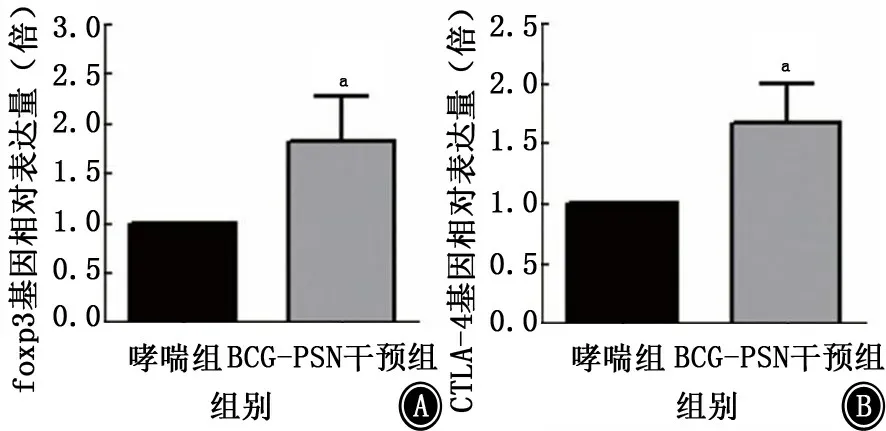
图7 BCG-PSN 干预对哮喘小鼠脾脏淋巴细胞foxp3 m RNA (A)、CTLA-4 m RNA (B)的影响
表2 BCG-PSN 干预对哮喘小鼠IL-10及TGF-β的影响 (ng/L,±s)

表2 BCG-PSN 干预对哮喘小鼠IL-10及TGF-β的影响 (ng/L,±s)
注:BCG-PSN 为卡介菌多糖核酸;TGF-β为转化生长因子-β;与哮喘组比较,a P <0.05,b P <0.01
组别 鼠数 IL-10 TGF-β正常组 10 218.91±53.91a 549.66±261.41b哮喘组 10 114.41±73.58 97.76±23.58 BCG-PSN 干预组 10 210.32±88.23a 487.66±32.57b
3 讨论
哮喘是由多种细胞及细胞组分参与的气道慢性炎症性疾病,以气道高反应性和气道炎症为重要特征,可自然缓解或经治疗后缓解,发病率呈增高趋势[10-12]。2006年亚太哮喘见解与现实第2 阶段调查结果显示,亚太地区哮喘患者只有2.5%达到哮喘控制[13],CD4+CD25+Treg 细胞是一种具有免疫抑制及免疫调节作用的细胞,具有独特的作用方式和功能特征,有可能在哮喘等变态反应性疾病和一些自身免疫性疾病的发病中起重要作用[14-15],大量动物试验证实BCG[16-19]通过CD4+CD25+Treg细胞防治哮喘,但完整的BCG 因其成分复杂,且副作用大,无法直接用于临床,BCG-PSN 是BCG经热酚法去除蛋白后提取BCG-PSN,配以灭菌生理盐水制成的以多糖成分为主的一种非特异免疫调节剂,多个研究[2-5]证实其对哮喘有保护作用,但具体作用机制仍未明确。
通过研究证实哮喘小鼠CD4+CD25+T 细胞数量明显低于正常组,说明哮喘小鼠体内的CD4+CD25+Treg 的确存在数量上的缺陷,Fontenot等[20]发现,高表达foxp3 的转基因小鼠CD4+CD25+Treg细胞数量明显增加,foxp3敲除小鼠活化的CD4+细胞增多,却缺乏独立的CD4+CD25+Treg细胞,因而导致自身免疫性疾病的发生,此后多个研究[21-22]表明foxp3 是调控CD4+CD25+Treg细胞发育及启动抑制功能的关键因子。通过real-time-PCR 测定了哮喘小鼠脾脏淋巴细胞中foxp3基因的表达水平,发现该基因的表达仅为正常组的23%左右,提示哮喘小鼠体内还存在着CD4+CD25+Treg的功能缺陷。BCG-PSN 干预可明显提高CD4+CD25+Treg 细胞/CD4+T 细胞比例,上调哮喘小鼠foxp3 m RNA 的表达水平。因此说明BCG-PSN 干预显著增加CD4+CD25+Treg细胞数量和功能。
CD4+CD25+Treg细胞可通过CTLA-4介导的细胞接触依赖机制发挥其免疫抑制功能,从而阻止哮喘的发生。CTLA-4是CD4+CD25+Treg细胞上膜分子,是T 细胞活化所需的协同刺激分子CD28的同源异构体,CTLA-4对效应性T 细胞的B7-1分子的亲和力比CD28更强,抑制效应性T 细胞的增殖和活化,从而调节哮喘等疾病的免疫失衡[23-24]。说明CTLA-4对于诱导CD4+CD25+Treg细胞的抑制功能是十分重要的;研究结果显示哮喘组CTLA-4m RNA 的水平为正常组的65%左右,说明哮喘小鼠存在CTLA-4mRNA 低表达,而BCG-PSN 干预组的CTLA-4m RNA 表达水平与哮喘组相比明显增高,说明BCG-PSN 可上调CTLA-4m RNA 的表达,并通过CTLA-4 介导的细胞-细胞接触抑制从而对哮喘小鼠产生保护作用。
此外CD4+CD25+Treg细胞也可通过分泌细胞因子 (IL-10、TGF-β)而介导抑制效应[25]。研究显示哮喘组中IL-10及TGF-β的分泌水平明显低于正常组,BCG-PSN 干预组的IL-10及TGF-β的分泌水平明显高于哮喘组,说明BCG-PSN 可能通过分泌抑制性细胞因此IL-10 及TGF-β从而产生对哮喘小鼠的保护作用。同时,除了CD4+CD25+Treg细胞外,机体内还存在着一类能分泌IL-10的Tr1 (抑制由Th1介导的自身免疫反应的T 细胞)[26]和能分泌TGF-β的Th3[27]。因此,本实验IL-10和TGF-β可能是多来源的,提示可能BCG-PSN 还可通过其他机制如树突状细胞、Tr1、Th3等发挥免疫调节作用。
综上所述,BCG-PSN 干预可增加哮喘小鼠CD4+CD25+Treg细胞数量及功能,具体可能通过促进IL-10、TGF-β等抑制性细胞因子的分泌及CTLA-4介导的细胞-细胞接触抑制机制诱导免疫耐受,从而降低哮喘小鼠的气道反应性和气道炎症。
利益冲突所有作者均声明不存在利益冲突

