甜菜碱和水杨酸对干旱胁迫下辣椒开花结果期生理特性的影响
马仲炼,周航飞,冉春艳,何巧丽,黄召存,王龙昌*
(1.西南大学 农学与生物科技学院,重庆 400716;2.昭通学院,云南昭通 657000;3.甘肃省静宁县种子管理站,甘肃平凉 743400)
我国南方属于亚热带气候区,高温伏旱频发成为影响我国夏季作物生产的主要因素之一。辣椒属于浅根性植物[1],对土壤水分缺欠极为敏感。干旱对辣椒开花结果期的危害最大。因此干旱已成为许多地方大规模发展辣椒种植业的限制因素。
近年来,施用外源生长物质提高植物的抗旱性已成为一个热门的研究问题。水杨酸(salicylic acid,SA)是植物体内的简单小分子酚类物质,逆境中能诱导相关蛋白基因表达以提高植物抗性[2-4]。甜菜碱(glycine betaine,GB)是一种非毒性、易溶于水的生理抗旱剂,能减缓干旱胁迫对植物造成的伤害。目前,有关SA和GB对植物抗旱性影响的研究已有较多报道。研究表明,SA 可以促进干旱胁迫下黑果枸杞体内渗透调节物质含量和抗氧化酶活性[5];SA 能缓解番茄叶片相对含水量(relative water content,RWC)的降低,降低相对电导率和丙二醛(malondialdehyde,MDA)含量,增加番茄叶片相对叶绿素、脯氨酸和可溶性蛋白含量,增强超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)的活性[6];SA可以提高一品红在干旱胁迫及复水条件下的保水能力及光合效率,减轻细胞膜脂过氧化,有效缓解干旱逆境对一品红的伤害[7];GB 能降低干旱胁迫下甜茶叶片MDA含量,提高甜茶的渗透调节物质和相对含水量,调节抗氧化物酶活性[8];外源GB 溶液能提高干旱胁迫条件下半夏氮代谢相关酶的活性,加快无机氮的同化,促进次生代谢物质的积累[9]等。而外源SA 和GB 对开花结果期辣椒抗旱性的影响研究较少。本研究探讨外源SA和GB对辣椒抗旱生理特性的影响,旨在为辣椒抗旱节水栽培提供技术支持,为旱区辣椒生产提供指导。
1 材料与方法
1.1 材料
试验于2017 年2—9 月在西南大学2 号温室内进行,选用辣椒品种云椒2号为材料。
1.2 试验设计
将大小一致、子粒饱满的辣椒种子播种于塑料营养钵中,基质配比为草炭∶蛭石=2∶1(体积比),进行常规育苗法管理。辣椒幼苗4 叶1 心时移栽于温室内的塑料盆中(直径24 cm,高18 cm),所用土壤取自大田耕层土壤(土壤最大持水量100%时净含水量为0.413 kg/kg),每盆装土壤7.0 kg,每盆定植2 株,施氮磷钾复合肥9 g。之后进行常规田间管理,开花结果前期(平均每株开花数20个)选择长势一致的植株进行干旱处理,试验设6个处理组,分别为中度干旱(MD)、中度干旱+GB(MDgb)、中度干旱+SA(MDsa)、重度干旱(SD)、重度干旱+GB(SDgb)、重度干旱+SA(SDsa)。每处理组种植15盆,6月4日开始干旱处理,其中中度干旱土壤含水量为田间最大持水量的40%~50%,重度干旱土壤含水量为田间最大持水量的20%~30%。干旱胁迫3 d 后,同时利用GB,SA 水溶液进行根灌和叶喷,根灌量40 mL/盆,叶喷至叶片湿润,其中GB 为100 mmol/L 水溶液,SA 为200 mg/L 水溶液。干旱处理分别用去离子水根灌叶喷。分别于6 月11,19,27 日清晨9:00—10:00 进行取样,共取样3次。
1.3 测定项目与方法
采用鲜重法测叶片RWC,采用硫代巴比妥酸(thiobarbituric acid,TBA)比色法测定MDA含量[10],采用蒽酮比色法测定可溶性糖,采用酸性茚三酮比色法测定游离脯氨酸含量[11],采用考马斯亮蓝比色法测定可溶性蛋白含量[12],采用试剂盒(南京建成试剂公司)测定SOD,POD和CAT活性。
1.4 数据分析
采用Excel 2003 和SPSS 17.0 软件对数据进行计算、统计分析。方差分析采用邓肯(Duncan’s)新复极差法检验。
1.5 抗旱性的综合评价
为了全面准确地评价GB,SA处理对辣椒抗旱性的影响,应用模糊隶属函数法对所测得的各项生理生化指标进行辣椒抗旱性的综合评价。公式为:

式中:X(hi)为h种类i指标的隶属值,Xhi为h种类i指标的测定值,Ximax为该指标的最大值,Ximin为该指标的最小值[13];h为某个品种;i为某项指标。
若某一指标与抗旱性呈负相关,则通过反隶属函数计算,其公式为:

运用抗旱隶属函数将所有抗旱隶属值累加,求平均值,其公式为:

式中:Xh-为平均抗旱隶属值,k为指标数。平均值越大则抗旱性越强。
2 结果与分析
2.1 GB,SA对干旱胁迫下辣椒叶片RWC的影响
由图1 可知,外源GB,SA 处理后,随着干旱胁迫时间的延长,RWC 的降低均有所缓解。处理组第8 d后,MDgb处理组RWC较MD和MDsa组分别高12.2%,11.8%,并且差异极显著;SDGB处理组RWC 较SD 及SDsa 组高,但差异不显著。处理第16 d 后,MDgb 和MDsa 处理组RWC 较MD 组分别高14.9%,6.0%;SDgb 和SDsa 处理组RWC 较SD 组分别高29.4%,16.1%,并且差异极显著。处理第24 d 后,MDgb 与MDsa 处理组RWC 较MD 组分别高7.9%,5.7%,并且差异极显著;SDgb 与SDsa处理组RWC较SD组分别高14.3%,9.4%,并且差异极显著。这说明干旱胁迫下GB及SA处理均能减缓叶片水分流失。

图1 GB、SA对干旱胁迫下辣椒叶片RWC的影响Fig.1 Effects of GB and SA on relative water content (RWC)in leaves of hot pepper under drought stress
2.2 GB,SA对干旱胁迫下辣椒叶片MDA含量的影响
由图2可知,随着胁迫时间的延长,各处理组MDA 含量总体呈现升高趋势。处理第8 d 后,MDgb 和MDsa 处理组MDA 含量较MD组略有降低,但差异不大;SDgb 和SDsa 处理组MDA 含量较SD组分别减少20.95%,7.14%,并且差异显著。处理第16 d 后,MDgb 和MDsa 处理组MDA 含量较MD组分别减少6.43%,24.71%;SDsa 处理组MDA 含量较SD 组减少9.17%且差异极显著。处理第24 d后,MDgb 和MDsa 处理组MDA 含量较MD 组分别减少14.04%,8.92%,并且差异显著;SDgb和SDsa处理组MDA 含量较SD 组分别减少12.43%,8.17%,并且差异显著。可见,干旱胁迫下SA,GB处理可以降低辣椒叶片MDA含量。

图2 GB,SA对干旱胁迫下辣椒叶片MDA含量的影响Fig.2 Effects of GB and SA on MDA content in leaves of hot pepper under drought stress
2.3 GB,SA对干旱胁迫下辣椒叶片渗透调节物质含量的影响
2.3.1 GB,SA对干旱胁迫下辣椒叶片脯氨酸含量的影响
由图3 可知,处理第8 d,MDgb 和MDsa 处理组的脯氨酸含量较MD 组分别增加25.3%、76.3%,并且差异极显著;SDgb 和SDsa 处理组的脯氨酸含量较SD组有所增长。处理第16 d,MDgb处理组的脯氨酸含量较MD 增加100.9%,且差异极显著,MDsa 处理组的脯氨酸含量较MD组减少64.1%,且差异极显著;SDgb 和SDsa 处理组的脯氨酸含量较SD 组分别增加149.0%,76.5%,并且差异极显著。处理第24 d,MDGB处理组的脯氨酸含量较MD 增加78.4%,且差异极显著;MDsa 处理组的脯氨酸含量较MD 组减少38.0%但差异不显著;SDgb 和SDsa 处理组的脯氨酸含量较SD 组分别增加114.5%,74.2%,并且差异极显著。这说明喷施GB 可促进干旱胁迫下辣椒脯氨酸的积累,喷施SA可促进重度胁迫下辣椒脯氨酸的积累,但在中度胁迫下,喷施SA 可引起中期、后期辣椒叶片脯氨酸含量降低。

图3 GB,SA对干旱胁迫下辣椒叶片脯氨酸含量的影响Fig.3 Effects of GB and SA on proline content in leaves of hot pepper under drought stress
2.3.2 GB,SA对干旱胁迫下辣椒叶片可溶性糖含量的影响
由图4 可知,处理第8 d,在相同干旱胁迫水平下,辣椒可溶性糖含量MDsa 处理组高于MD 处理组,MDgb处理组最少;SDsa处理组最高,其次为SD处理组,SDgb处理组含量最少。处理第16 d,MDgb和MDsa处理组的可溶性糖含量与MD组相比差异不大,SDgb和SDsa处理组可溶性糖含量较SD组增长,且差异极显著;处理第24 d,MDgb 和MDsa 处理组的可溶性糖含量较MD 组分别增加8.81%,14.38%,并且差异极显著;SDgb 和SDsa处理组可溶性糖含量较SD 组分别增加28.62%,22.97%,并且差异极显著。这说明喷施GB 与SA后,随着干旱胁迫的持续,辣椒叶片可溶性糖含量显著增加。

图4 GB,SA对干旱胁迫下辣椒叶片可溶性糖含量的影响Fig.4 Effects of GB and SA on soluble sugar content in leaves of hot pepper under drought stress
2.3.3 GB,SA对干旱胁迫下辣椒叶片可溶性蛋白含量的影响
由图5 可知,MDsa 处理组的可溶性蛋白含量较MD组在第8,16,24 d分别减少5.81%,7.66%,7.3%;SDsa处理组可溶性蛋白含量较SD组在第8,16,24 d可溶性蛋白含量分别减少25.21%,7.95%,4.21.%。SDGB处理组可溶性蛋白含量较SD 组在第24 d减少38.6%且差异极显著。这说明外源SA 处理使干旱胁迫下辣椒叶片可溶性蛋白含量下降,外源GB处理使重度胁迫后期辣椒叶片可溶性蛋白含量下降。

图5 GB,SA对干旱胁迫下辣椒叶片可溶性蛋白的影响Fig.5 Effects of GB and SA on soluble protein content in leaves of hot pepper under drought stress
2.4 GB,SA对干旱胁迫下辣椒叶片保护酶活性的影响
2.4.1 GB,SA对干旱胁迫下辣椒叶片POD 活性的影响
由图6可知,处理第8 d,MDsa处理组的POD活性较MDgb 和MD 组分别高29.4%,27.8%,且差异极显著;SDsa 处理组的POD 活性较SDgb 和SD组分别高26.0%和35.7%,且差异极显著。处理第16 d,在相同干旱胁迫水平下,施用GB,SA 组的POD 活性均高于未施用组。处理第24 d,SDGB处理组的POD 活性较SDsa,SD 组分别高了31.7%和38.9%,且差异极显著。说明在干旱胁迫下,施用GB,SA可在一定程度上缓解干旱胁迫对辣椒的损害, 提高其耐旱性。

图6 GB,SA对干旱胁迫下辣椒叶片POD活性的影响Fig.6 Effects of GB and SA on POD activity in leaves of hot pepper under drought stress
2.4.2 GB,SA对干旱胁迫下辣椒叶片SOD活性的影响
由图7可知,处理第8 d,MDsa 处理组的SOD活性较MD 组高16.5%,且差异极显著,SDsa 处理组的SOD 活性较SD 组增加16.8%。处理第16 d,MDsa 处理组的SOD活性较MD组增加35.9%,且差异极显著。处理第24 d,MDsa 和MDGB处理组的SOD活性较MD组分别增加25.2%,17.4%,且差异极显著;SDGB处理组的SOD 活性较SD 组增加16.6%,且差异极显著。这说明干旱胁迫下,喷施外源GB,SA 可在一定程度上提高辣椒的抗旱性。
2.4.3 GB,SA对干旱胁迫下辣椒叶片CAT 活性的影响
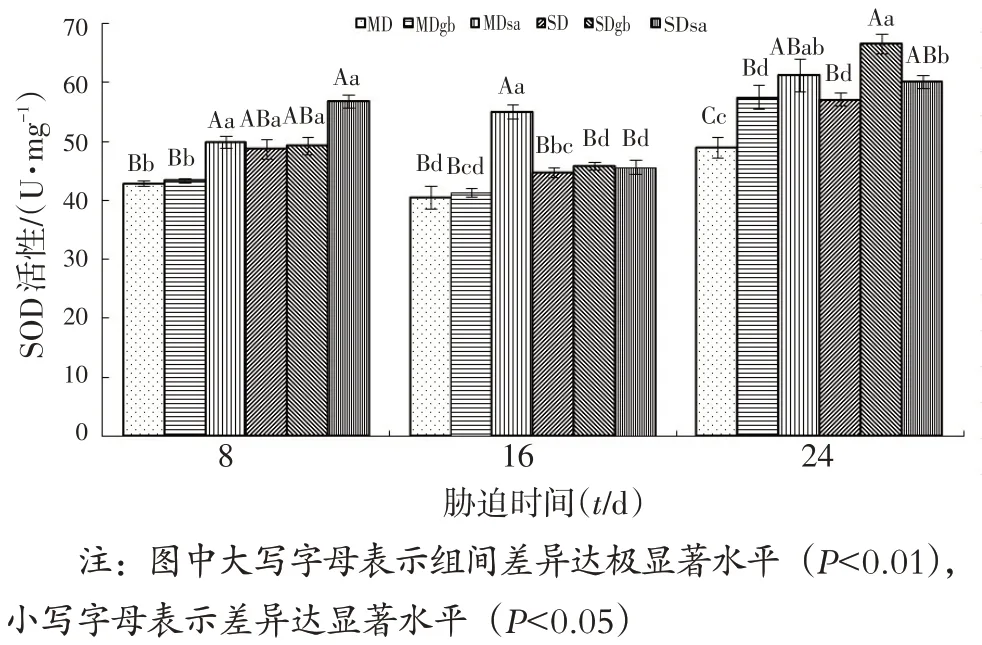
图7 GB,SA对干旱胁迫下辣椒叶片SOD活性的影响Fig.7 Effects of GB and SA on SOD activity in leaves of hot pepper under drought stress
图8 表明,处理第8 d,MDgb处理组的CAT活性较MD组高44.9%,且差异极显著,MDsa处理组的CAT 活性较MD 组高18.9%,但差异不显著,SDsa 和SDGB处理组的CAT 活性较SD 组分别高21.1%,29.6%,并且差异极显著。处理第16 d,MDGB处理组的CAT 活性较MD 组高11.8%,且差异极显著,MDsa 处理组的CAT 活性较MD 组低7.4%,并且差异显著,SDgb 和SDsa 处理组的CAT活性较SD 组分别高10.1%、6.7%,并且差异极显著。处理第24 d,在相同胁迫水平,各处理之间差异不显著。这说明随着干旱胁迫的持续,GB 和SA处理对辣椒CAT活性的影响减弱。

图8 GB,SA对干旱胁迫下辣椒叶片CAT活性的影响Fig.8 Effects of GB and SA on CAT activity in leaves of hot pepper under drought stress
2.5 GB,SA对辣椒抗旱性影响的综合评价
以所测得的8个生理生化指标为依据,采用模糊隶属函数法对辣椒的抗旱性进行综合评价,其结果见表1。
从表1可以看出,干旱、GB和SA各处理综合评价值分别为0.475 1,0.521 9 和0.495 0,提示GB 与SA 处理可以提高辣椒抗旱性,GB处理的辣椒抗旱性更好。
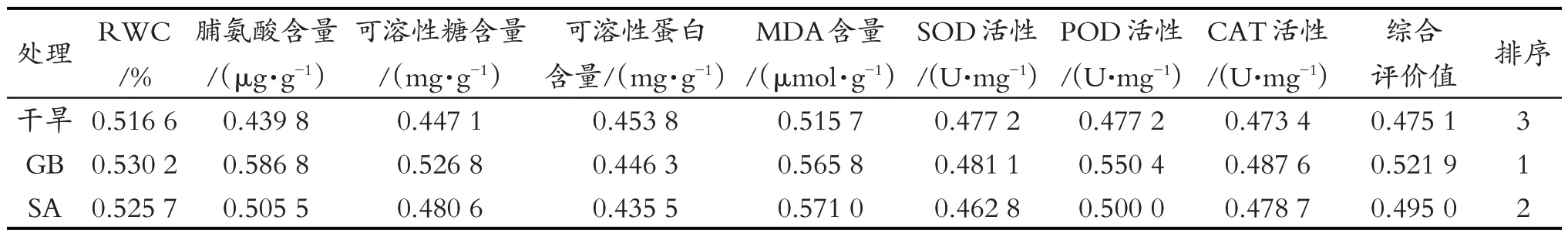
表1 干旱、GB和SA处理对辣椒抗旱性影响的综合评价Tab.1 Comprehensive evaluation of effects of GB and SA on drought resistance of hot pepper
3 讨论
3.1 干旱胁迫下辣椒渗透调节物质含量对外源SA,GB的响应变化特征
植物细胞可通过积累大量的可溶性糖,使细胞原生质浓度增大,进而引起抗脱水作用,增强植物的抗旱性[14]。本试验表明,外施SA 显著提高了辣椒叶片内可溶性糖含量,这与可静等[5]的研究结果相同,说明在干旱胁迫下SA 处理能促进辣椒可溶性糖的积累,提高辣椒叶片的渗透调节能力。然而,在SA 处理后,辣椒可溶性蛋白含量出现下降趋势,这一现象与叶松涛等[15]的研究结果相同,这可能是因为在干旱和轻度干旱条件下,SA 处理会启动以脯氨酸和某些可溶性蛋白为底物的其他防御途径,胁迫中、后期脯氨酸含量降低或升高可以说明这一点。在重度干旱时,随着胁迫时间的延长,SA 处理的脯氨酸含量显著提高,原因可能是此时缺水已经成为辣椒最大的胁迫因素,辣椒启动各种保水调节机制来提高可溶性物质的含量,其中可能通过降解可溶性蛋白来提高脯氨酸积累量,最大限度保持水分。
本试验中外施GB 能有效减轻干旱胁迫对辣椒造成的危害,减缓辣椒叶片相对含水量下降速率,促进脯氨酸、可溶性糖积累。分析原因,可能是因为甜菜碱的施用可诱导脯氨酸、可溶性糖等相溶性物质的合成,这些渗透调节物质的合成与积累,能降低细胞渗透势,增强细胞的吸水能力,以维持细胞膨压,适应干旱胁迫[16-17],这与李爱梅等[8]的研究结果相一致。
3.2 外源SA,GB处理对干旱胁迫下辣椒丙二醛含量、抗氧化酶活性的影响
干旱等胁迫下,关于SA,GB提高保护酶活性已有相关报道。常云霞等[18]的研究表明外源SA处理可进一步提高龙葵幼苗叶片中SOD、POD和CAT活性,贺丽江等[19]证明喷施甜菜碱有利于苎麻叶片POD 活性的提高。本研究表明,在胁迫初期,SA 处理辣椒叶片POD,SOD 的活性高于GB处理,表明POD,SOD对SA更敏感,GB处理下辣椒叶片CAT的活性高于SA处理。在逆境胁迫下,SA是植物重要的信号分子,外施SA 能进一步加强活性氧清除机制中保护酶SOD 发挥作用,将超氧阴离子自由基快速歧化为过氧化氢(H2O2)和分子氧,有效减少自由基对膜系统的伤害[20]。使植物体内H2O2含量水平上升,SOD 产生的H2O2也会对细胞产生毒害,POD 可以使H2O2还原成H2O 而减轻植物体内的氧化状态,3 种保护酶活性的此消彼长,使MDA 的积累量降低,减轻膜脂过氧化作用的伤害,缓解旱害。在胁迫后期,GB处理下辣椒叶片POD、SOD 和CAT 活性高于SA 处理,可能是由于随着胁迫的持续,GB处理的游离脯氨酸大量积累,稳定了酶、蛋白复合体等生物大分子的结构和功能,提高了各种抗氧化酶活性,尤其是提高了POD、SOD和CAT活性,增强了植株抗氧化能力。
4 结语
在干旱胁迫下,GB,SA处理不仅能有效缓解辣椒叶片相对含水量的下降,抑制MDA 含量的增加,而且能提高POD,SOD 和CAT 的活性,促进可溶性糖、脯氨酸含量的积累,甚至能通过降低可溶性蛋白来提高脯氨酸的积累量。模糊隶属函数法综合评价结果表明,GB,SA处理能提高辣椒的抗旱性,GB处理的辣椒抗旱性更好。

