2型糖尿病患者牙槽骨骨髓间充质干细胞生物学特性研究*
刘长营 马攀 耿 威 林潇 李 钧
糖尿病(diabetes mellitus,DM)是一种糖代谢异常及全身新陈代谢异常并具有遗传倾向的慢性疾病。据国际糖尿病联盟(IDF)估计,2013年患有糖尿病的成年人有3.8亿,到2035年,预计增加到5.9亿[1]。目前,我国糖尿病患病率为9.7%,患者人数近1个亿,并呈快速增长趋势[2],已成为糖尿病第一大国。糖尿病分为1型和2型,有90%的糖尿病患者为2型糖尿病。糖尿病患者常伴有骨代谢及钙、磷代谢的障碍,引起继发性骨量减少及骨质疏松等DM性骨病[3]。临床上要求种植修复的2型DM患者也日益增多。但2型DM一直被认为是种植手术的相对禁忌症。糖尿病病人的异常高血糖状态所引起的一系列病理变化,导致骨结合差,是糖尿病病人种植义齿失败的重要原因。但2型糖尿病影响骨结合的具体机制尚不清楚。
骨结合是一个动态的骨改建过程,成骨细胞在此过程中起着非常重要的作用。而成骨细胞多起源于多潜能的骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)。BMSCs具有多向分化潜能和自我更新能力,是骨组织再生的重要种子细胞,成骨发生的关键是BMSCs向成骨细胞方向分化,这可能也是形成种植体骨结合的关键。种植体与骨组织间的结合是一种动态的骨改建与吸收的过程,种植体植入后早期,在手术区血凝块形成后,会有类似轻度的炎症反应出现,包括大量的吞噬细胞和从邻近骨膜组织来的未分化的BMSCs的增殖与分化,从周围骨膜新分化的成骨细胞能够分泌产生编织样的骨基质最早与氧化表面形成接触。因此,在骨损伤修复的过程中,骨髓间充质干细胞在损伤部位募集起着至关重要的作用[4,5]。DM是如何通过内环境影响BMSCs的生物学特性和功能,从而影响骨结合,机制目前尚不清楚。本研究以糖尿病患者BMSCs为研究模型,在体外模拟正常糖浓度和高血糖状态,观察糖尿病患者BMSCs生物学特性,为进一步探讨糖尿病影响种植体骨结合的分子机制提供实验基础。
1.材料与方法
1.1 材料
1.1.1 标本来源 人牙槽骨BMSCs取自在首都医科大学附属北京口腔医院种植中心行种植手术的病人,所收集的种植窝制备过程中产生的骨碎屑均向患者说明,征得患者知情同意并签署知情同意书。
正常人入组标准:全身状况良好,无系统性疾病,无传染性疾病,无吸烟、饮酒等不良嗜好。
2型糖尿病患者入组标准:糖尿病病史,确诊为2型糖尿病,空腹血糖>6.2mmol/L,长期服用降血糖药物,否认骨质疏松症,否认其他系统病史,无吸烟饮酒等不良嗜好。
以上两组牙列缺损患者入组时均进行年龄匹配(见表 1,表 2)。
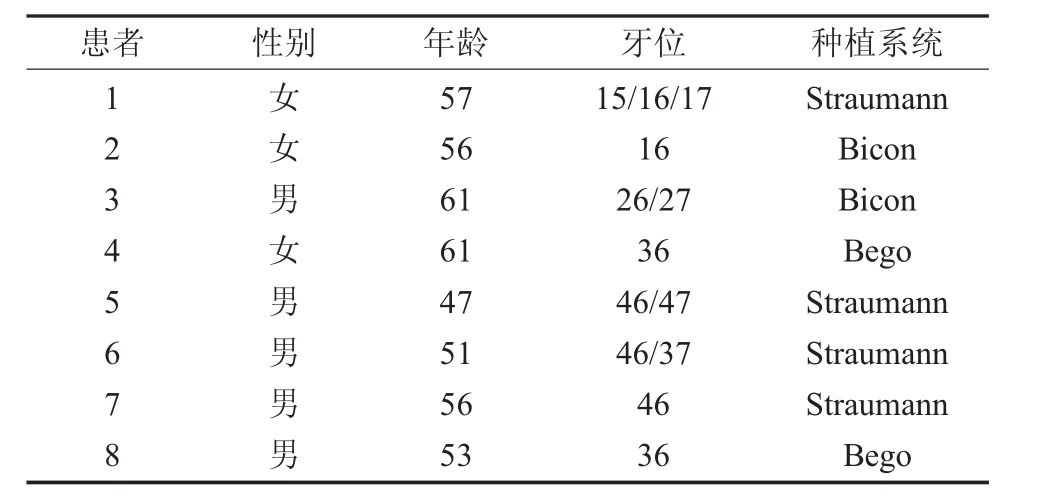
表1 正常人患者基本情况

表2 糖尿病患者基本情况
1.1.2 主要试剂 DMEM高糖培养基,含糖量为4.5g/L(Gibco,美国),DMEM低糖培养基,含糖量为1.0g/L(Gibco,美国),胎牛血清,青-链霉素,磷酸盐缓冲液,胰蛋白酶(Gibco,美国);Annexin V/PI细胞凋亡试剂盒(购自南京建成生物工程研究所,中国);Trizol Reagent(Life Technologies,美国),无水乙醇(国药化学试剂,中国),氯仿(国药化学试剂,中国)。
1.2 方法
1.2.1 人牙槽骨骨髓间充质干细胞获取、分离与培养与表面标记物鉴定 于种植手术中收集各级扩孔钻凹槽以及种植窝中的骨屑,在无菌操作下放入15ml离心管(5mlPBS+1%青-链霉素)内,1100r/min离心6min,弃上清液,加入5mlDMEM培养基(15%胎牛血清,2 mmoL/L谷氨酰胺,100U/ml青霉素,100ug/ml链霉素),重悬后移入6cm细胞培养皿中,置于37℃,5%CO2孵箱中培养,每日观察细胞生长情况。培养到第6天,对细胞进行全换液,PBS清洗,尽量去净培养瓶内骨屑。接下来每2~3天对细胞更换培养基。待细胞长至接近80%~90%融合状态时,用0.25%胰蛋白酶按1∶2消化、传代。
流式细胞仪检测BMSCs表面标记物:取第5代细胞,0.25%胰蛋白酶含(EDTA)消化离心。PBS清洗一次,将细胞再以5×106/ml细胞浓度重悬于PBS中。取流式管,各取100μl细胞悬液,分别加入鼠抗人单克隆抗体CD45-FITC,CD90-FITC,HLA-DR-FITC,CD34-PE,CD44-PE,CD73-PE,CD105-PE,以及同型对照抗体Mouse IgG1-FITC,MOUSE IgG1-PE各20μl,4℃避光下孵育30min。1000r/min离心5min,PBS洗一次。弃去上清液,加入100μl PBS混匀,4℃避光保存。4h内流式细胞仪上样,检测相关分子的表达情况。
在本研究中,应用的正常人BMSCs和糖尿病患者BMSCs为4~5代,在同一实验中,应用的BMSCs为同一代数。正常人和糖尿病患者BMSCs消化、传代后各分为两组,分别加入高糖培养基和低糖培养基。共四组细胞:正常人高糖组、低糖组;糖尿病高糖组、低糖组。
1.2.2 CFSE掺入及流式细胞术检测细胞增殖实验 每组细胞消化后,以0.1%BSA重悬细胞,调整细胞浓度为1×106/ml;加入2μl 5 mM CFSE,使CFSE终浓度为10μM;37℃孵育10min,冰上孵育5min;1500rpm离心10min,去上清,以DMEM培养基洗3次后,放入6孔细胞培养板,37℃、5%CO2培养;3d后,消化细胞,1500rpm离心10min,500μl 0.1%BSA重悬;流式细胞仪检测(488通道),使用Modfit软件分析增殖指数。
1.2.3 Annexin V/PI及流式细胞术检测细胞凋亡实验 每组细胞用胰蛋白酶消化后,用PBS重悬细胞,计数,调整细胞浓度;取1×106重悬的细胞,1000g离心5min,弃上清,加入350μl结合液轻轻重悬细胞;加入5μl Annexin V-FITC,轻轻混匀;再加入5μl碘化丙啶(PI),轻轻混匀;室温(20~25℃)避光孵育10min,可以用铝箔进行避光;随即进行流式细胞仪检测。
1.2.4 划痕实验检测细胞迁移能力 将细胞按5×105/ml接种于6孔板中,37℃、5%CO2孵箱中孵育细胞,待细胞达到80%融合时,用200ul枪头垂直于孔板底划痕,PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入37℃、5%CO2培养箱培养。每孔随机选取5个不同的区域,分别于0h,6h,24h取样,倒置荧光显微镜下,应用CellSens软件分析。找到标记处,保证每个时间点测量均为同一位置,测量细胞间距离,随机测量3次取平均值,拍照。迁移距离为两个时间点测量值的差值。
1.2.5 细胞黏附实验 将纯钛钛片修整为1*1cm大小,丙酮浸泡、脱脂,无水乙醇反复冲洗,再用去离子水冲洗,高温高压消毒备用;将培养至第4代的BMSCs,取24孔细胞培养板,将预先消毒好的钛片铺入24孔板底部,每孔加入2*104个细胞铺板,每样本设3复孔,共4组;分别于6h,12h后吸出培养液,收集,待行细胞计数,加入4℃预冷2.5%戊二醛固定液固定1~2h;10%PB冲洗3次,每次10min,4℃保存;1%锇酸4℃下固定1h。系列梯度酒精脱水,干燥,喷金。扫描电镜观察。观察时将钛片中心置于SEM视野的中央,再向固定方向移动视野,观察每组BMSCs在钛片表面的黏附形态,拍照。
细胞黏附率的测定:分别收集每组吸出的细胞悬液,上CountStar细胞计数仪计数,测定细胞黏附率,每组设3个复孔,细胞黏附率=(20000-培养液中剩余的细胞数)/20000*100%。
1.3 统计学方法 采用SPSS 17.0统计学软件进行统计学分析,两组计量资料比较采用t检验,多组计量资料比较采用ANOVA分析,P<0.05认为差异有统计学意义。
2.结果
2.1 细胞形态观察与生长状况及表面标记物鉴定 在BMSCs细胞原代培养中,正常人BMSCs在第5~6天时可见细胞从组织块中爬出,而2型糖尿病患者BMSCs则在第7~9天时才有少量爬出。两者的细胞形态无明显差异,细胞形态梭形或者三角形,随着细胞数量的增多和生长,胞棱较大,核仁呈椭圆形。随着细胞扩增,细胞间交织成网。正常人在第14天,细胞增殖良好,贴壁良好,成克隆性生长,可见克隆集落形成,集落中心细胞密集,周围细胞呈放射状或漩涡状排列,形态与成纤维样细胞相似,成指纹样生长,细胞融合达到80%,此时进行传代。而2型糖尿病患者细胞经16~20d培养后,融合达到底面积80%时,才能进行传代(见图1)。

图1 A:糖尿病患者原代BMSCs(40x);B:传代后(P5)糖尿病BMSCs(40x);C:传代后(P5)糖尿病BMSCs(100x);D:正常人原代BMSCs(40x);E:传代后(P5)正常人BMSCs(40x);F:传代后(P5)正常人 BMSCs(100x)。
传代后两者的细胞形态稍有不同,正常人种植窝来源的牙槽骨BMSCs随着细胞扩增,细胞间更为密集,均匀,交织成网,细胞核较大,较为明显,细胞的生长速度较快,每2~3d可传代一次;而糖尿病患者BMSCs的细胞棱角稍大,细胞间的密集度稍小,其生长速度较正常人BMSCs的生长速度慢,需4~5d后传代一次。
细胞表面标记物鉴定:采用第5代细胞,取样抗体标记后上流式细胞仪。流式细胞术分析显示CD44、CD73、CD90和CD105阳性表达,而CD34、CD45和HLA-DR阴性表达。阳性标志物表达均大于95%,阴性标志物表达均小于2%。表达情况及阳性率符合BMSCs一般特点(见图2)。

图2 人牙槽骨BMSCs细胞表面标志物表达情况。流式细胞术分析显示CD44、CD73、CD90和CD105阳性表达,而CD34、CD45和HLA-DR阴性表达。
2.2 CFSE掺入及流式细胞术检测细胞增殖实验 通过应用CFSE掺入法及流式细胞术进行细胞增殖实验发现,糖尿病高糖组增殖指数为17.16±0.437;糖尿病低糖组增殖指数为25.107±2.478;正常人高糖组增殖指数为18.587±1.688;正常人低糖组增殖指数为27.227±1.426;方差分析显示,四组之间差异有显著统计学意义。低糖组明显高于高糖组。说明BMSCs细胞在高糖环境下的增殖明显减弱(见图3)。
2.3 Annexin V/PI及流式细胞术检测细胞凋亡实验 细胞凋亡实验发现,四组BMSCs中糖尿病高糖组的细胞凋亡率最高,约为12.1%,而其他三组的细胞凋亡率明显较小,其中正常人低糖组细胞凋亡最少。糖尿病低糖组细胞凋亡为4.43%;正常人高糖组细胞凋亡为3.49%;正常人低糖组细胞凋亡为2.56%;差异有统计学意义(见图4)。
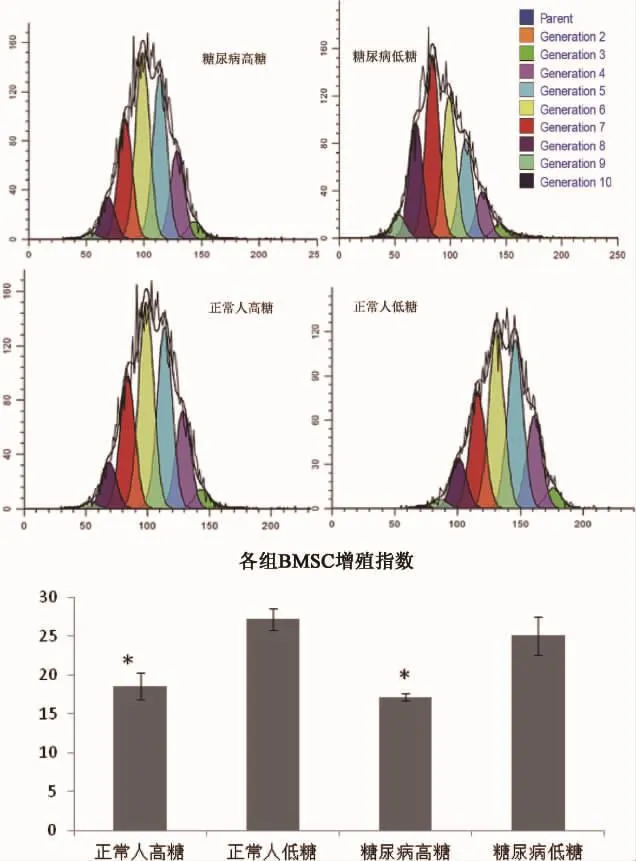
图3 细胞增殖实验:CFSE掺入法及流式细胞术进行细胞增殖实验,在正常人和糖尿病患者组中,低糖组明显高于高糖组,P<0.05。

图4 细胞凋亡实验:四组BMSCs中糖尿病高糖组的细胞凋亡率最高,约为12.8%,而其他三组的细胞凋亡率明显较小,其中正常人低糖组细胞凋亡最少。
2.4 细胞黏附实验 通过细胞黏附率的检测发现,正常人低糖组BMSCs在6小时的黏附率为88.13%±4.5%,稍高于其他三组,差异无明显统计学意义,正常人高糖组黏附率为75.54%±13.79%,糖尿病高糖组黏附率为85.07%±7.08%,糖尿病低糖组为82.53%±8.29%。而12小时的黏附率四组均可达到87%~91%,差异无统计学意义(见图4)。通过扫描电镜发现,钛片表面可见到BMSCs附着,细胞形态呈梭状,边缘有伪足伸出,细胞多尚未完全展开,伪足伸展不充分,细胞核体积较大,各组之间形态未发现明显差异(见图5A,B)。

图5 细胞黏附实验:四组细胞在6h 时黏附率可达75%~88%,12h时粘附率可达87%~91%,差异无统计学意义,P>0.05。扫描电镜发现(3000x)各组之间形态未发现明显差异。A:正常人牙槽骨BMSCs;B:糖尿病患者BMSCs。
2.5 细胞迁移实验 通过划痕法进行细胞迁移能力测定,发现6小时和24小时后正常人BMSCs在高糖和低糖环境下迁移距离均大于糖尿病患者BMSCs的迁移距离,正常人组划痕两侧的BMSCs 24h后几乎融合在一起,而糖尿病患者划痕两侧细胞尚有一定的距离。24h时正常人低糖组的迁移距离最高,为426.33±72.767μm;正常人高糖组迁移距离次之,为397.33±110.17μm;而糖尿病高糖组和低糖组分别为201.33±92.45μm和224.67±49.21μm,P<0.05。在 6h时观察发现正常人BMSCs的迁移距离大于糖尿病BMSCs的迁移距离,正常人组与糖尿病组之间差异有统计学意义(见图 6)。
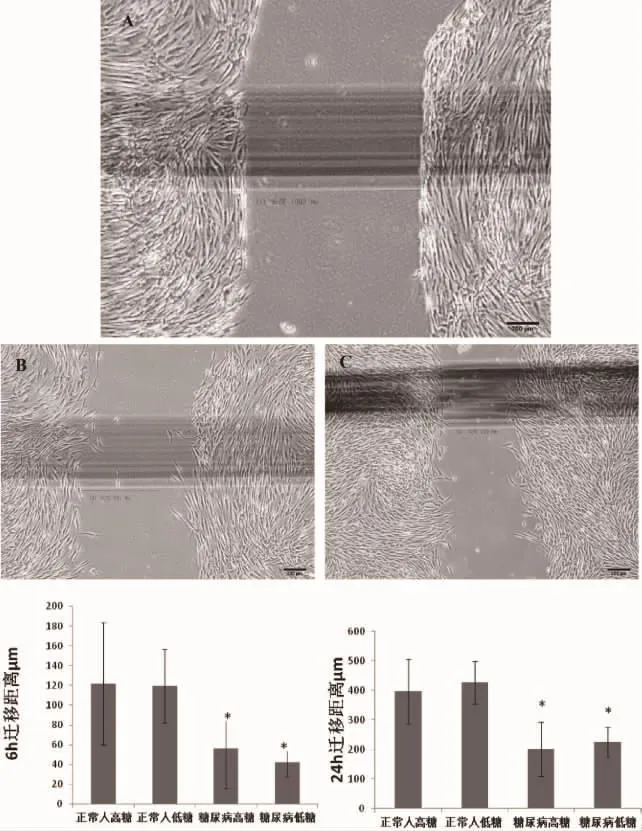
图6 细胞迁移实验:A:在倒置显微镜下测量细胞间距离,迁移距离为两个时间点测量值的差值。B:倒置显微镜下观察(40x),糖尿病组BMSCs 24h后细胞迁移情况。C:倒置显微镜下观察(40x),正常人组BMSCs 24h后细胞迁移情况。*表示该组细胞迁移距离与正常人组之间差异有统计学意义。
3.讨论
由于直接从患者牙槽骨取材有一定的创伤及风险,所以目前关于糖尿病患者牙槽骨骨髓间充质干细胞的研究还比较少,国内外许多研究多是采用正常的骨髓间充质干细胞在体外模拟不同的高糖环境,观察BMSCs生物学特性的改变。国外曾有学者报道可通过收集种植扩孔钻上骨屑来培养人牙槽骨骨髓基质干细胞[6]。本研究采用同样的方法从种植手术过程所收集的骨屑中,可以成功的分离培养出BMSCs,探讨出一种不需拔牙或组织活检等即能获得口腔颌面部组织工程种子细胞的方法,能够对口腔颌面部组织工程带来新的机遇,同时很可能是一种创伤最小的口腔颌面部种子细胞获取的方法。通过这种方法对糖尿病患者牙槽骨BMSCs进行研究将比在体外模拟不同浓度的高糖环境更直接,更有效,能够更好的为糖尿病患者牙种植提供理论和实验基础。
同时,本研究除了直接从糖尿病患者的种植过程中获取BMSCs外,还对获取的BMSCs在体外应用不同的糖浓度进行刺激,模拟糖尿病患者体内高血糖的水平,研究其BMSCs的生物学特性。本研究选择的低糖浓度为1g/L,约为5.56mmol/L,近似于正常情况下的血糖水平;选择的高糖浓度为4.5g/L,约为25mmol/L,与许多文献报道的糖浓度接近。有文献报道[7],糖浓度达到24mmol/L时对细胞的增殖、骨基质矿化、成骨分化影响较明显,所以本研究选择25mmol/L作为高糖组。本研究将正常人和糖尿病患者的BMSCs分别应用两种糖浓度培养基进行培养:糖尿病高糖组用来模拟糖尿病患者血糖未控制;糖尿病低糖组用来模拟糖尿病患者血糖控制良好的情况;正常人低糖组用来模拟正常人血糖水平;正常人高糖组用来模拟之前学者关于糖尿病BMSCs的研究。以正常人低糖组作为对照,本研究发现糖尿病高糖组BMSCs的增殖能力和迁移能力明显下降,而细胞凋亡明显增高;而糖尿病低糖组BMSCs仅在迁移能力上表现比对照组差,细胞增殖和细胞凋亡与对照组无明显区别;而正常人高糖组仅增殖能力较对照组下降,而凋亡和迁移能力未发现明显下降。所以之前有的研究采用正常的BMSCs细胞在高糖环境下进行培养来模拟糖尿病BMSCs,并不能完全反映出糖尿病患者的真实情况。本研究的分组更全面、更客观。
本研究通过观察糖尿病患者以及正常人的BMSCs的增殖、凋亡情况,发现糖尿病患者BMSCs在高糖环境下细胞的增殖能力明显低于正常人的BMSCs,同时也低于在低糖环境下的增殖能力,而DM高糖组BMSCs的细胞凋亡率明显高于其他三组。这提示我们糖尿病患者高糖环境严重影响了BMSCs的增殖能力,反而容易引起BMSCs的过早凋亡。Sun等[8]通过对2型糖尿病患者牙槽骨成骨细胞体外培养,也发现2型糖尿病患者牙槽骨成骨细胞增殖较缓慢。Dliloglu-Gurhan[9]等发现糖浓度的增高可以引起骨髓基质干细胞的过早衰老,使得骨髓基质干细胞的凋亡显著增加、增殖减少。Gopalakrishnan[10]等也证实,高糖环境下骨髓间充质干细胞的增殖,碱性磷酸酶活性、钙结节形成数目等都显著降低,认为高糖环境下成骨细胞分化能力减弱,这可能是糖尿病骨质疏松的原因之一。这与本研究的结果类似。
种植体骨结合是种植成功的关键,成骨细胞在种植材料表面的附着、黏附和伸展是细胞和材料作用的第一期,对于细胞后期的增殖和分化进而形成良好的骨结合界面至关重要。由于细胞黏附后才发生迁移、增殖、分化并分泌钙基质,细胞在材料表面的黏附直接影响到后继的生物学行为,是接触成骨的关键因素[11]。关于糖尿病患者牙槽骨BMSCs的粘附、迁移能力的实验尚未见报道。本实验除了对各组BMSCs的增殖、凋亡、成骨分化潜能等进行了研究,还对细胞的粘附和迁移能力进行了研究。通过细胞黏附率的检测发现,各组BMSCs在6小时的黏附率为75.54%~88.13%。而12小时的黏附率四组均可达到87%~91%,差异无统计学意义。姜焕焕等[12]使用成骨细胞发现亲水性纯钛表面6小时和12小时的细胞黏附率接近90%,与本实验结果接近。进一步通过扫描电镜发现,钛片表面可见到BMSCs附着,细胞形态呈梭状,边缘有伪足伸出,细胞多尚未完全展开,伪足伸展不充分,细胞核体积较大,各组之间形态未发现明显差异。本实验观察时间点为6小时和12小时,这考虑到BMSCs在接种后2~3小时开始粘附、贴壁,随着时间的增长比如24小时后,细胞的增殖可能会影响细胞黏附率的检测。
目前关于BMSCs在体内或体外的迁移规律的研究,特别是在损伤组织和病理条件下迁移的特性的研究还比较少。关于细胞迁移能力的检测主要有Transwell迁移小室和划痕方法(wound healing)。Transwell法应用范围较广,不受实验条件限制,但是价格比较昂贵,相反划痕法只需无菌移液管即可,比较方便经济[13]。细胞划痕法是简捷测定细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿培养的单层贴壁细胞上,用无菌移液管或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间,取出细胞培养板,观察周边细胞是否生长(修复)至中央划痕区,以此判断细胞的生长迁移能力。通过划痕法进行细胞迁移能力测定,发现6小时和24小时后正常人BMSCs在高糖和低糖环境下迁移距离明显大于糖尿病患者BMSCs的迁移距离,正常人组划痕两侧的BMSCs 24小时后几乎融合在一起,而糖尿病患者划痕两侧细胞尚有一定的距离。这说明糖尿病患者牙槽骨BMSCs的迁移(修复)能力较差,这可能也是糖尿病患者种植骨结合稍差的原因。而且,我们课题组前期研究发现,DM患者BMSCs成骨分化能力比正常人BMSCs成骨分化能力差,推测糖尿病患者BMSCs生物学特性较正常人减弱,从而影响骨改建[14],但是引起这些生物学行为改变的分子机制尚不清楚,还需要我们进一步研究。

