野葛特异性PCR检测方法的建立与应用研究
张丽,刘良科,郑丽平,刘秤利,刘虹,覃瑞*
(1 中南民族大学 生命科学学院/武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074;2 怀化学院 生物与食品工程学院,怀化 418008)
野葛(学名:Puerarialobata,英文名称:kudzu),是隶属于豆科葛属的多年生落叶藤本植物. 《本草纲目》记载:野葛,气味甘、平,无毒. 中国葛属植物中野葛(Puerarialobata)和粉葛(Puerariathomsonii)分布最广、产量最高[1]. 对我国葛属植物的研究结果表明,野葛的葛根素及总黄酮含量明显高于同属其他植物,粉葛次之,干燥野葛中总黄酮含量高达5%~10%,干燥粉葛中总黄酮含量也达到0.5%~4%[2]. 野葛的根茎叶及种子等部位都具有相当大的药用和食用价值,因此被广泛用于保健食品和医药等领域,是开发前景广阔的药食两用植物[3].
葛属植物大多具块根,野葛和粉葛是商品“葛根”的主要来源. 葛根的食用价值主要是从根中提取优质淀粉----葛粉,葛粉不仅富含人体必需的各种氨基酸和钙、铁、锌、硒等微量元素,还含有一定量的黄酮类物质,具有清热解毒、生津止渴等功效[4]. 由于葛属植物的块状根外形相似,从外观上难以鉴别. 葛根在加工成粉末后更加容易混淆,市场中的不法商贩经常在纯葛粉里大量地掺杂诸如红薯粉、马铃薯粉等廉价的薯类淀粉,甚至直接用廉价淀粉冒充,损害消费者利益[5].
目前,在葛根和葛根制品的鉴定方面,主要是以化学成分测定为主的仪器分析方法[6-8]. 在分子标记方面,也有利用RAPD标记[9]对葛根的遗传多样性进行分析,但是目前尚未有利用这些标记将野葛与其他植物进行区分的报道.
物种特有的DNA序列可以开发成能够识别该物种及其加工产品的标记. 该方法与其他检测方法相比,具有操作简便、灵敏度高、结果判定简单、重复性好等优点,非常适合生物真实身份的判定. 该方法在花生、芝麻等容易导致过敏的成分检测[10],牛、羊等动物源成分的鉴定[11],以及中药材的鉴定[12]方面均有广泛的应用. 本研究旨在寻找一段野葛特异性的DNA序列,并以此序列为基础建立野葛特异性PCR检测方法,用于野葛及其制品的检测和鉴定.
1 材料与方法
1.1 材料与试剂
野外收集湖南、云南、贵州、福建、重庆、安徽、河南等地的14个不同野葛居群样品. 其他20种不同种属的材料由本实验室收集,材料详细信息如表1和表2所示.

表1 14个不同野葛居群来源信息Tab.1 Origin of 14 different kudzu populations in this study

表2 特异性验证实验中所用到材料的详细信息Tab.2 Detailed information about the materials used in species specificity analysis
PCR试剂、Takara Taq酶皆购自宝生物工程(大连)有限公司,PCR引物由武汉擎科生物科技有限公司合成.
1.2 植物基因组DNA的提取与检测
植物基因组DNA采用QIANGEN公司(德国)生产的DNA小量提取试剂盒提取. DNA浓度和纯度检测用紫外分光光度法测定OD260/280. 用0.8%琼脂糖凝胶电泳和YeaRed核酸染料染色检测DNA样品的完整性. 使用植物18s rDNA基因引物对所有提取的植物基因组DNA进行PCR扩增,以验证基因组DNA的可扩增性[13].
1.3 目的基因的获取
首先对GenBank中野葛(Puerarialobata)基因信息进行检索分析,在检索分析时排除EST或微卫星序列,因为其序列大多很短,较难设计特异性引物. 优先选择具有完整信息的DNA或者cDNA序列,同时结合本研究团队从野葛中克隆获得的基因序列,对候选基因序列进行Blastn分析,筛选出特异性强、同源序列少的基因序列. 以这些基因序列为基础,设计PCR引物,对PCR扩增片段进行再次Blastn分析,以保证扩增片段的特异性. 最后通过PCR实验进行验证,筛选出扩增条带单一,扩增特异性、稳定性均较好的引物组合.
1.4 PCR扩增和检测
PCR引物利用primer premier 5.0软件设计. PCR的引物序列如表3所示. PCR反应体系为:20 ng/μL DNA 模板 1 μL,10 ×PCR 缓冲液 2.5 μL,25 mmol/L MgCl22.0 μL,10 mmol/L dNTP 0.5 μL,10 μmol/L 正、反向引物各 0.25 μL,DNA 聚合酶0.5 U,ddH2O 补足至 25 μL. PCR反应条件:94 ℃预变性2 min;94 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min.
PCR产物用1.5%琼脂糖凝胶进行电泳,电泳后用凝胶成像系统进行检测. PCR产物送至武汉擎科生物科技有限公司进行测序.
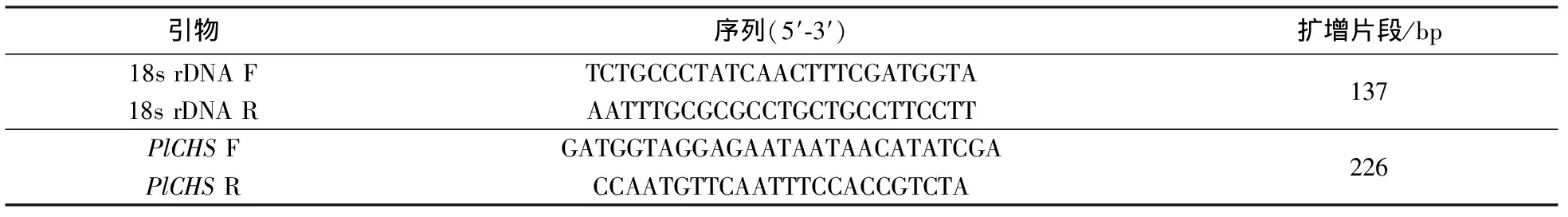
表3 检测所用的引物序列及扩增片段长度Tab.3 Primers used in qualitative PCR
2 结果与分析
2.1 候选DNA序列的筛选
通过序列的收集、筛选和Blastn比对分析,筛选到野葛查耳酮合成酶基因(D63855),异戊二烯合酶基因(AY316691),葡糖基转移酶基因(KC473599)等基因具有特异性较强的区域. 以特异性较强的区域为扩增靶标设计引物,进行PCR扩增,筛选扩增条带单一,扩增特异性、稳定性好的引物组合. 最终筛选出一对以野葛查耳酮合成酶基因(D63855)上的区域为靶标的引物组合. 图1为野葛查耳酮合成酶基因(D63855)在NCBI中进行Blastn比对分析的结果,图2为筛选出来的引物组合PlCHSF/PlCHSR的扩增序列在NCBI中进行Blastn比对分析的结果,可以看到该扩增序列具有较强的物种特异性.
2.2 物种特异性鉴定
2.2.1 种外扩增特异性
选取8种豆科植物、2种模式植物、10种其他植物对PlCHSF/PlCHSR引物组合的种外特异性进行实验(表2). 首先利用引物组合18s rDNA F/18s rDNA R对20个其他物种的DNA样品进行PCR扩增,并用1.5%琼脂糖凝胶对扩增产物进行电泳分析. 结果提取的20种植物的基因组DNA均能扩增出137 bp片段(图3),表明提取的20种植物基因组DNA的浓度和纯度满足PCR扩增要求. 再利用引物组合PlCHSF/PlCHSR 对20个其他物种(表2)的DNA样品进行PCR扩增,结果均无扩增(图4),表明PlCHSF/PlCHSR引物组合在其他物种中具有较强的特异性.
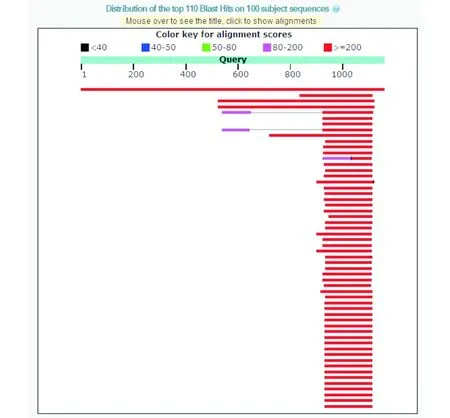
图1 野葛查耳酮合成酶基因的特异性分析Fig.1 Homologous analysis of chalcone synthase gene
2.2.2 种内扩增稳定性
利用引物组合PlCHSF/PlCHSR对采自我国14个不同地区的野葛的DNA样品进行PCR扩增,并用1.5%琼脂糖凝胶对扩增产物进行电泳分析,结果14种野葛的基因组DNA均能扩增出226 bp的片段(图5). 对扩增的片段进行序列测定,DNA序列与理论上一致. 表明引物组合PlCHSF/PlCHSR的扩增序列在不同野葛居群中一致性、稳定性好,可以作为野葛特异性序列,用于PCR检测野葛成分.

图2 查耳酮合成酶基因PCR扩增片段的特异性分析Fig.2 Homologous analysis of PCR amplification fragment for chalcone synthase gene

注:泳道M为DL2000 DNA ladder;泳道1为空白对照;泳道2~21分别为粉葛、峨眉葛、大豆、长豇豆、豌豆、蚕豆、绿豆、花生、拟南芥、烟草、水稻、玉米、薏米、萝卜、大麦、小麦、马铃薯、番茄、油菜、棉花图3 18S rDNA引物对20种植物基因组DNA PCR扩增结果Fig.3 Amplification of 18S rDNAs with DNA from 20 different plant species

注:泳道M为 DL2000 DNA ladder;泳道1为空白对照;泳道2为野葛叶片基因组DNA阳性对照;泳道3~22分别为粉葛、峨眉葛、大豆、长豇豆、豌豆、蚕豆、绿豆、花生、拟南芥、烟草、水稻、玉米、薏米、萝卜、大麦、小麦、马铃薯、番茄、油菜、棉花图4 PlCHS F/PlCHS R引物对20种其他植物基因组DNA PCR扩增结果Fig.4 Amplification of PlCHS F/PlCHS R with DNA from 20 different plant species
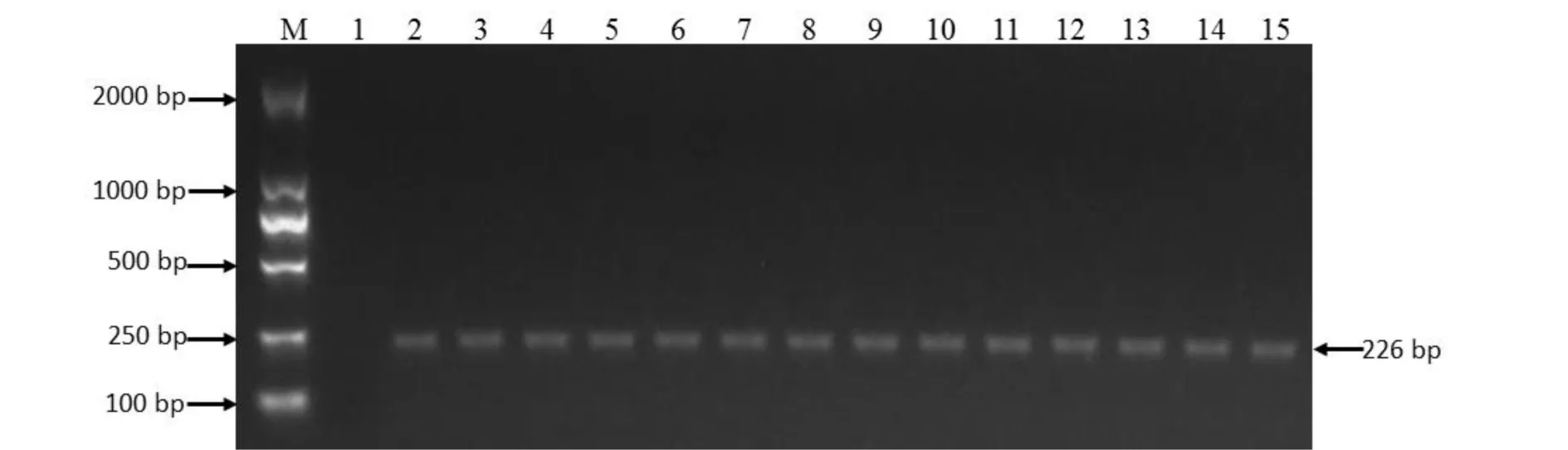
注:泳道M为 DL2000 DNA ladder;泳道1为空白对照;泳道2~15的野葛分别来自湖南、云南、贵州、福建、重庆、安徽、河南等地图5 PlCHS F/PlCHS R引物对14种不同野葛基因组DNA PCR扩增结果Fig.5 Amplification of PlCHS F/PlCHS R with DNA from 14 different kudzu populations
2.3 PCR灵敏度实验
为了确定引物组合PlCHSF/PlCHSR PCR反应的灵敏度,将野葛基因组DNA依次进行10倍梯度稀释,浓度梯度分别为20,2.0,0.2,0.02,0.002 ng/μL,以此为模板进行PCR扩增. 扩增结果如图6所示.在模板量为0.02 ng时还能看到条带,但是到0.002 ng时则已无可辨别的条带.

注:泳道M为DL2000 DNA ladder;泳道1为空白对照;泳道2~6分别为20、2、0.2、0.02、0.002 ng野葛基因组DNA图6 野葛基因组DNA浓度梯度稀释PCR扩增结果Fig.6 Amplification results with serial dilutions of kudzu DNA
因此该体系的定性PCR检测极限为0.02 ng野葛基因组DNA,单倍体野葛基因组约990 Mb[14, 15],0.02
ng基因组DNA则约含有18个拷贝的基因组DNA. 因此该体系的定性PCR检测极限为18个拷贝的野葛基因组DNA,该检测灵敏度高,可以满足实际检测的需求.
2.4 PCR检测葛根制品中的野葛根成分
为验证建立的PCR方法的适用性,从市场购买不同类型的葛根制品,分别为即冲型野葛粉(市售),野葛粉(同仁堂牌),野葛根中药饮片(市售),野葛代餐粉(市售),粉葛根粉(市售),粉葛根丁(市售),将上述葛根制品打磨成粉末状后提取基因组DNA,用引物组合18s rDNA F/18s rDNA R和PlCHSF/PlCHSR对6个样品进行PCR检测. 结果如图7所示,图A中18s rDNA检测引物对所有的葛根制品基因组DNA均有扩增,表明成功地从这些葛根制品中提取到了基因组DNA. 图B中野葛粉(同仁堂牌)和野葛根中药饮片(市售)均检测到与阳性对照相同的条带,因此含有野葛成分. 即冲型野葛粉(市售),野葛代餐粉(市售),粉葛根粉(市售),粉葛根丁(市售)均无扩增,因此不含有野葛成分. 实验结果表明,本研究建立的基于野葛特异性序列的引物组合能够准确鉴定出样品中的野葛成分.

注:泳道M为DL2000 DNA ladder;泳道1为空白对照;图A中泳道2~7分别为18s rDNA F/18s rDNA R对 6种不同的葛根制品:即冲型野葛粉(市售),野葛粉(同仁堂牌),野葛根中药饮片(市售),野葛代餐粉(市售),粉葛根粉(市售),粉葛根丁(市售)的扩增结果;图B中泳道2为野葛叶片基因组DNA阳性对照,泳道3~8分别为PlCHS F/PlCHS R对6种不同的葛根制品的扩增结果市售图7 葛根制品PCR检测结果Fig.7 PCR detection of kudzu products
3 结语
以特定的化学成分及其含量对物种进行鉴定已广泛应用[16, 17],但化学成分指纹图谱分析的依据主要为植物物种后天的代谢产物,且大多为植物的次生代谢物,容易受到生物体的生长发育阶段、环境条件、人类活动等的影响,具有较大的变异性,存在主观性强、重复性和稳定性差等缺点[18]. 目前,物种的分类研究已经从过去的形态学分类转变为分子系统学及代谢组学研究[19]. 本研究以野葛物种特有的DNA序列为基础,建立的特异性PCR检测方法,属于一种生物学指纹图谱,不受样本形态特征、组织部位的影响,对物种的鉴定更加准确.
此外,目前对葛属种质资源的全面调查、品种选育等方面的研究和应用较少,对于葛属植物的分类也未有定论,《中国植物志》第四十一卷记载中国产葛属8种3变种,顾志平等认为有9种2变种[1]. 此外,葛属种的命名也存在不规范之处,如“葛根”既有葛属植物的块状根之意,又有习惯特指“野葛”或者“粉葛”. 食用葛(Puerariaedulis)有别称葛根、葛藤、粉葛、甘葛,与粉葛又相互混淆. 本研究建立的野葛特异性检测方法,可作为传统方法的有力补充,用于葛属植物的物种鉴定与分类中.
通过生物信息学和分子生物学手段筛选和鉴定出野葛特异性的DNA序列,设计了特异性引物组合PlCHSF/PlCHSR,对野葛14个不同的居群都有相同的扩增,对20种其他植物均无扩增,检测灵敏度可达0.02 ng基因组DNA. 对市场上的各种葛根制品进行检测,能够准确地鉴定出制品中是否为野葛以及是否含有野葛成分. 本研究为野葛成分的鉴定提供了一种方便、快捷、特异强、灵敏度高的PCR检测方法.

