FOXA2在胰腺癌组织中的表达及其对胰腺癌细胞增殖和侵袭的影响
赵金磊,季春勇,罗红杰,刘东亮
(郑州大学附属郑州市中心医院 肝胆胰微创外科,河南 郑州 453000)
胰腺癌作为消化系统常见的、恶性程度极高的肿瘤类型,近年来发病率呈升高趋势,且病死率位居恶性肿瘤第四位[1]。由于该肿瘤不易早期被诊断,多数患者确诊时已进展为中晚期[2],且手术切除后复发率高,患者预后较差,5年生存率较低[3]。有研究指出,胰腺癌发生及进展是多基因、多步骤、多因素共同作用的结果[4]。叉头框蛋白A2(forkhead box A2,FOXA2)作为叉头框蛋白家族重要成员,在进化上高度保守,广泛存在于真菌及动物体中,与胚胎发育、细胞增殖、分化、生长及能量代谢等密切相关[5]。近年来发现,FOXA2参与了肿瘤发生及浸润转移过程,与恶性肿瘤患者不良预后有关[6]。本研究分析FOXA2在胰腺癌组织中的表达,以及与病理特征和预后的关系,并利用小分子干扰RNA(siRNA)技术沉默人胰腺癌PANC-1细胞株,观察其对细胞增殖、迁移和侵袭能力的影响,以期为胰腺癌发病机制研究提供基础资料。
1 资料和方法
1.1 病例资料选择
选取2010年1月至2013年1月在郑州市中心医院择期行手术切除的胰腺癌患者71例,其中,男42例,女29例,年龄36~78岁,平均(59.61±10.72)岁,所选对象术前未行放化疗,术后经病理学检查均为胰腺导管癌。根据第七版国际抗癌联盟(UICC)和美国癌症联合委员会(AJCC)TNM分期标准:I期37例,II期18例,III期16例;分化程度:低分化21例,中分化31例,高分化19例;发生淋巴结转移29例。术中留取胰腺癌和肿瘤边缘>3 cm癌旁组织,甲醛固定,石蜡包埋保存。本研究通过医院伦理委员会批准。所有患者从手术时间开始进行随访,截止时间为2018年1月31日或患者死亡时间,随访形式包括门诊和电话,随访时间0.5~60个月,随访过程中失访3例。
1.2 主要试剂和设备
免疫组化试剂盒(北京中杉金桥生物公司),兔抗FOXA2多克隆抗体(美国Cell Signaling Technology公司),人胰腺癌PANC-1细胞株(上海斯信生物科技公司),胎牛血清、DMEM培养基、RPMI1640培养基和0.25%胰蛋白酶(美国Gibco公司)。siRNAFOXA2和阴性对照序列由上海基康生物公司设计合成,FOXA2和内参引物由上海生工生物公司设计合成。Lipofectamine 2000转染试剂和Trizol总RNA提取试剂(美国Invitrogen公司),逆转录和PCR试剂盒(日本TaKaRa公司),CCK-8检测试剂盒(广州硕恒生物科技有限公司),聚偏二氟乙烯膜(PVDF) (上海膜源环保科技有限公司),Transwell小室(美国Costar公司),Matrigel基质胶(美国BD公司),7500型实时荧光定量PCR仪(美国ABI公司)。
1.3 检测方法
1.3.1 免疫组化SP法检测胰腺癌和癌旁组织中FOXA2蛋白表达:取胰腺癌和癌旁组织石蜡标本,连续切片(厚度约4 μm),二甲苯脱蜡,梯度乙醇脱水,用磷酸盐抗原修复液行抗原修复,3%双氧水灭活内源性过氧化物酶,血清封闭60 min,加入一抗兔抗FOXA2多克隆抗体(1:800稀释),4 ℃过夜孵育,加入二抗,DAB显示,苏木素复染。经脱水、透明、封片,上镜观察。以PBS替代一抗为阴性对照。结果判定:FOXA2蛋白主要表达于胞浆,以胞浆中出现黄色或黄褐色染色为阳性;随机取5个高倍视野,采用半定量法[7]对结果判定:(1)染色强度:按不染色、浅黄、黄色、棕黄色分别赋分0~3分;(2)阳性细胞比例:按<10%、10%~25%、26%~50%、51%~75%和>75%分别赋分0~4分。上述两项评分相乘作为最终评分,阴性:0~4分,阳性:≥5分。所有切片均由2位病理科医师独立完成阅片。
1.3.2 细胞培养和处理:人胰腺癌PANC-1细胞用含10%胎牛血清的DMEM培养基培养,AsPC-1细胞用含10%胎牛血清的RPMI1640培养基培养,培养条件:37 ℃、饱和湿度、5% CO2。24 h后,胰酶消化,传代培养。取对数生长期细胞,按转染试剂盒说明进行转染。分组方法:(1)siRNA-FOXA2组:转染FOXA2的siRNA序列:5'-ACCAGTGGATCATGG ACCT-3';(2)siRNA-NC组:转染阴性对照序列:5'-T TCTCCGAACGTGTCATGT-3';(3)对照组:不作任何处理。转染后各组继续培养48 h完成后续实验。
1.3.3 实时荧光定量PCR技术检测细胞中FOXA2基因表达:取各组转染后培养48 h细胞,加入细胞裂解液,用Trizol总RNA提取试剂提取细胞中总RNA,使用紫外分光光度计检测纯度,标准为A260/A280在1.80~2.20。用逆转录试剂盒对RNA进行逆转录,用实时荧光定量PCR仪,按PCR试剂盒说明对引物进行扩增。引物序列:FOXA2:上游:5'-TGGAGCAGC TACTATGCAG-3',下游:5'-CGTGTTCATGCCGTT CATC-3';GAPDH:上游:5'-ATGTTCGTCATGGGT GTGAA-3';下游:5'-GGTGCTAAGCAGTTGGTGG T-3'。PCR反应条件:94 ℃ 3 min,94 ℃ 30 s,94 ℃30 s,60 ℃ 30 s,76 ℃ 30 s,连续循环38次。每个样品设平行复孔6个。用2-△△Ct法获得细胞中FOXA2 mRNA相对表达量。
1.3.4 Western blotting检测细胞中FOXA2蛋白表达:各组细胞培养48 h后,提取总蛋白,并按BCA法测定浓度。取50 μg总蛋白,行SDS-PAGE凝胶电泳分离,电转移至PVDF膜,室温下用10%脱脂奶粉封闭120 min,加入一抗兔抗FOXA2多克隆抗体,4 ℃过夜孵育,TBST冲洗3次,加入二抗,室温孵育60 min,TBST冲洗3次,加入ECL暗室下反应10 min,拍照,用Image J软件对蛋白条带分析。
1.3.5 CCK-8法检测细胞增殖活性:取各组转染后细胞,制备单细胞悬液,浓度为6×104/mL,各取100 μL加入至96孔板,置于37 ℃培养箱中培养,分别于24、48、72和96 h时,弃培养液,加入CCK-8液,37 ℃培养60 min,用酶联免疫仪取450 nm波长处检测各孔吸光度值(OD),每组设6个复孔。
1.3.6 Transwell法检测细胞迁移能力:取各组转染后培养48 h细胞,胰酶消化,离心后取细胞沉淀,用无血清培养液重悬,调整密度为5×104个/mL,取200 μL加入到Transwell小室上室,下室则加入600 μL的含10%胎牛血清的培养液,培养条件同1.2.2。24 h后取出小室,多聚甲醛固定,结晶紫染色,用棉签将散落的细胞去除,镜下随机取5个视野计数穿膜细胞数。
1.3.7 Transwell法检测细胞侵袭能力:取液态Matrigel基质胶,用预冷无血清培养液按1:6体积稀释,取40 μL加入到Transwell小室上室,风干备用。其余步骤同1.2.4。
1.4 统计学分析
使用SPSS 17.0统计软件进行数据分析,计数资料采用率值表示,组间比较采用χ2检验,计量资料采用(±s)表示,多组间比较采用单因素方差分析和LSD-t检验,生存分析采用Kaplan-Meier法和Log-Rank检验,影响患者预后的危险因素分析采用COX比例风险回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌和癌旁组织中FOXA2蛋白表达情况
胰腺癌组织中FOXA2蛋白阳性表达率32.39%(23/71),低于癌旁组织的83.10%(59/71),差异有统计学意义(χ2=37.405,P<0.001),见图1。
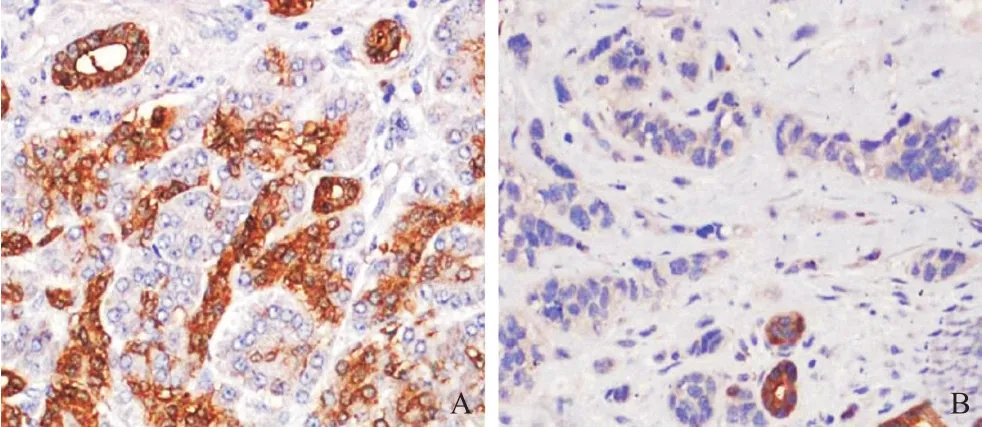
图1 胰腺癌和癌旁组织中FOXA2蛋白表达(免疫组化,×200)
2.2 胰腺癌组织中FOXA2蛋白表达与临床病理指标间的关系
胰腺癌组织中FOXA2蛋白阳性表达与年龄、性别、肿瘤大小、肿瘤部位和分化程度无关(P>0.05),而与TNM分期、淋巴结转移和脉管癌栓有关(P<0.05),见表1。
2.3 胰腺癌组织中FOXA2蛋白表达与预后的相关性
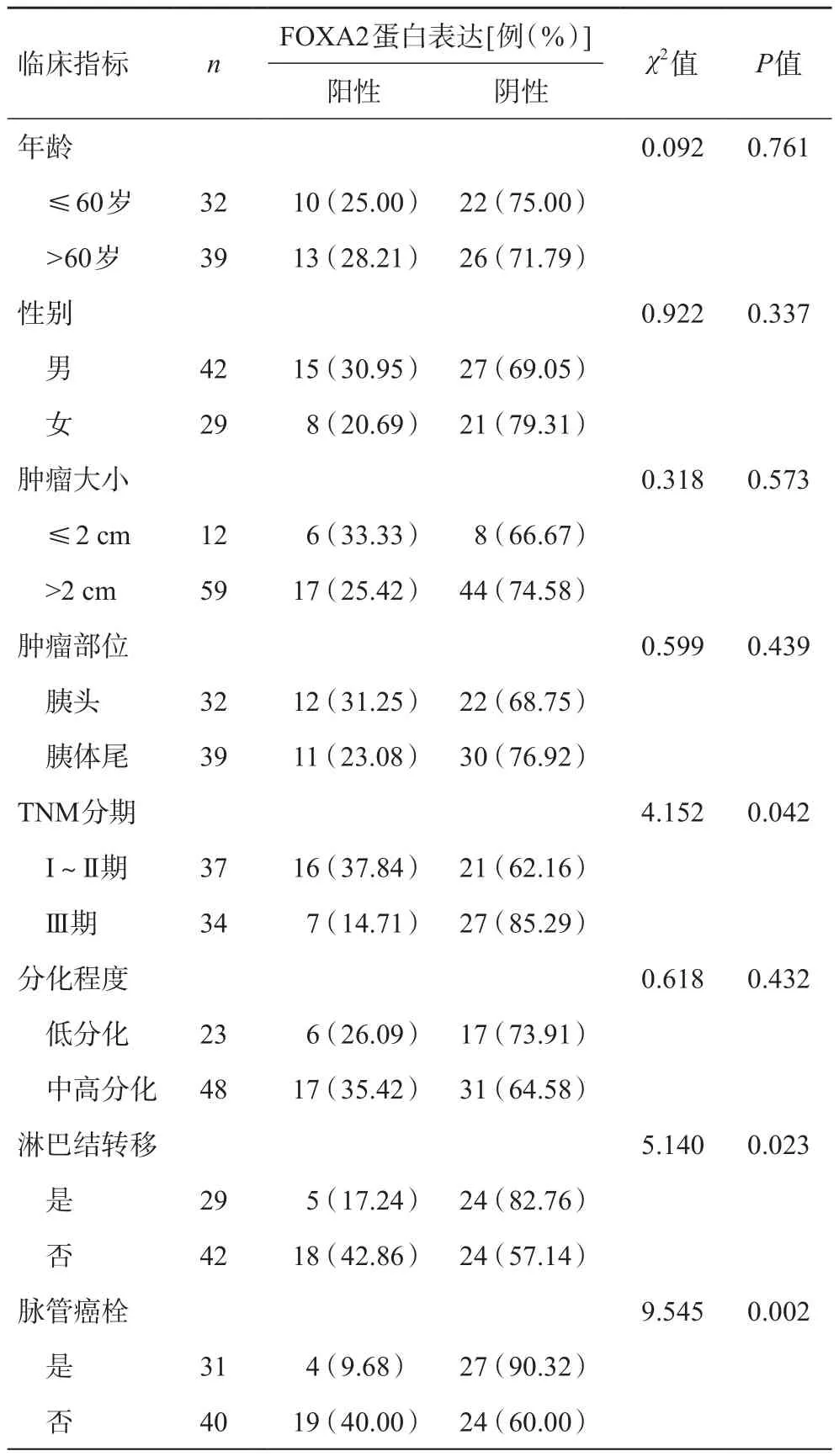
表1 胰腺癌组织中FOXA2蛋白表达与临床病理指标间的关系
根据胰腺癌组织中FOXA2蛋白表达情况,将患者分为阳性组(n=22)和阴性组(n=46),Kaplan-Meier生存分析结果显示,阳性组患者平均生存时间(28.46±3.30)个月,高于阴性组的(15.17±1.83)个月,Log-Rank检验差异有统计学意义(χ2=11.135,P=0.001),见图2。
2.4 胰腺癌患者生存时间的影响因素分析
Cox比例风险回归模型结果显示,淋巴结转移、脉管癌栓和FOXA2蛋白阴性表达是影响患者预后的风险因素(P<0.05),见表2。
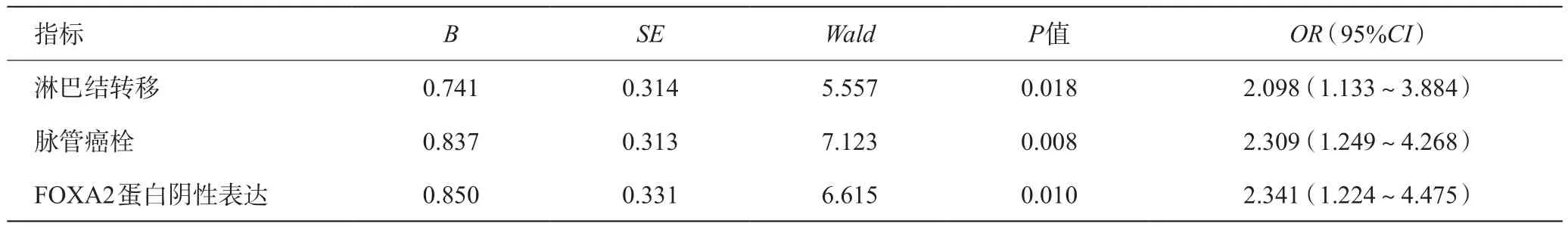
表2 影响胰腺癌患者生存时间的多因素Cox比例风险回归模型分析
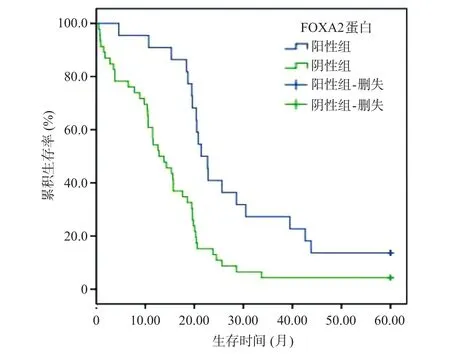
图2 Kaplan-Meier法分析胰腺癌组织中FOXA2蛋白表达对预后的影响
2.5 各组细胞中FOXA2 mRNA和蛋白表达情况
siRNA-NC组和对照组细胞中FOXA2 mRNA和蛋白表达量无统计学差异(P=0.345和0.106),siRNA-FOXA2组细胞中FOXA2 mRNA和蛋白表达量低于siRNA-NC组和对照组,差异有统计学意义(P<0.05),见表3。
2.6 FOXA2基因沉默对各组细胞增殖活性的影响
CCK-8实验结果显示,siRNA-FOXA2组24、48、72和96 h时OD值均高于siRNA-NC组和对照组,差异有统计学意义(P<0.05),见表4。
2.7 FOXA2基因沉默对各组细胞迁移和侵袭能力的影响
siRNA-NC组和对照组迁移细胞数和侵袭细胞数均无差异(P>0.05),siRNA-FOXA2组迁移细胞数和侵袭细胞数均高于siRNA-NC组和对照组,差异有统计学意义(P<0.05),见表5、图3和图4。
3 讨论
临床研究发现,胰腺癌患者确诊时超过80%的已出现远处转移,从而错失了最佳的手术根治时机[8]。研究表明,高侵袭转移性是导致胰腺癌患者病情进展快、病死率高的重要因素[9]。因此,积极探讨影响胰腺癌侵袭转移的相关机制及敏感基因对改善患者预后具有积极意义。FOXA2作为调控胚胎发育的重要基因,在细胞增殖、分化、器官形成中发挥重要作用[10];同时,研究发现,FOXA2在肝癌、乳腺癌、肺腺癌、胃癌等多种恶性肿瘤组织中表达缺失,可能发挥抑癌基因的功能[11-14]。本研究结果显示,胰腺癌组织中FOXA2蛋白阳性表达率低于癌旁组织,说明FOXA2蛋白在胰腺癌组织中呈低表达,可能发挥抑癌基因的功能而参与胰腺癌发生。在与临床病理特征之间的关系分析发现,FOXA2蛋白在TNM分期III期、发生淋巴结转移及出现脉管癌栓的胰腺癌组织中阳性表达率更低,说明FOXA2蛋白低表达与胰腺癌恶性进行有关,提示FOXA2可能参与了胰腺癌恶性化过程。Kaplan-Meier生存分析结果显示,FOXA2蛋白阳性组患者平均生存时间高于阴性组,说明FOXA2蛋白表达与胰腺癌患者预后有关,阳性表达者总体生存时间长于阴性者。Cox比例风险回归模型结果显示,FOXA2蛋白阴性表达是影响患者预后的风险因素,进一步说明FOXA2蛋白与胰腺癌患者预后有关,是影响预后的风险因素。
表3 各组细胞中FOXA2 mRNA和蛋白表达比较(n=6, ±s)

表3 各组细胞中FOXA2 mRNA和蛋白表达比较(n=6, ±s)
注:与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05
组别 FOXA2 mRNA FOXA2蛋白siRNA-FOXA2组 1.23±0.12*# 0.23±0.04*#siRNA-NC组 2.46±0.12 0.84±0.06对照组 2.55±0.23 0.79±0.07 F值 118.669 213.467 P值 <0.001 <0.001
表4 各组细胞不同时点吸光度OD值比较(n=6,±s)
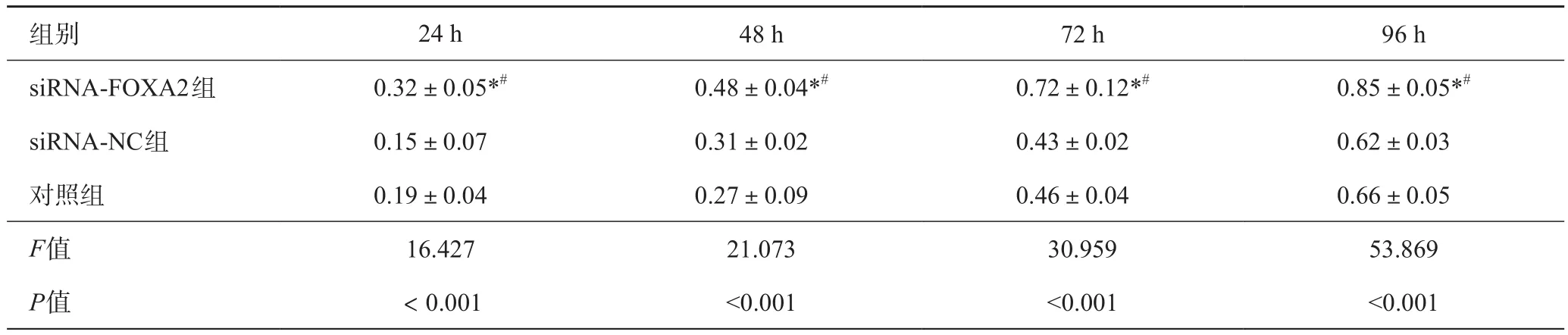
表4 各组细胞不同时点吸光度OD值比较(n=6,±s)
注:与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05
组别 24 h 48 h 72 h 96 h siRNA-FOXA2组 0.32±0.05*# 0.48±0.04*# 0.72±0.12*# 0.85±0.05*#siRNA-NC组 0.15±0.07 0.31±0.02 0.43±0.02 0.62±0.03对照组 0.19±0.04 0.27±0.09 0.46±0.04 0.66±0.05 F值 16.427 21.073 30.959 53.869 P值 <0.001 <0.001 <0.001 <0.001
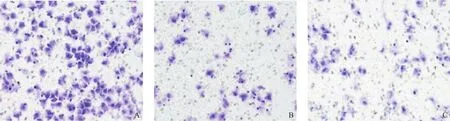
图3 Transwell法检测细胞迁移能力(结晶紫染色,×200)
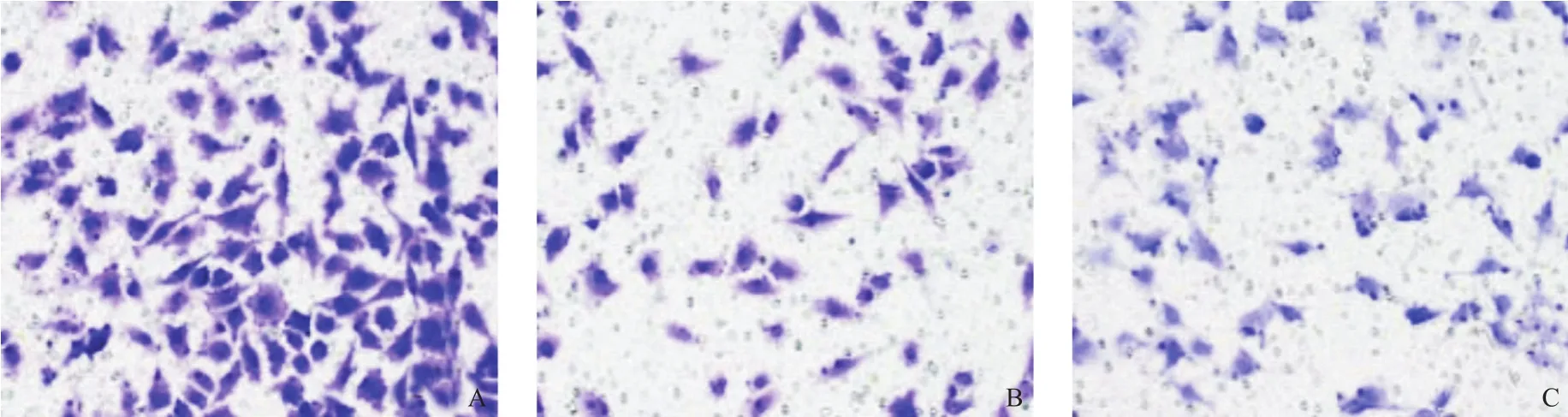
图4 Transwell法检测细胞侵袭能力(结晶紫染色,×200)
本研究利用siRNA技术特异性下调PANC-1细胞中FOXA2基因,结果显示,siRNA-FOXA2组细胞中FOXA2 mRNA和蛋白表达量均低于siRNA-NC组和对照组,说明两种细胞中FOXA2基因表达被成功抑制。王曦等[15]研究指出,过表达FOXA2后会抑制结直肠癌细胞的增殖,促进癌细胞的凋亡。本研究CCK-8实验结果显示,siRNA-FOXA2组24、48、72和96 h时OD值均高于siRNA-NC组和对照组,说明沉默FOXA2基因表达可明显增强细胞的增殖活性。有研究指出,FOXA2信号通路与肿瘤细胞侵袭转移过程密切相关[16]。本研究结果显示,siRNA-FOXA2组迁移细胞数和侵袭细胞数均低于siRNA-NC组和对照组,说明特异性下调PANC-1细胞中FOXA2表达,细胞迁移和侵袭能力均增强,提示FOXA2基因可能参与了胰腺癌细胞迁移和侵袭过程,但具体机制尚待进一步研究明确。
表5 不同组PANC-1和AsPC-1迁移细胞数和侵袭细胞数比较(n=6,±s)
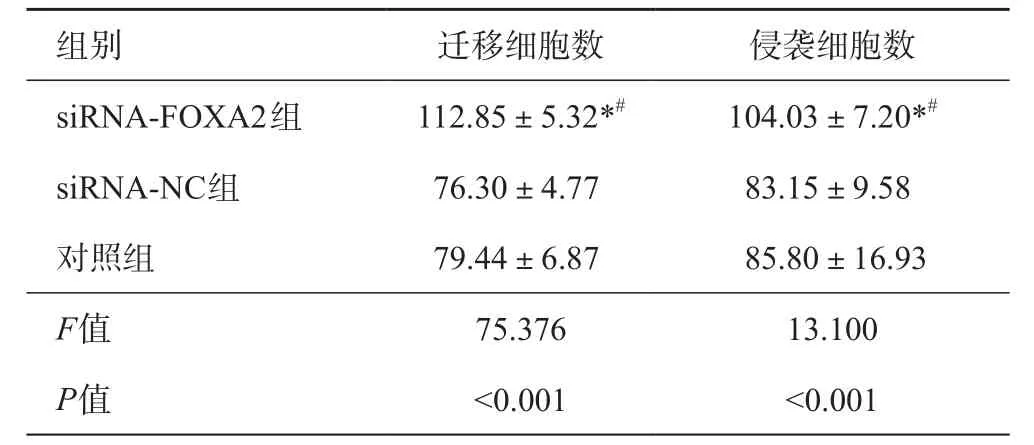
表5 不同组PANC-1和AsPC-1迁移细胞数和侵袭细胞数比较(n=6,±s)
注:与对照组比较,*P<0.05;与siRNA-NC组比较,#P<0.05
组别 迁移细胞数 侵袭细胞数siRNA-FOXA2组 112.85±5.32*# 104.03±7.20*#siRNA-NC组 76.30±4.77 83.15±9.58对照组 79.44±6.87 85.80±16.93 F值 75.376 13.100 P值 <0.001 <0.001
综上所述,胰腺癌组织中FOXA2蛋白呈低表达,且与肿瘤恶性化及患者预后有关,是影响患者预后的风险因素,FOXA2基因可能参与了胰腺癌细胞增殖、迁移和侵袭过程,沉默FOXA2基因表达,胰腺癌细胞增殖、迁移和侵袭力明显增强。FOXA2基因有望为胰腺癌临床诊疗提供新的潜在靶点,为药物研发提供新的线索。

