核酸适配体在食源性致病菌检测中应用的研究进展
胡金强,黄润娜,王 一,赵卫东,高 辉,姜春鹏,耿 尧,景建洲,董彩文,王章存
(1.郑州轻工业学院,食品与生物工程学院,河南郑州 450000; 2.河南省食品安全国际联合实验室,河南郑州 450000; 3.食品生产与安全河南省协同创新中心,河南郑州 450000; 4.河南省冷链食品质量安全控制重点实验室,河南郑州 450000)
近年来,国内外食品安全事件层出不穷,食源性致病菌在全世界广泛分布并每年造成成千上万例人类疾病。据WHO公布的信息,全球每年发生食源性疾病达数10亿起。美国疾病控制与预防中心估计,每年约有4800万例食源性疾病患者,其中12.8万人入院治疗,3000人死亡[1]。据报道,2018年4月,美国农业部(USDA)宣布召回得克萨斯州标准肉制品公司生产的约5.3万磅可能受沙门氏菌污染的生牛肉产品[2];同月,美国食品与药物管理局(FDA)宣布,美国北卡罗来纳州海德县一家养鸡场自愿召回2.07亿枚怀疑被沙门氏菌污染的鸡蛋[3]。在我国,威胁食品安全的最大问题同样是致病微生物引起的食品污染。据国家卫计委通报,2015年度,我国微生物性食物中毒人数高达3181人,占全年食物中毒总人数的53.7%,为食物中毒人数之最[4]。以上数据表明,食源性致病菌污染已成为食品安全的首要隐患,是世界头号食品安全问题,迫切需要建立快速、灵敏、特异、高效的检测技术对食源性致病菌进行预防、控制以及风险评估。
目前针对食品中致病菌检测,主要采用传统(改进)培养鉴定技术[5]、PCR及其衍生技术[6-8]以及免疫学检测技术[9]等手段。然而,传统检测技术检测周期长、灵敏度不高、样品处理繁琐;PCR及其衍生技术使用的仪器昂贵、检测易出现假阳性结果;免疫学检测技术存在抗体制备周期长、成本高等缺陷,已不能满足食品安全对食源性致病菌进行快速、灵敏、特异检测的需求[10]。
核酸适配体是一段能特异性识别并结合靶分子的15~40个碱基寡核苷酸片段[11]。核酸适配体的概念在1990年由Ellington和Szostak[12]最早提出并命名,同年,Tuerk与Gold[13]首次提出这种新的体外筛选与扩增核酸的方法-指数富集配体系统进化技术(System aticevolution ofligandsby exponential enrichment,SELEX),并且利用该技术筛选出可与T4 DNA聚合酶特异性结合的随机寡核苷酸。迄今为止,已有200多种靶物质的核酸适配体得到筛选[14]。核酸适配体可有效识别如生物大分子[15]、细菌[16]、细胞[17]、小分子[18]、病毒[19]等各种目标物,具有筛选周期短、高亲和性、高特异性以及适用范围广泛等技术优势,已在重金属与抗生素检测[20]、药物筛选[21]、物质分离与纯化以及疾病诊断与治疗[22-23]以及食源性致病菌检测[24]等领域得到广泛应用。本文主要从核酸适配体的筛选技术分类以及在食源性致病菌检测中的应用等方面进行简要概述。
1 适配体的筛选技术分类
目前,根据筛选过程中是否涉及序列扩增富集,适配体筛选技术主要可分为SELEX和Non-SELEX两大类。
1.1 SELEX筛选适配体
当前,多数适配体采用SELEX技术进行筛选。SELEX主要包括毛细管电泳-SELEX(Capillary electrophoresis SELEX)、亲和层析-SELEX、全细胞-SELEX、磁珠-SELEX、微流控-SELEX等方法。核酸适配体筛选过程主要包括4个步骤:a.建立文库:人工合成一个含核酸序列数大约为1013~1015的单链随机寡核苷酸文库;b.孵育:将靶标与建立的文库在一定条件下孵育,形成适配体-靶标复合物;c.分离:孵育后,通过离心、滤膜过滤等分离方法使与靶标结合力强与未结合(结合力弱)的核酸序列进行分离;d.扩增:分离后的DNA或RNA序列经PCR(RT-PCR)进行扩增,扩增产物经分离与纯化,制备次级文库,进行下一轮筛选。经数轮筛选后可得到高亲和力与高特异性的适配体[25]。针对食源性致病菌适配体的SELEX筛选主要采用全细胞-SELEX、磁珠-SELEX、亲和层析-SELEX等技术方法。
全细胞-SELEX是以全细胞作为靶物质,在一定程度上拓宽了SELEX筛选靶标范围,而且避免了靶标的纯化过程。磁珠-SELEX具有球形展示面,便于靶标展示以及具有便捷的磁性分离特性。亲和层析-SELEX筛选技术不仅具有成本低、重复性等特点,而且可用来研究靶分子的结合位点。
1.2 Non-SELEX筛选适配体
Non-SELEX由Berezovski等[26]首次提出并应用于h-RAS蛋白适配体筛选,与SELEX不同的是,Non-SELEX是以缩短筛选周期为目的的高效筛选方法,不需要进行PCR等核酸序列扩增步骤,经过2~3次分离、分析筛选步骤后直接可得到适配体序列。Kim等[34]利用平衡混合物的非平衡毛细管电泳筛选方法经3轮Non-SELEX筛选便得到了能特异性结合大肠杆菌O55∶B5脂多糖的适配体。常规SELEX筛选技术通常需要经过8~15轮筛选,筛选周期为1~3个月,与之相比,Non-SELEX筛选技术可在几天甚至几小时内完成适配体筛选全过程,极大地缩短了筛选周期。然而,Non-SELEX筛选技术需要利用毛细电泳仪进行筛选,有一定局限性,多用于大分子物质的适配体筛选。
截止目前,通过SELEX与Non-SELEX已筛选适用于大肠杆菌[27-34]、沙门氏菌[35-44]、金黄色葡萄球菌[45-52]、副溶血弧菌[41,53-54]、单核增生李斯特菌[55-56]、蜡样芽孢杆菌[57]、志贺氏菌[58-59]以及铜绿假单胞菌[60]等诸多食源性致病菌适配体(表1)。此类适配体可直接用于构建基于适配体的快速、灵敏、特异的食源性致病菌检测技术。

表1 食源性致病菌检测相关适配体Table 1 Aptamers for the detection of foodborne pathogens
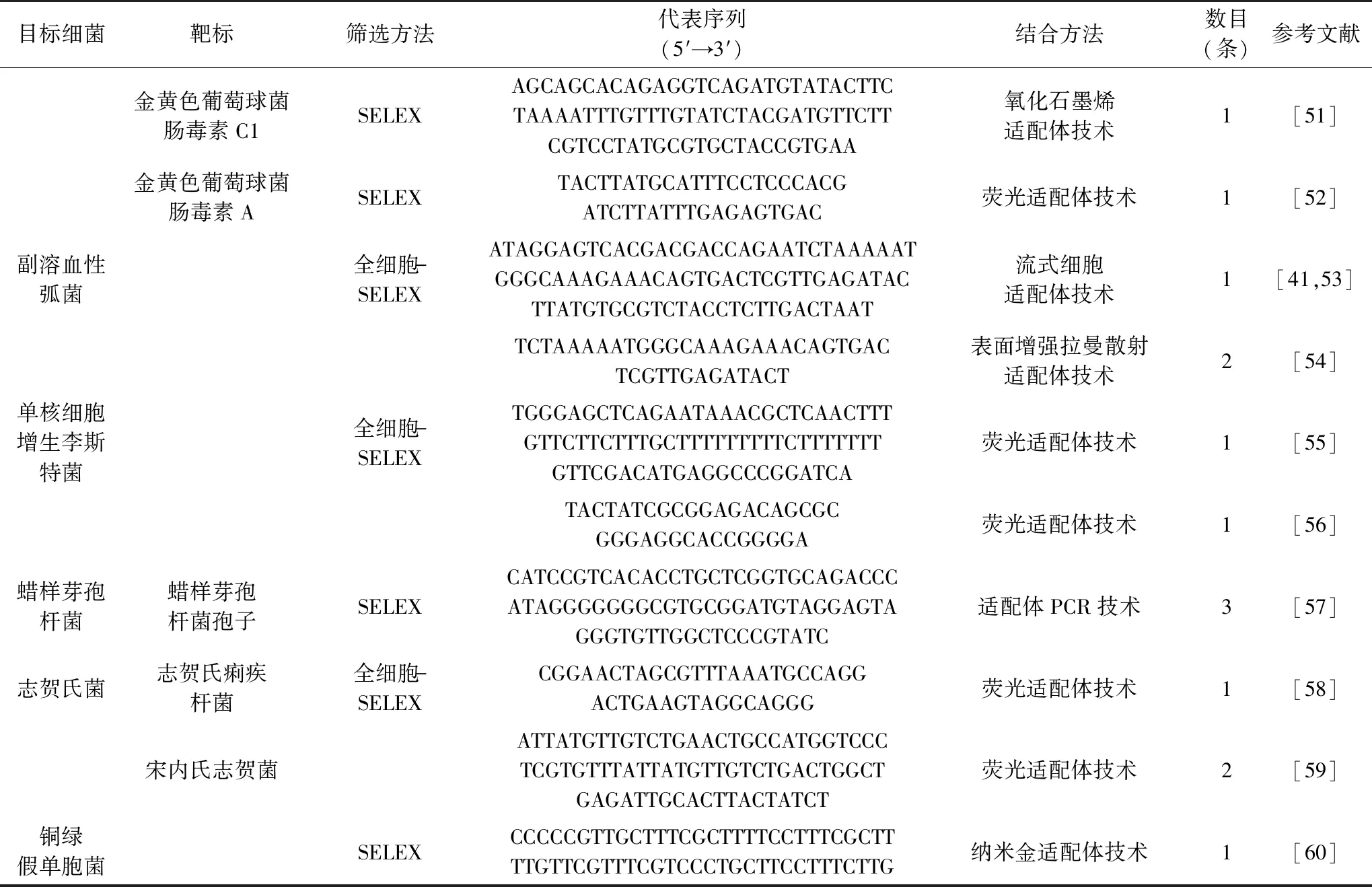
续表
2 适配体在食源性致病菌检测中的应用
2.1 纳米金适配体技术
纳米金为直径在1~100 nm之间的纳米材料。纳米金由于简便的制备方法、良好的生物相容性、优异的催化活性、独特的物理与光学性质等优点,已成为当前的研究热点[61]。适配体与纳米金技术结合可构建高灵敏度、高特异性快速检测技术,适配体与纳米金在溶液中结合,当靶目标存在时,适配体作为识别与捕获因子特异性地结合目标菌,引起纳米金状态发生改变。基于状态变化,可对靶目标进行定性与定量分析。目前,纳米金适配体技术已应用于铜绿假单胞菌[60]和鼠伤寒沙门氏菌等食源性致病菌[37]的检测。将铜绿假单胞菌的适配体与超顺磁性氧化铁纳米粒子共价结合建立方法,在加入目标菌后通过测量自旋-自旋弛豫时间(T2)的增加可以对靶物质进行定量测定,已应用于鸡肉与饮用水样品中铜绿假单胞菌检测,该方法可以在40 min内完成检测,检测限为50 CFU/mL[60],该方法具有灵敏度高,操作简捷,反应迅速和良好选择性等优点,可实现对复杂食品基质中的铜绿假单胞菌进行快速检测,然而缺点是仪器昂贵,不适合现场检测。此外,可将适配体作为识别与捕获元素,结合纳米金标银增强信号放大技术,可实现对鼠伤寒沙门氏菌的可视化检测。在最佳条件下,菌液浓度为101~106CFU/mL(R2=0.9913)时,鼠伤寒沙门氏菌浓度与信号强度呈线性相关,检测限为7 CFU/mL[37],该方法检测结果与传统检测法一致,可对实际食品样品中的鼠伤寒沙门氏菌进行灵敏、快速、直观的检测。适配体结合靶分子的高亲和力和特异性,确保了该检测技术的高灵敏度与高特异性,可满足食源性致病菌的快速检测要求,未来可向多重检测方向发展。
2.2 荧光适配体技术
荧光检测具有灵敏度高、选择性强、定量精准等优点,与核酸适配体技术结合更能发挥技术优势[62]。适配体与荧光标记技术结合,是基于适配体与靶物质作用后发生荧光强度改变以检测食源性致病菌,利用荧光基团或淬灭基团修饰适配体,加入目标菌后适配体构象发生改变引起荧光信号差异。近年来,荧光适配体技术已用于沙门氏菌O8[43]、单核细胞增生李斯特菌[56]、金黄色葡萄球菌[63]和宋内氏志贺氏菌[59]等食源性致病菌的快速、灵敏、特异性检测。建立单核细胞增生李斯特菌荧光适配体技术,首先,应用全细胞-SELEX技术筛选出与靶细菌结合效果最好的荧光修饰适配体A15,然后将生物素化的适配体A15固定在微孔板上形成夹心型结构捕获靶标,适配体与细菌亲和形成的复合物与羧基荧光素(FAM)标记的适配体A15结合,并用SpectraMax M5分光光度计测定荧光强度,检测限为75 CFU/mL[56],该方法具有良好的检测单核细胞增生李斯特菌生长的能力,研究还证实,适配体的靶分子非常广泛并且可以用不同表位捕获靶标。Maeng等[63]根据RNA适配体荧光强度的变化,开发了检测金黄色葡萄球菌等致病菌的检测系统,将筛选出的RNA适配体通过硫醇基团固定在银膜上,RNA适配体捕获的细菌可通过添加适配体-dT-FAM后发射荧光量的增加而被检测到。该方法操作简捷、快速、特异性强。宋内氏志贺氏菌的荧光适配体检测技术建立,通过使用全细胞-SELEX技术筛选得到最优适配体SS-3与SS-4,然后在5′端分别以5′-胺修饰的SS-4与Cy5标记的SS-3合成捕获探针与检测探针来检测与鉴别宋内氏志贺氏菌,检测限为103cells/mL[59],研究表明,建立的荧光适配体传感器平台可特异性检测多种食物中的宋内氏志贺氏菌。
综上所述,荧光适配体技术已在多种致病菌检测中得到应用,此外,对该技术的研究一方面有利于质量控制和食品安全,对开发其它致病菌的快速、灵敏检测方法具有重要意义;另一方面,这种方法未来可向多种病原菌同时检测的便携式检测方向发展,具有良好的应用前景。
2.3 电化学适配体技术
电化学检测方法具有操作简便、成本低廉、灵敏度高、仪器简单,适用于便携式设备等优点[40]。适配体与电化学技术结合,是将适配体与电化学活性传感元件固定在电极上,加入靶物质后,适配体与靶物质结合导致电极表面修饰物结构改变,通过检测电化学信号或电流变化进行定性与定量检测。当前,电化学适配体技术已用于检测大肠杆菌O111[33]、大肠杆菌O55∶B5[34]、葡萄球菌肠毒素B[49]和金黄色葡萄球菌[64]等食源性致病菌及其毒素。建立检测大肠杆菌O111的电化学适配体生物传感器技术,需先将捕获探针通过Au-硫醇锚定在电极表面上,适配体因与捕获探针杂交被固定在金电极表面,当目标菌存在时,适配体会识别、结合目标菌并脱离捕获探针,捕获探针与生物素化检测探针结合后留在电极表面,加入识别元件链霉抗碱性磷酸酶后产生电化学信号,该技术可在3.5 h内可实现对目标致病菌的精确定量,对牛奶样品中目标菌的检测限为305 CFU/mL[33],是一种特异性强、准确性高、灵敏、快速的检测技术。利用电化学法拉第阻抗理论开发了检测牛奶中葡萄球菌肠毒素B(staphylococcal enterotoxin B,SEB)的无标记、简便的电化学适配体生物传感器技术,当样品中存在SEB时,由于适配体对SEB有高特异性与亲和性,使SEB组装在金电极表面上,阻止[Fe(CN)6]3-/4-进入电极表面进行有效电子转移,得到[Fe(CN)6]3-/4-的大法拉第阻抗反应;当在样品中不存在SEB时,只有适配体与巯基己醇(MCH)组装在电极表面上,导致有效的电子转移,产生小法拉第阻抗反应。结果显示,在0.5~500 ng/mL范围内,Ret与SEB的浓度对数呈线性关系,检出限为0.17 ng/mL(S/N=3)[49],该检测技术与ELISA商品化试剂盒检测结果一致,具有良好的适用性与可靠性。Abbaspour等[64]设计了一种基于双适配体的电化学夹心传感器测定法检测金黄色葡萄球菌,固定在磁珠表面上的初级适配体捕获金黄色葡萄球菌,与银纳米颗粒缀合的次级适配体提供限定的电化学特性,显著提高了检测的灵敏度,应用释放的Ag+离子进行差示脉冲阳极溶出伏安(DPV)信号的测量,以对金黄色葡萄球菌进行定性与定量检测。该方法灵敏度高,对适配体常规检测方法无法检测的微量细菌的检测提供了新方法。
电化学适配体技术既可进行有标记的检测也可进行无标记的简单检测。相比于其他技术,电化学适配体传感器技术更易于实现小型化检测,具有检测成本低、灵敏度高、响应快、设计方便且适用性强、检测限低等特点,已成为食品中病原微生物检测的有力工具。
2.4 流式细胞适配体技术
流式细胞术(Flow cytometry,FCM),是应用流式细胞仪对单个细胞或微粒进行多参数定量分析与分选的检测技术,具有快速、灵敏、精确以及便于操作等突出优点[65]。适配体与流式细胞术结合,是对适配体进行荧光标记后,应用流式细胞仪通过荧光分析对靶物质进行定性与定量检测。应用流式细胞术,以荧光标记的核酸适配体为识别分子,构建的检测与鉴别金黄色葡萄球菌的新技术特异性强、操作简捷,40 min即可从浓度为108~109CFU/mL混合菌液中准确鉴别金黄色葡萄球菌[47]。Duan等[53]采用流式细胞仪对FAM标记的副溶血弧菌适配体进行特异性与亲和力分析,筛选出最佳适配体,并在之后建立同时检测副溶血性弧菌与鼠伤寒沙门氏菌的流式细胞适配体技术,该技术应用量子点分别标记副溶血性弧菌与鼠伤寒沙门氏菌适配体,量子点-适配体复合物与副溶血弧菌结合后显示出绿色荧光,与鼠伤寒沙门氏菌结合后显示为橙色荧光,采用流式细胞术通过荧光分析进行定性与定量检测,两种细菌的检测限均为5×103CFU/mL,可在虾样品中对目标菌进行特异性定量检测[41]。该方法具有检测速度快、特异性强、分析全面等技术优点。
食品样本往往存在多种微生物污染,实现食源性致病菌的高通量鉴别是未来检测发展趋势。流式细胞术可通过多种适配体同时使用,实现食源性致病菌的多重检测。然而该方法涉及的流式细胞仪价格昂贵、荧光染料成本较高、样品前处理繁琐,目前仅适用于实验室的基础研究,工业化应用不多。
2.5 表面增强拉曼散射适配体技术
表面增强拉曼散射(surface-enhanced Raman scattering,SERS)技术以其极高的灵敏度、荧光背景低、对检测样品无损等优势,广泛应用于化学工业分析、生物分析以及医学检测等诸多领域[66]。利用适配体与表面增强拉曼技术结合可构建便捷、灵敏、特异的传感器。建立检测副溶血弧菌的表面增强拉曼适配体传感器,需合成SiO2@Au核壳纳米粒子(NPs)并制备有效的SERS基底,在靶标存在时,固定在SiO2@Au核壳NPs表面的适配体1(apt 1)与花青染料3(Cy3)修饰的适配体2(apt 2),形成了SiO2@Au-apt 1-target-apt 2-Cy3三明治样复合物。在最佳条件下,SERS信号与菌液浓度10~106CFU/mL线性相关,检测限为10 CFU/mL[54],该方法灵敏度高,选择性强,可实现对细菌的直接检测,无需提取病原基因组,对实际样品的检测与标准平板法检测结果一致,符合率高。Ravindranath等[67]将抗鼠伤寒沙门氏菌、抗金黄色葡萄球菌以及抗大肠杆菌O157∶H7抗体分别用金(Au)、银(Ag)和银金核壳纳米粒子进行功能化标记,应用拉曼与紫外-可见吸收光谱同时检测三种不同的病原体。该平台可特异性捕获靶细菌以及从细菌混合物中检测特定病原体,该方法可在30 min内检测鸡尾酒中多种病原体的存在,检测限为102~103CFU/mL。建立的新技术可实现致病菌的高通量检测,并具有可扩展到多种应用潜力,为其他适配体新技术的开发提供理论指导。Li等[38]提出了一种基于表面增强拉曼散射快速灵敏检测鼠伤寒沙门氏菌的适配体传感器,互补DNA(cDNA)和靶标与适配体竞争结合,导致适配体构象发生改变,分散的金纳米棒(GNRs)和SERS“热点”形成的等离子体耦合导致拉曼光谱极大增强,以对氨基苯硫酚(PATP)作为拉曼活性信号分子,在菌液浓度为56~56×107CFU/mL范围内,检测信号与菌液含量呈线性相关,检测限为9 CFU/mL。该方法已用于牛奶样品中鼠伤寒沙门氏菌的检测。表面增强拉曼散射适配体技术具有较宽的线性范围以及极低的检出限,是检测食源性致病菌检测中极具发展前景的技术手段。随着纳米技术的进步,更多灵敏的、可重复性的SERS基底将被制备,未来可实现商业化。此外,便携式拉曼光谱仪的设计与使用有利于实现食源性致病菌的现场快速分析。
综上,基于适配体的检测技术在食源性致病菌检测得到广泛应用,这些技术具有高特异性与较高的灵敏度,可对食品中的致病菌进行快速、高效的检测。然而,该技术方法也具有一定的缺陷性,例如,使用仪器昂贵、样品前处理复杂等。因此,研究者可根据研究需求以及实验条件选择合适的适配体检测技术(见表2)。

表2 适配体技术对比Table 2 Comparison between aptamer technologies
3 结语与展望
核酸适配体具有特异性强、稳定性好、灵敏度高、亲和力强、易于修饰等特点,能够识别多种目标物,与纳米金、荧光、电化学、流式、表面增强拉曼等技术相结合,可进一步提高检测的灵敏度,降低检测成本,缩短检测时间,因此在食源性致病菌检测中得到广泛应用。然而,适配体技术在食源性致病菌检测相关技术依然存在适配体筛选效率低,高通量与多重同时检测关键技术欠缺,相关仪器设备体型庞大、价格昂贵等瓶颈,难以满足现场快速检测需求。
核酸适配体技术可从如下几个方面进行深入研究。应用石墨烯SELEX、细胞芯片SELEX以及高保真SELEX等新型SELEX筛选技术进一步提高适配体筛选效率与质量;将适配体与核酸新型重组酶聚合酶扩增技术、环介导等温扩增技术等相结合,大幅降低病原菌检测限以及检测速度;研究适配体与微流控芯片相结合技术,实现食源性致病菌的高通量、自动化检测;探索适配体与侧流层析技术结合方法,对病原微生物实现可视化检测;将适配体与ELISA技术等结合,并实现对大规模食品中的病原菌进行快速分析,降低检测成本;将适配体与荧光技术结合并借助智能手机实现便携式一体化检测。综上所述,核酸适配体在食源性致病菌监测、风险评估以及控制等方面具有广阔的应用前景。

