尿石素A对糖尿病小鼠心肌细胞自噬的影响
朱小艳,周 友,岑慧裕,黄雅焱,高智敏,吴晓倩
(广州医科大学药学院药理学教研室,广东 广州 511436)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病主要的心血管并发症之一,独立于高血压、冠心病、心脏瓣膜病及其他已知心脏疾病而存在,是由糖代谢紊乱引起,以心脏结构和功能障碍为主要病理改变的一种心肌病变。DCM发病机制较为复杂,目前尚未被详尽阐明[1]。现有研究证明,自噬在DCM进程中发挥着重要的作用[2]。自噬是真核细胞内受严格调控的溶酶体依赖性降解途径,正常情况下,心肌细胞内保持一种低水平的自噬,清除错误折叠的蛋白质和老化受损的细胞器,为细胞提供营养,在饥饿缺血/缺氧应激状况下,自噬受到激活或抑制,维持细胞稳态[3]。有研究表明,在DCM的发生、发展过程中激活自噬,能够起到保护DCM的作用[4]。也有研究显示,抑制自噬后,能够对DCM的损伤进行修复[5]。
尿石素A(urolithin A,UA)主要由富含鞣花单宁的植物(石榴、草莓、核桃模型、花生等)经体内肠道微生物代谢产生,具有抗炎、抗氧化等生物活性[6],且在抗缺血/再灌注[7]、顺铂所致肾损害[8]等方面有积极作用。研究表明,UA能通过诱导自噬而延长线虫的寿命,并通过增强自噬而改善啮齿类动物衰老性肌肉衰退功能[9]。另有研究表明,UA能够通过激活PI3K/Akt通路,缓解心肌缺血/再灌注损伤[7]。UA对于DCM的影响及机制尚不十分清楚。本研究通过高糖处理乳鼠心肌细胞建立DCM细胞模型,观察不同时间、不同浓度高糖刺激对乳鼠心肌细胞内自噬的影响;建立DCM小鼠模型,探讨UA能否改善糖尿病心肌病损伤。
1 材料与方法
1.1 材料
1.1.1实验动物 新生1~3 d的SD乳鼠,♀♂不限,购自广州中医药大学实验动物中心;健康♂ C57BL/6小鼠,SPF级,50只,体质量(20±5)g,购于广州中医药大学实验动物中心,动物准字号:SYXK(粤)2016-0168。小鼠分笼饲养,自由进食和饮水。动物实验参照中国动物福利法案,经广州医科大学实验动物伦理委员会批准后进行。
1.1.2试剂 DMEM低糖培养基、L-15细胞培养液、胎牛血清、胰蛋白酶,购于美国Gibco公司;UA、链脲佐菌素(streptozotocin,STZ)、D-(+)-葡萄糖(glucose)、氯喹(chloroquine,CQ),购于Sigma公司;MTT细胞增殖检测试剂盒,购于南京凯基公司;鼠单抗GAPDH,抗兔或抗鼠二抗,购自北京中杉金桥;LC3一抗,购自美国Cell Signal Technology公司;p62一抗,购自Bioworld公司。
1.1.3仪器 低温高速离心机(德国Hettich公司);垂直电泳槽、转膜仪(美国Bio-Rad公司);超净工作台(苏州仪器厂);凝胶成像分析系统(美国UVP);自动洗片机(美国Kodak);CO2培养箱(Thermo)。
1.2 方法
1.2.1乳鼠心肌细胞分离培养 新生1~3 d乳鼠消毒1~2次,在超净台无菌条件下,用眼科剪沿左侧肋骨打开胸腔暴露搏动心脏,取出心脏,放入装有30 mL预冷的HBSS离心管中,晃洗3遍至洗净残留血液。将洗净残留血液的心肌组织移至100 mm培养皿中,修剪出左心室心肌组织后,剪碎成均匀的1~2 mm小块,加入预冷的8 mL HBSS和2 mL 0.25%的胰酶,4 ℃冰箱消化12~16 h。次日,加入2 mL的FBS终止消化后,加入终浓度为0.1%二型胶原酶,于37 ℃水浴摇动45 min,取出加入L-15细胞培养基轻轻吹打组织,用500目滤网过滤后,于室温中静置20 min,离心,吹打成细胞悬液,种于100 mm培养皿中,放在正常细胞培养箱中静置45 min进行差速贴壁。取出培养皿,收集液体离心,弃上清,吹打成细胞悬液,接种细胞,24 h后换液,即可进行后续实验。
1.2.2细胞实验分组 为探讨不同浓度高糖对心肌细胞的影响,乳鼠心肌细胞随机分为:正常对照组(使用含葡萄糖5.5 mmol·L-1的DMEM培养基),葡萄糖(20、33、47 mmol·L-1)培养基刺激48 h组。为探讨33 mmol·L-1葡萄糖对心肌细胞内自噬的影响,乳鼠心肌细胞随机分为:正常对照组(使用含葡萄糖5.5 mmol·L-1的DMEM培养基)、33 mmol·L-1葡萄糖刺激48 h组、33 mmol·L-1葡萄糖刺激48 h+20 μmol·L-1CQ处理12 h组。为探讨不同浓度UA对高糖诱导的心肌细胞内自噬的影响,乳鼠心肌细胞随机分为:正常对照组(使用含葡萄糖5.5 mmol·L-1的DMEM培养基)、33 mmol·L-1葡萄糖+UA(5、10、15、20 μmol·L-1)刺激48 h组。
1.2.3糖尿病模型的制备 6~8周龄C57BL/6 ♂小鼠随机分为正常对照组(CON组,8只)、正常+UA组(CON+UA 50 mg·kg·d-1,6只)、DCM模型组(DCM组,9只)、UA低、高剂量组(DCM+UA 25、50 mg·kg·d-1,各10只)。每日灌胃给药1次,连续给药10周。
1.2.4Western blot检测 取等量的各组蛋白上样,使用SDS-PAGE凝胶,在100 V恒压下电泳,250 mA恒流转膜,转膜结束后,用5%脱脂奶粉室温封闭PVDF膜1 h,一抗4 ℃孵育过夜,PBST洗膜3次,每次10 min,二抗室温孵育1 h,PBST洗膜5次,每次10 min,取出膜,增强化学荧光发光试剂中反应1 min,曝光成像后进行扫描。
1.2.5MTT法检测细胞存活性 按照说明书操作。酶标仪在570 nm波长处检测每孔的吸光度(A)值,按公式:细胞存活率%=处理组A值/对照组A值×100%,求出各组的存活率,重复3次。计算并评价细胞存活率。
1.2.6超声测量心功能 采用加拿大VisualSonics生产的Vevo2100高分辨小动物超声成像系统,探头频率为250 MHz对小鼠进行超声心动图检测,观察小鼠心脏结构及其功能的变化。异氟烷麻醉小鼠后,仰卧固定于37 ℃恒温加热板上,持续吸入异氟烷。小鼠四肢与心电图电极相连以监测心率。脱毛,涂抹超声波导声剂,进行超声检测,分别在短轴用M-Mode和在超声四腔面用二尖瓣灌流模式,检测小鼠心脏的收缩和舒张功能。超声心动图各参数连续测量5个心动周期,计算均值。
1.2.7常规Masson染色 将心脏组织经冷PBS灌注后,置于4%多聚甲醛中固定24 h。常规石蜡包埋, 制作切片,连续切片(厚4 μm),每5张取1张,每个标本取3张切片。脱蜡后行Masson染色,通常心肌细胞呈红色,胶原纤维呈蓝绿色,每张切片在400倍光学显微镜下观察,并随机选取4个视野拍照,用Image-Pro Plus 5.0图像处理系统测量胶原纤维阳性区占所观察视野的面积比。
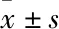
2 结果
2.1 不同浓度高糖对心肌细胞存活率的影响Fig 1的MTT结果显示,高糖条件下,乳鼠心肌细胞的存活率随着葡萄糖浓度的升高而逐渐下降,在33 mmol·L-1葡萄糖刺激48 h后,乳鼠心肌细胞的存活率明显下降,部分细胞出现死亡,与对照组比较差异有显著性(P<0.05)。本研究选取的最佳高糖造模浓度是33 mmol·L-1。
2.2 不同浓度高糖对心肌细胞内自噬相关蛋白表达的影响20、33、47 mmol·L-1葡萄糖培养基刺激乳鼠心肌细胞48 h,Fig 2结果表明,与对照组相比,在不同浓度高糖条件下,自噬相关蛋白LC3 II的表达增加,LC3 Ⅱ/Ⅰ比值增加,自噬底物蛋白p62堆积(P<0.05)。提示高糖刺激后,心肌细胞内自噬体降解受阻,自噬流可能发生障碍。
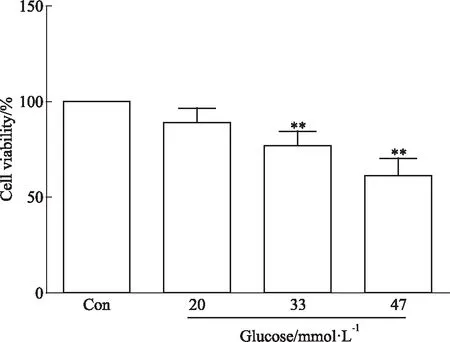
Fig 1 Effect of different concentrations of high glucose(HG) on cell viability in neonatal rat
**P<0.01vscontrol
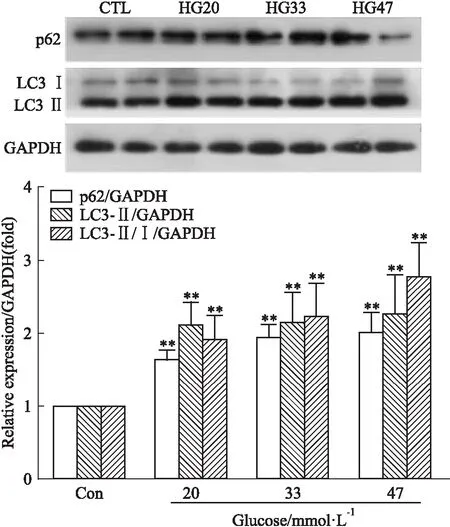
Fig 2 Effect of different concentrations of HG on expression of autophagy related proteins in
**P<0.01vscontrol
2.3 33 mmol·L-1葡萄糖对心肌细胞内自噬的影响为进一步探讨高糖对心肌细胞内自噬的影响,运用自噬抑制剂CQ(溶酶体融合抑制剂)处理心肌细胞。Fig 3结果表明,与对照组相比,33 mmol·L-1葡萄糖处理心肌细胞48 h后,细胞内LC3 Ⅱ的表达增加、LC3 Ⅱ/Ⅰ比值增加、自噬底物蛋白p62堆积(P<0.05);添加CQ处理12 h后,与高糖组相比,细胞内自噬蛋白LC3 Ⅱ及p62的表达并无明显差异,没有额外的LC3 Ⅱ及p62堆积。提示33 mmol·L-1葡萄糖刺激48 h后,心肌细胞内自噬流已发生障碍,自噬体与溶酶体融合受阻。
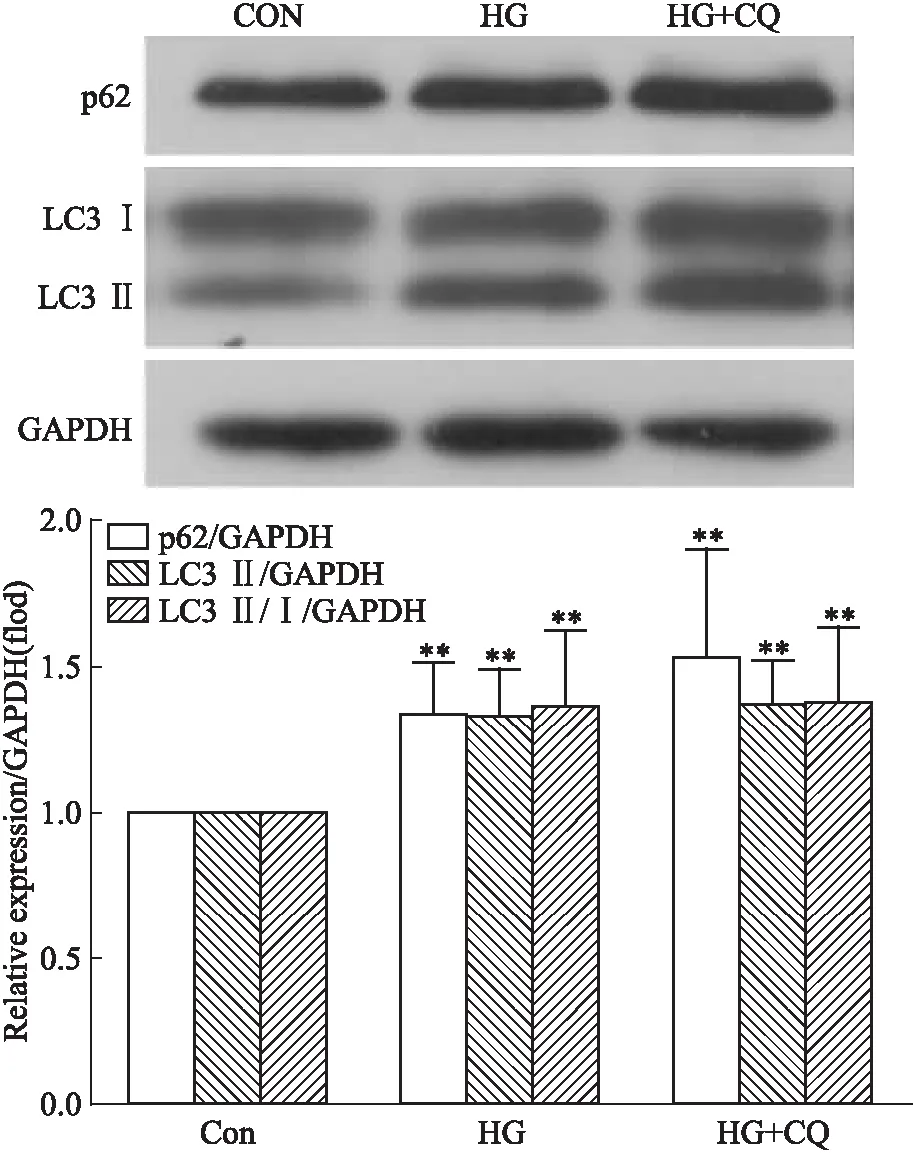
Fig 3 Effect of 33 mmol·L-1 HG on expression of autophagy related proteins in neonatal rat
**P<0.01vscontrol
2.4 不同浓度UA对心肌细胞存活率的影响应用不同浓度的UA作用于正常条件下的乳鼠心肌细胞,Fig 4的MTT结果表明,以对照组(葡萄糖5.5 mmol·L-1)细胞存活率为100%作为参照,随着UA浓度的增大,乳鼠心肌细胞的存活率下降,UA(40 μmol·L-1)刺激48 h后,存活率下降与对照组比较差异具有显著性(P<0.05)。
2.5 UA对高糖诱导的心肌细胞内自噬相关蛋白表达的影响本实验选择5~20 μmol·L-1的UA,在33 mmol·L-1高糖培养的基础上,给予不同浓度的UA干预48 h。Fig 5的Western blot显示,乳鼠心肌细胞经过高糖刺激48 h后,自噬底物p62堆积,LC3 Ⅱ表达、LC3 Ⅱ/Ⅰ比值明显增多,与对照组比较差异有统计学意义(P<0.05);给予UA后,自噬底物p62堆积减少,随着UA浓度的提高,细胞内自噬相关蛋白LC3 Ⅱ表达、LC3 Ⅱ/Ⅰ比值逐渐下降,与高糖组比较差异有统计学意义(P<0.05)。提示UA对高糖诱导的细胞内自噬流障碍有改善作用。
2.6 UA对糖尿病小鼠心功能的影响Fig 6的超声结果显示,DCM组E/A峰下降明显,与对照组比较差异有显著性(P<0.05);UA(25、50 mg·kg·d-1)组E/A值升高(P<0.05),提示UA对糖尿病小鼠心脏舒张功能有改善作用。
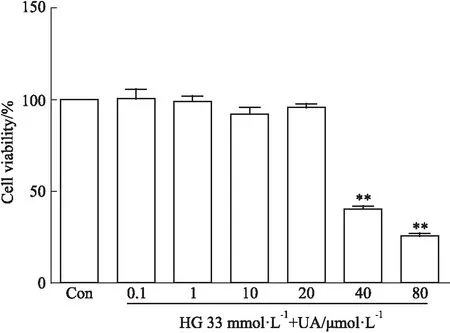
Fig 4 Effect of urolithin A on cell viability in neonatal
**P<0.01vscontrol
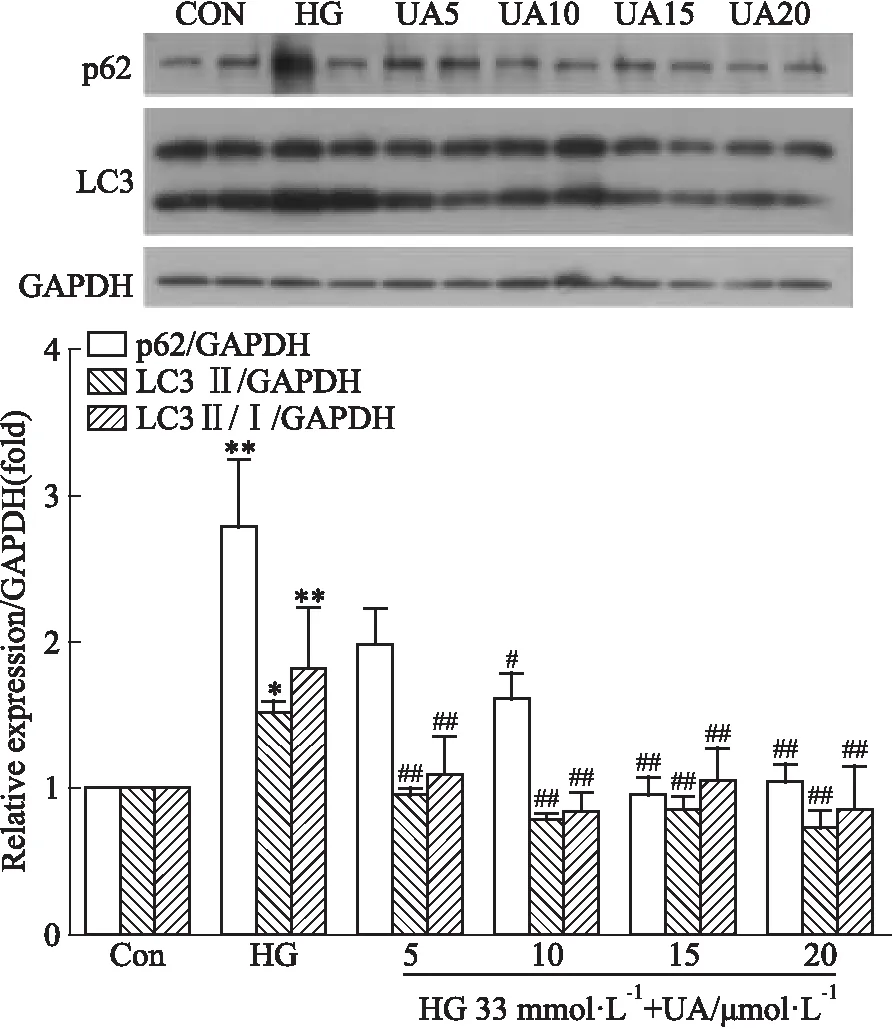
Fig 5 Effect of UA on expression of autophagy related proteins in neonatal rat cardiomyocytes induced by high
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsHG
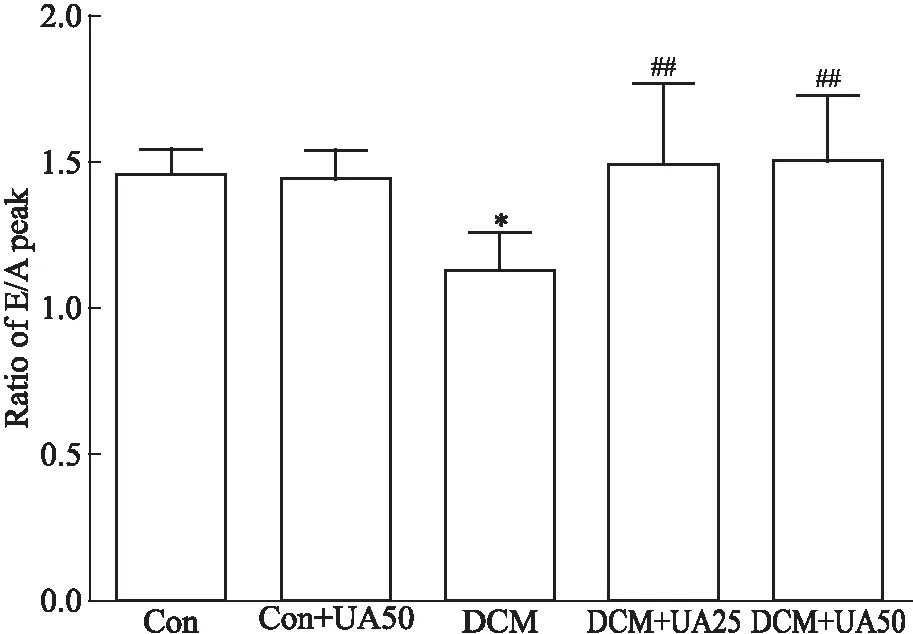
Fig 6 Effect of UA on cardiac function
*P<0.05vscontrol;##P<0.01vsDCM
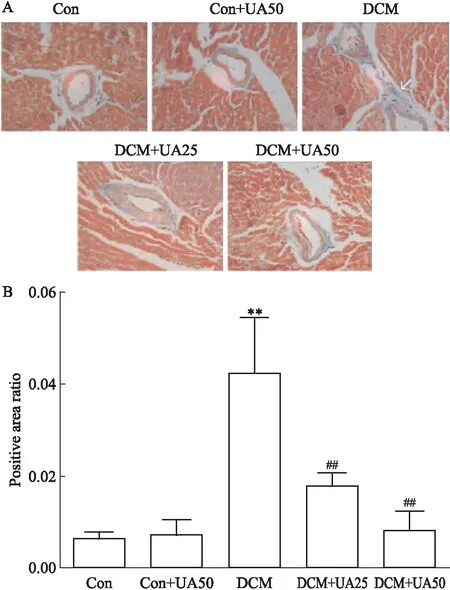
2.7 UA对糖尿病小鼠心肌胶原纤维沉积的影响灌胃给药10 周后,麻醉处死动物,取部分心脏横截面组织制作病理切片,采用Masson染色检测左心室横切面胶原分布情况。如Fig 7所示,对照组与CON+UA50组左心室心肌间血管和心肌间质可见少许胶原纤维沉积;DCM小鼠的胶原纤维沉积更加明显,UA组胶原沉积减少。用Image-Pro Plus 5.0图像处理系统测量胶原纤维阳性区占所观察视野的面积比,结果发现,与对照组相比,DCM组小鼠心肌间质胶原纤维明显增多(P<0.05);与DCM组比较,DCM+UA组小鼠心肌间质胶原纤维明显减少(P<0.05)。
3 讨论
DCM是在1972年由Rubler等[10]首次提出,他研究记录了4例心力衰竭患者除了糖尿病外无其他心血管疾病(冠心病、高血压等),可引起心力衰竭,通过反复研究进而提出了DCM这一概念。DCM早期的病理表现为舒张功能降低,后逐渐出现心脏收缩功能受损,最终发展为心力衰竭,致残致死率极高。DCM过程中的相关分子机制极为复杂,糖基化终产物的蓄积、氧化应激的发生、炎症因子信号通路的启动、自噬等都参与其中[10]。现有研究认为,自噬在DCM进程中发挥着重要的作用[2]。自噬被分为三大类,包括巨自噬、微自噬以及分子伴侣介导的自噬,本实验所指的为巨自噬。自噬在真核细胞是受多种信号分子调控的动态过程,由自噬体的形成、膜的延伸以及自噬溶酶体降解等多个环节组成,其整个过程又被称之为自噬流。我们前期研究也已经证实,急性心梗后心肌细胞自噬被迅速激活,但持续缺血会引起自噬流障碍[11],改善自噬流障碍可发挥抗心肌缺血损伤的作用[12]。在此基础上,我们探讨在糖尿病细胞模型上,自噬该如何改变,UA在DCM模型上能否通过影响自噬来改善DCM。
糖代谢异常是DCM的始发因素,高血糖在DCM形成过程中起关键作用,高糖状态下,心肌肥大、心肌细胞凋亡、心肌间质纤维化发生[10]。本实验发现,33 mmol·L-1高糖可致乳鼠心肌细胞存活率明显降低,同时使细胞内自噬蛋白LC3 Ⅱ及自噬底物p62水平增加,LC3 Ⅱ水平的增加可能是自噬水平增高导致自噬体增多,或是自噬体降解减少导致自噬体堆积[13]。自噬底物p62能与LC3 Ⅱ结合,在自噬溶酶体降解,自噬蛋白LC3 Ⅱ及p62水平同时增加,说明自噬体与溶酶体融合受阻。为了进一步研究在高糖条件下心肌细胞内自噬状态,用溶酶体融合抑制剂氯喹作用于高糖细胞模型,发现并没有额外的LC3 Ⅱ及p62的堆积,说明在33 mmol·L-1高糖处理48 h条件下,心肌细胞内自噬流已发生障碍。
UA是富含鞣花单宁的植物在机体肠道的代谢产物,有研究证明,UA可通过诱导自噬,延长线虫的寿命及改善啮齿类动物的肌肉功能。本实验发现,在高糖细胞模型上给予UA后,自噬蛋白LC3 Ⅱ及自噬底物p62水平下降,改善了细胞内自噬流障碍,糖尿病动物模型小鼠超声心功能及Masson染色均显示,UA有改善DCM作用。有研究表明,二甲双胍通过增强自噬,改善糖尿病心肌损伤[14]。腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)激活促进Bcl-2/Beclin-1复合物解离,并发挥抗糖尿病心肌细胞凋亡作用[15]。这些研究都提示,改善自噬可发挥抗糖尿病心肌损伤作用。
综上所述,UA可起到保护DCM的作用,其机制可能与改善心肌细胞内自噬流障碍有关。本研究为开发新型抗糖尿病心肌损伤的药物研究提供了新的理论基础。