枸橼酸芬太尼对人肝癌HepG2细胞生物学性状的影响①
徐连生 卿 帅 黄世明
(宜宾市第一人民医院麻醉科,宜宾 644000)
原发性肝癌是常见的恶性肿瘤之一,据最新研究显示,肝癌已经成为肿瘤相关死亡的第二大类[1]。原发性肝癌主要包括肝细胞癌、肝内胆管癌和混合型三种,其中肝细胞癌占90%以上[2]。乙/丙型肝炎病毒感染、长期酗酒和其他促发肝硬化的因素都会加大患肝癌的风险[3]。对于早期肝癌患者,手术切除肿瘤是最为有效的方法,但由于患者检测不及时或者切除部位影响肝脏功能,使手术切除率不高[4]。对于不能手术切除的患者,肝脏移植是最好的选择,但是捐赠者的短缺极大限制该技术的应用[5]。目前临床上常用的是射频消融,但是对体积较大的肿瘤治疗效果不佳[6]。靶向药物、化疗药常用于晚期肝癌的治疗,但是容易复发且生存期太短,近年来出现的免疫疗法技术尚不成熟,因此寻找治疗肝癌的新型药物显得尤为重要[7,8]。剧烈疼痛是晚期癌症患者的典型症状,给患者带来极大的痛苦。阿片类镇痛药是治疗长期和短暂性疼痛的最佳药物[9]。枸橼酸芬太尼是人工合成的阿片类强效麻醉镇静剂,镇痛效果是吗啡的50~100倍,具有安全、药效快、副作用小等特点[10]。临床上作为麻醉辅助用药,用于各种外科手术后的镇痛。近来有研究发现,枸橼酸芬太尼能抑制胃癌和乳腺癌的发展,但枸橼酸对肝癌细胞生物学性状的影响还未见报道。本文探究枸橼酸芬太尼对人肝癌HepG2细胞生物学性状的影响。
1 材料与方法
1.1材料 枸橼酸芬太尼注射液由宜昌人福药业提供;人正常肝细胞LO2购自中国科学院上海细胞所;BrdU ELISA检测试剂盒购自Roche公司;人肝癌HepG2细胞株购自ATCC;DMEM、FBS、胰酶、盘尼西林和链霉素均购自Hyclone;CCK-8检测试剂盒购自碧云天生物;凋亡双染试剂盒购自上海复申生物;Ki67、Cleaved-Caspase-3、VEGF鼠抗人一抗购自Abcam;来源于兔的二抗及显影液均购自艾美捷。
1.2方法
1.2.1细胞的培养 将液氮冻存的人肝癌细胞株HepG2细胞迅速转入37℃水浴锅,手动摇晃3 min,1 000 r/min离心5 min,去上清,于10%胎牛血清的DMEM,补充青霉素100 U/ml、链霉素100 mg/ml,37℃ 5%CO2生化培养箱中培养。正常人肝细胞LO2接种于10%胎牛血清的DMEM中,37℃ 5%CO2生化培养箱中培养。
1.2.2CCK8 将100 μl的LO2细胞悬液接种于96孔板中,细胞密度为3×104个/ml,正常条件下预培养12 h;向对应的孔中加入10 μl不同浓度的待测物质,设置空白对照组,每组设置3个复孔,培养箱中孵育24 h;每孔中加10 μl CCK8溶液,培养箱中孵育2 h;用酶标仪检测450 nm处的吸光值。
1.2.3BrdU-ELISA检测细胞增殖 取对数生长期的人肝癌细胞HepG2,胰酶消化制成单细胞悬液,调整细胞密度为1×104个/ml,按照每孔200 μl接种于96孔板,加枸橼酸芬太尼使终浓度为10、20、50 nmol/L,设置空白对照组和背景对照组。培养1、2、3、4 d后,加20 μl的BrdU标记液,继续培养6 h,加Fix Denat使细胞变性,然后每孔加100 μl的辣根过氧化物酶标记的BrdU抗体,洗3次,加100 μl的TMB底物液显色,20 min终止反应。在酶标仪下检测450 nm和630 nm双波长下数值,每组设置3个复孔。
1.2.4流式细胞术检测细胞凋亡 用胰酶消化细胞后,1 000 r/min离心5 min,弃培养液,用预冷的PBS缓冲液清洗3次后重悬沉淀,使细胞密度为1×106个/ml。加入Annexin V-FITC和PI溶液,混匀后室温下避光孵育15 min,加入结合缓冲液,用流式细胞仪检测细胞凋亡情况。
1.2.5划痕实验 实验前用Maker笔于培养板背面画平行的5条直线,灭菌后备用。将细胞传代培养于12孔板中,加入不同剂量的药物后,用10 μl枪头垂直于培养板背面直线划痕,用预冷的PBS洗涤3次后,加入无血清培养液进行培养,于0 h和24 h进行拍照记录,并计算划痕愈合率,划痕愈合率 =(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。
1.2.6Transwell 将人肝癌细胞以无血清培养液培养24 h后,用0.25%胰蛋白酶消化细胞并传代接种于用Matrigel预处理的Transwell小室中,细胞密度为3×105个/ml。小室上层加入无血清培养液培养细胞,下层则加入含血清的正常培养液。24 h后用无菌棉签擦去小室上层细胞,下层细胞染色后计数统计,每个孔随机选择5个视野。
1.2.7Western blot 收集细胞,加含蛋白酶抑制剂的RIPA裂解液,冰上裂解30 min,离心后转移上清。用BCA试剂盒检测总蛋白浓度,加蛋白上样缓冲液,沸水浴10 min,15 000 r/min离心10 min,12%SDS-PAGE分离蛋白后用半干转膜仪转移蛋白质至PVDF膜。用5%脱脂牛奶室温封闭蛋白2 h,随后加入一抗(Ki67,1∶1 000;Cleaved Caspase-3,1∶1 000;VEGF,1∶1 000)于4℃孵育过夜,加入对应二抗室温封闭1 h,最后滴加ECL曝光显影。使用Image-Pro plus6.0分析蛋白条带灰度值。
1.3统计学分析 所有实验数据均用统计软件SPSS18.0进行统计分析。方差齐且服从正态分布则组间比较用One-Way ANOVA,反之则用秩和检验。P<0.01表示差异有统计学意义。
2 结果
2.1不同剂量枸橼酸芬太尼对正常人肝细胞LO2细胞活力的影响 使用不同剂量枸橼酸芬太尼处理LO2细胞后24 h,检测细胞活力。检测结果显示(见图1),IC10为59 nmol/L,当枸橼酸芬太尼浓度在50 nmol/L 及以内时,对正常肝细胞毒性很小。因此本文选择剂量为10、20、50 nmol/L的枸橼酸芬太尼进行后续实验。
2.2枸橼酸芬太尼抑制人肝癌HepG2细胞的活力 HepG2细胞经枸橼酸芬太尼加药处理后,HepG2细胞的增殖倍数明显下降,且随着枸橼酸芬太尼剂量的升高和用药时间的增加,细胞活力下降越明显。加药处理后第4天,HepG2组细胞生长倍数约为6倍,低剂量FC组约为5倍,中剂量FC组低于4倍,高剂量FC组低于3倍,10、20和50 nmol/L的枸橼酸芬太尼均能明显抑制HepG2细胞的活力,且呈时间和浓度依赖效应,见图2。
2.3枸橼酸芬太尼诱导人肝癌HepG2细胞凋亡 HepG2细胞经枸橼酸芬太尼处理后,凋亡细胞比率明显升高,且凋亡细胞比率随着枸橼酸芬太尼剂量的增加而升高。实验结果表明,枸橼酸芬太尼可诱导人肝癌HepG2细胞凋亡,见图3。
2.4枸橼酸芬太尼对人肝癌HepG2细胞Ki67、Caspase-3、VEGF表达的影响 为了进一步探究枸橼酸芬太尼对肝癌细胞增殖、凋亡和血管生成相关蛋白表达的影响,我们用Western blot检测枸橼酸芬太尼处理后HepG2细胞Ki67、Caspase-3,VEGF的蛋白表达水平。HepG2细胞加枸橼酸芬太尼处理后,检测结果显示,Ki67和VEGF的表达水平显著下调,活化Caspase-3的表达水平显著上调,见图4。
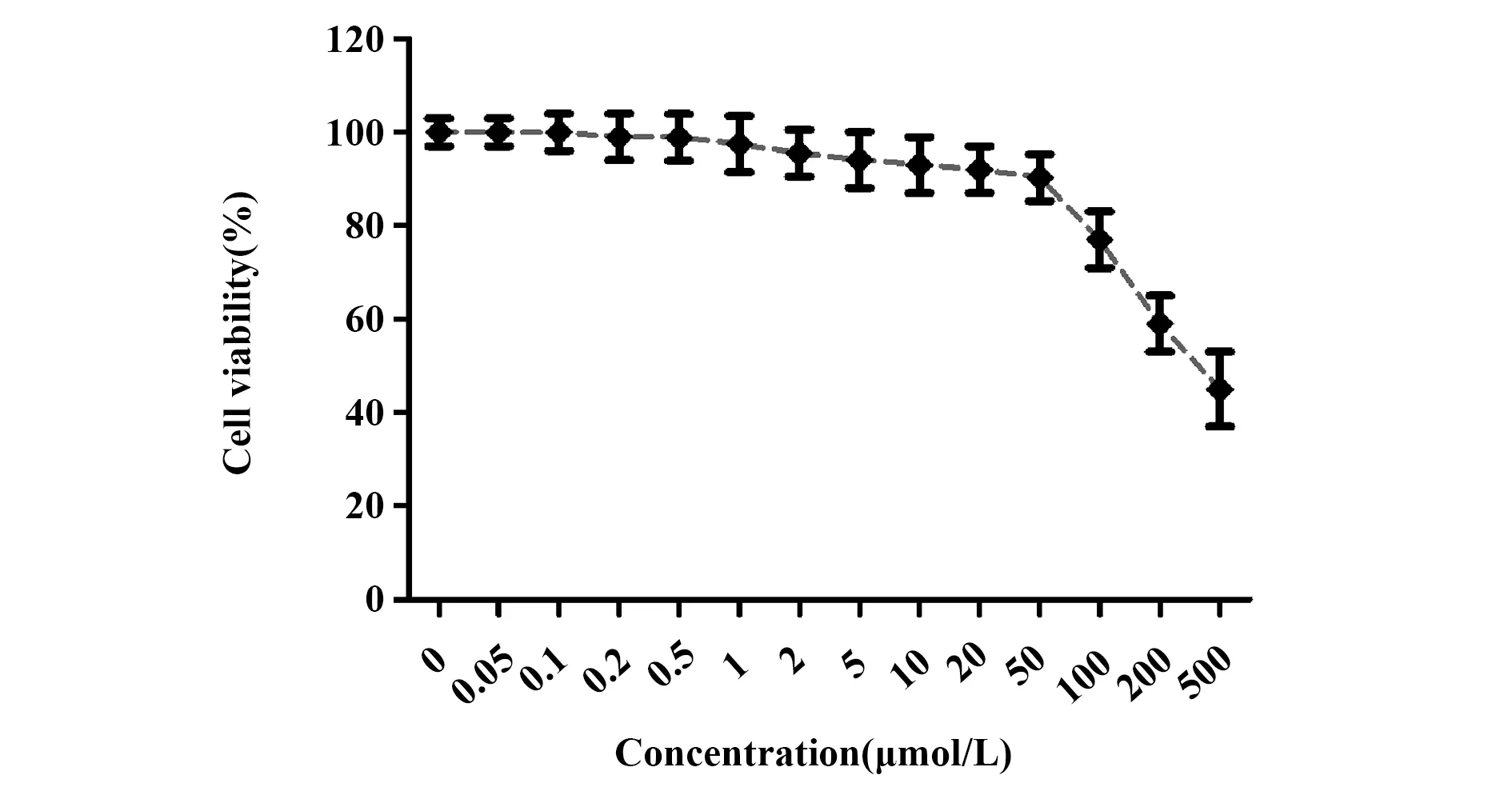
图1 不同剂量枸橼酸芬太尼对正常肝细胞LO2活力的影响Fig.1 Effect of different dose fentanyl citrate on cell viability of human hepatocellular LO2
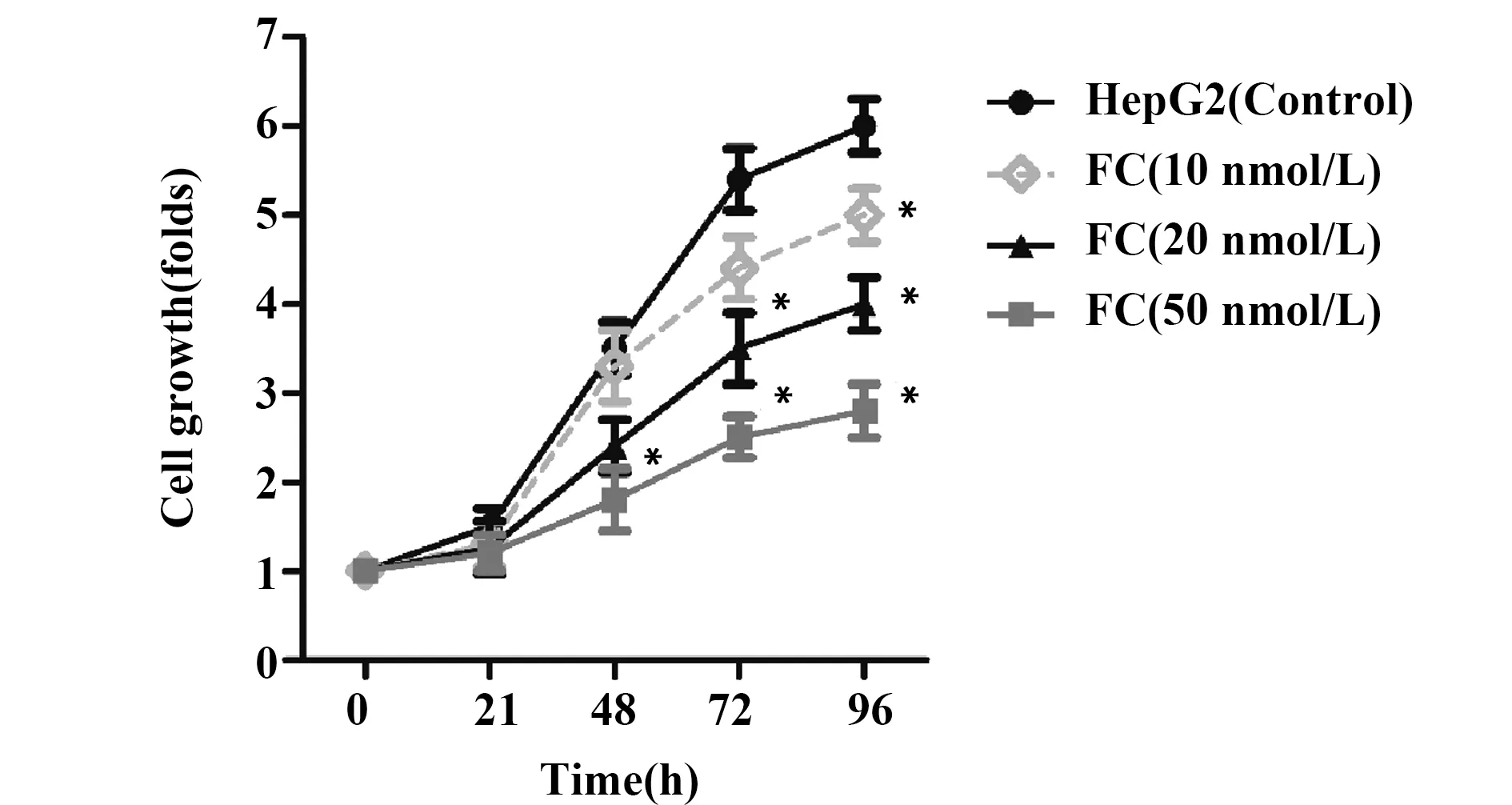
图2 BrdU-ELISA检测枸橼酸芬太尼对人肝癌HepG2细胞活力的影响Fig.2 Effects of fentanyl citrate on cell viability of human hepatocellular carcinoma HepG2 cells was detected by BrdU-ELISANote: *.P<0.01 compared with the control group.
2.5枸橼酸芬太尼抑制人肝癌HepG2细胞侵袭 HepG2细胞经枸橼酸芬太尼处理后, 细胞侵袭数目明显降低。随着枸橼酸芬太尼浓度的增加,侵袭细胞数目逐渐减少,见图5。实验结果表明,枸橼酸芬太尼抑制人肝癌HepG2细胞侵袭,且HepG2细胞的侵袭能力与枸橼酸芬太尼的加药浓度呈负相关。
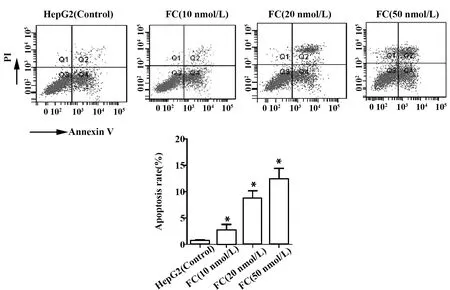
图3 枸橼酸芬太尼对人肝癌HepG2细胞凋亡的影响Fig.3 Effect of fentanyl citrate on cell apoptosis of human hepatocellular carcinoma HepG2 cellsNote: *.P<0.01 compared with the control group.
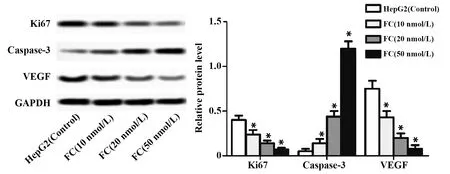
图4 枸橼酸芬太尼对人肝癌HepG2细胞Ki67、Caspase-3、VEGF表达的影响Fig.4 Effect of fentanyl on expression of Ki67,Caspase-3,VEGF of human hepatocellular carcinoma HepG2 cellsNote: *.P<0.01 compared with the control group.
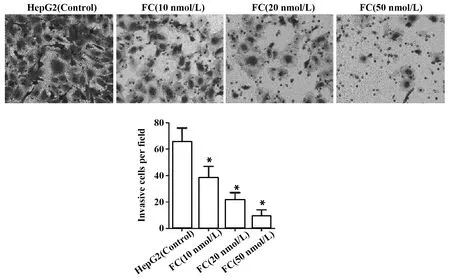
图5 枸橼酸芬太尼对人肝癌细胞HepG2细胞侵袭的影响Fig.5 Effect of fentanyl citrate on cell invasion of human hepatocellular carcinoma HepG2 cellsNote: *.P<0.01 compared with the control group.
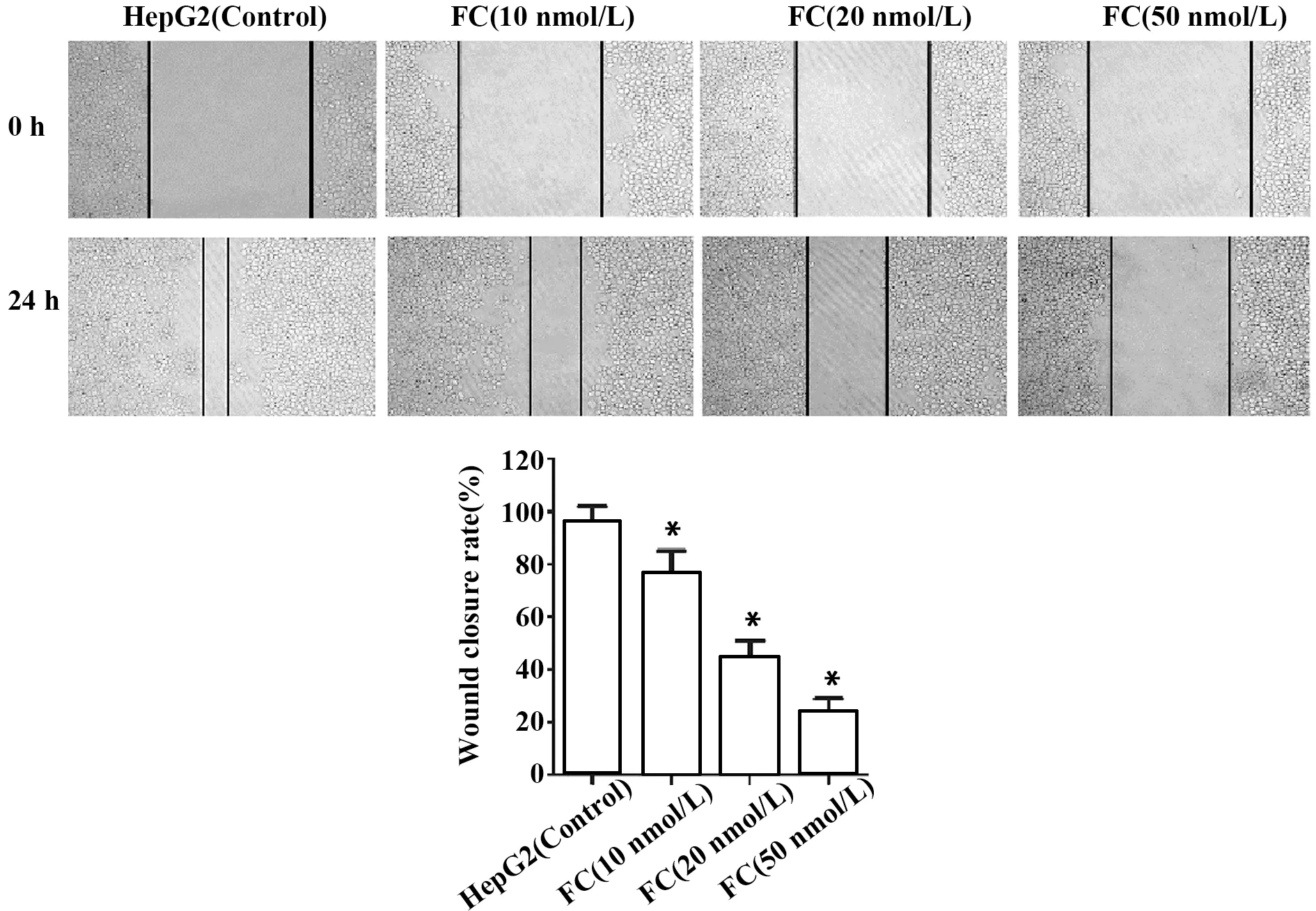
图6 枸橼酸芬太尼对人肝癌细胞HepG2细胞迁移的影响Fig.6 Effect of fentanyl citrate on cell migration of human hepatocellular carcinoma HepG2 cellsNote: *.P<0.01 compared with the control group.
2.6枸橼酸芬太尼抑制人肝癌HepG2细胞迁移 为了进一步研究枸橼酸芬太尼对HepG2细胞迁移能力的影响,我们用划痕实验检测枸橼酸芬太尼处理HepG2细胞24 h后划痕闭合程度。加药组划痕闭合程度明显低于HepG2组,且随着枸橼酸芬太尼剂量的增加,划痕闭合程度越低,见图6。实验结果表明,枸橼酸芬太尼抑制人肝癌HepG2细胞迁移。
3 讨论
肝癌是常见的恶性肿瘤,早期症状不明显,且发展迅速,因此到确诊时常常发现为局部晚期或者发生远端转移,造成治疗困难、预后效果差、生存期短[11,12]。芬太尼是临床上常用的麻醉性镇静剂,用于治疗创伤性疼痛、术后疼痛和癌症疼痛[13]。芬太尼是阿片受体类激动剂,其作用原理与吗啡类似[14]。细胞毒性是指由化学物质引起的单纯的细胞杀伤事件,不依赖于凋亡或坏死的细胞死亡机理[15]。研究显示,化学物质引起体外细胞毒性的浓度与体内血液药物浓度有良好的相关性。体外细胞毒性实验常用于药物筛选时检测药物安全性和选择合适的加药浓度。Chechik等[16]研究发现,正常剂量下,芬太尼对人关节软骨细胞生存能力和增殖没有影响。Ficklscherer等[17]发现,将人成纤维细胞暴露于0.025%芬太尼中7 d,细胞生存能力没有明显改变。根据药物毒性实验,IC10=59 nmol/L,因此本文选择浓度为10、20、50 nmol/L 的枸橼酸芬太尼进行后续实验。
无限增殖是肿瘤的重要特征,有研究显示,芬太尼具有抑制肿瘤生长的作用。如Miao等[18]研究发现,芬太尼能抑制体外胰腺癌细胞株细胞存活,降低移植瘤小鼠肿瘤的生长。Qin等[19]研究显示,芬太尼通过下调NF-κB和上调PTEN,抑制人胃癌MGC803细胞的生长。Ki67是与细胞增殖密切相关的核蛋白,同时与核糖体RNA的转录有联系[20]。Ki67的表达与细胞周期密切相关,因此Ki67被认为是检测恶性肿瘤增殖能力的最可靠的标记蛋白之一[21,22]。BrdU-ELISA结果显示,枸橼酸芬太尼降低人肝癌HepG2细胞的增殖倍数。与BrdU检测结果相对应,Western blot检测结果显示,枸橼酸芬太尼处理后的HepG2细胞Ki67的表达显著下调。与前人研究结果一致,本文研究结果表明,枸橼酸芬太尼抑制人肝癌HepG2细胞增殖。
细胞凋亡是高度有序的多基因参与调控的复杂过程。细胞凋亡异常与肿瘤的发展有着密切的联系。Li等[23]研究发现,芬太尼通过抑制NF-κB的激活,进而抑制下游VEGF-A、MMP-9和BAX/Bcl-2的表达,促进细胞凋亡,抑制人胃癌MGC-803细胞的生长。Caspase家族在介导细胞凋亡的过程中发挥着重要作用,其中Caspase-3是下游关键的执行蛋白分子[24]。正常情况下,Caspase-3以酶原的形式存在于细胞质中,凋亡早期被上游酶切蛋白激活,形成活化的形式。活化后的Caspase-3通过酶切特异性的底物,使DNA不能正常合成、转录和修复,进而导致细胞发生不可逆转的凋亡[25]。研究显示,Caspase-3在肝癌的表达水平显著下调。本文研究结果显示,枸橼酸芬太尼处理后的HepG2细胞Caspase-3显著下调,发生凋亡的细胞数目明显增加,与前人研究结果一致。实验结果表明,枸橼酸芬太尼促进人肝癌HepG2细胞凋亡。
在原发性肿瘤生长早期,肿瘤细胞主要从临近组织微环境中摄取生长所需养分。当肿瘤生长到直径超过1~2 mm后,从周围组织摄取养分已经不能满足需求,此时肿瘤细胞分泌大量的VEGF细胞,促使肿瘤组织血管生成[26]。血管生成不仅为肿瘤的生长提供必要的养分,也为肿瘤的进入血液循环系统提供基本条件。研究显示,在肿瘤生长过程中,癌基因的激活、抑癌基因失活都会引起VEGF的高表达[27]。本文研究发现,人肝癌HepG2细胞经枸橼酸芬太尼处理后,细胞中VEGF的表达显著下调。与前人研究结果一致,实验结果提示,枸橼酸芬太尼可能抑制肿瘤新生血管的形成。
肿瘤从原发部位,经血液或淋巴液等途径散播,到其他部位继续生长称之为肿瘤转移[28]。恶性肿瘤具有侵袭和迁移能力是其难于治愈的主要原因[23]。近年来大量报道芬太尼具有抑制肿瘤运动的能力。如Look等[29]研究发现,芬太尼通过阻断Ets-1对BANCR的调节,进而抑制结直肠癌的侵袭和迁移。Marks等[30]的研究结果显示,芬太尼通过下调miR-182和MMP-9的表达,抑制结直肠癌的增殖和侵袭。本文研究结果显示,枸橼酸芬太尼能抑制人肝癌HepG2细胞侵袭和迁移。综上所述,枸橼酸芬太尼抑制人肝癌HepG2细胞增殖和运动能力,促进细胞凋亡,对人肝癌HepG2细胞具有抑制作用。

