伯氏疟原虫丝/苏氨酸磷酸酶6抗血清对原虫有性阶段发育抑制作用的研究①
孙 林 洪明阳 曹雅明 朱晓彤 崔立旺
(中国医科大学免疫学教研室,沈阳 110122)
疟疾是经蚊媒传播的寄生原虫感染性疾病。迄今为止,全球仍有1.2亿疟疾患者,3亿无症状携带者,每年仍有近百万非洲儿童死于疟疾感染[1]。因此,亟待研发安全有效的疫苗以在全球范围内防治疟疾。疟疾疫苗主要包括红前期、红内期和传播阻断疫苗(Transmission blocking vaccines,TBVs)。其中,TBVs由于其候选抗原表达于蚊阶段原虫,不受人体免疫系统选择压力影响,故具有低多态性和良好的免疫原性[2],被广泛认为是一种在疟疾流行地区降低疟疾传播的有效策略。现已发现多个疟疾TBVs候选抗原,如配子体和配子表面蛋白P48/45与P230,合子和动合子期表面蛋白P25和P28,蚊阶段原虫表面蛋白HAP2(Hapless 2 protein)[3-5]。尽管上述TBVs候选抗原具有一定的传播阻断效应,但仍不能完全阻断疟原虫传播。因此,筛选并研发新的TBVs候选抗原将为阻断疟疾在流行区的传播提供必要的理论依据。
疟原虫复杂的生活史包括人体内的无性裂体增殖和按蚊体内的有性生殖两个阶段。其中,有性发育阶段始于雌性按蚊吸食疟原虫感染患者血液。雄/雌配子体随同血液进入蚊胃。在蚊胃内环境刺激下,雄配子体经历3次有丝分裂,并通过“出丝”破裂宿主红细胞而发育为8个雄配子。雄/雌配子结合成合子,进而发育成动合子。动合子穿越蚊胃壁发育成卵囊,随后发育为子孢子。子孢子进入蚊唾液腺,随按蚊再度叮咬感染新的宿主[6]。多种蛋白磷酸酶(Protein phosphatases,PPs)和蛋白激酶(Protein kinases,PKs)参与疟原虫有性阶段发育中的信号转导调控[7]。因此,PPs和PKs为小分子药物的有效作用靶位,同时也是疟疾TBVs潜在的候选抗原[8]。
蛋白丝/苏氨酸磷酸酶(Serine/threonine protein phosphatase)参与细胞分裂、转录、翻译、凋亡和RNA剪接等细胞发育过程。蛋白磷酸酶6(PPP6)属于PP2A家族,在调控细胞功能过程中发挥重要作用[9,10]。与 Mg2+依赖性磷酸酶家族的其他成员一样,PPP6能够将无机底物以及多肽去磷酸化。此外,PPP6蛋白磷酸酶活性可被冈田酸抑制[11-13]。氨基酸序列预测分析显示,伯氏疟原虫PPP6的催化结构域与磷酸化丝/苏氨酸蛋白磷酸酶(Phosphoserine and phosphothreonine residues phosphatases,PPPs)其他成员高度同源且保守[14]。鉴于PPPs在疟原虫生活周期中具有不可替代的作用,其可作为疟疾防治的潜在靶位。本项目采用生物信息学方法选取伯氏疟原虫PPP6(PbANKA_041210)蛋白,扩增其编码基因,构建原核表达载体,表达并纯化PPP6重组蛋白。免疫小鼠后,通过ELISA和Western blot方法评估PPP6蛋白的免疫原性和免疫反应性,并通过体内外传播阻断实验评估抗PPP6免疫血清的传播阻断效果,以期为研制新型高效疟原虫TBVs提供理论依据。
1 材料与方法
1.1实验材料 6~8周龄雌性BALB/c小鼠购自北京实验动物研究所;Pb.ANKA 2.34原虫及基因组DNA(gDNA)由中国医科大学免疫学教研室保存。KOD-Plus-Neo(Toyobo);Rosetta(DE)competent cell、限制性内切酶BamHⅠ和NotⅠ、T4 DNA连接酶、TaKaRa Agarose Gel DNA Extraction Kit v4.0(TaKaRa);快速质粒小提试剂盒(天根);LB Broth(Solarbio);氨苄青霉素(Genview);IPTG、Tween-20(北京鼎国);HisPurTMNi-NTA Magnetic Beads、SuperSignal West Pico Chemiluminescent Substrate、Goat anti-Mouse IgG(H+L)Secondary Antibody,HRP、6×His Tag Monoclonal Antibody、ECL试剂盒 (Thermo Fisher Scientific);anti-tubulin Ⅱ antibody(Abcam);1640培养基(Gibco);胎牛血清(Hyclone);脱脂奶粉(BD DifcoTMSkim Milk);弗氏佐剂(Sigma-Aldrich);Pbs21抗体由教研室自己制备。
1.2实验方法
1.2.1PPP6(PlasmoDB ID:PbANKA_041210)基因合成及原核表达载体构建 以Pb.ANKA原虫gDNA为模板,采用引物:PPP6-BamHⅠF:5′-cgcggatccACTAGGGGAGACGAAAAAAAATGG-3′;PPP6-NotⅠ R:5′-ttttccttttgcggccgcTAAAAAATACGGAAT-GGTCGC-3′,扩增PPP6基因功能区域。将上述PCR产物进行琼脂糖凝胶电泳,切胶纯化后,经BamHⅠ和NotⅠ限制性内切酶37℃孵育2 h,纯化回收。pET32a(+)原核表达载体采用BamHⅠ和NotⅠ双酶切后回收纯化。采用T4连接酶16℃过夜连接pET32a(+)载体和PPP6-DNA片段酶切产物,构建pET32a(+)-PPP6表达载体。连接产物转化至宿主菌Rosetta(DE)Competent Cell,菌落PCR鉴定选取阳性克隆后,质粒小提,送华大基因公司测序。采用MEGA7.0软件,将测序结果与PlasmoDB(http://www.plasmodb.org)数据库中PPP6基因组DNA序列进行比对分析。
1.2.2重组蛋白的表达、纯化与实验动物免疫 选取pET32a(+)-PPP6阳性克隆菌液加入LB培养基中,经1 mmol/L IPTG诱导后20℃过夜摇菌表达重组蛋白,采用HisPurTMNi-NTA Magnetic Beads纯化PPP6-his重组蛋白并检测蛋白浓度。将纯化的重组蛋白用10%的聚丙烯酰胺凝胶电泳分离,使用25 V、30 min 半干法转膜条件,使用5%脱脂奶粉封闭,4℃过夜。将封闭后的PVDF膜用TBST漂洗3次后,采用6×His Tag Monoclonal Antibody(1∶2 000)孵育PVDF膜,室温1 h。用TBST洗涤3次,每次10 min,采用HRP标记的山羊抗小鼠IgG二抗孵育PVDF膜,室温1 h,TBST洗涤6次,每次5 min。采用ECL发光方法,荧光图像分析系统中检测结果。实验动物免疫方法为6~8周龄BALB/c雌性小鼠随机分为2组,每组5只,组1免疫PPP6重组蛋白(PPP6);组2为PBS对照组(PBS)。隔周皮下免疫一次,共免疫3次,初次免疫重组蛋白(50 μg/只)与完全弗氏佐剂充分混合,二免和三免中重组蛋白与不完全弗氏佐剂混合。
1.2.3血清特异性抗体水平检测 用溶解在碳酸盐缓冲液的PPP6重组蛋白(10 μg)包被96孔酶标板,4℃过夜。采用含1%BSA的PBST封闭,37℃ 1 h,PBST清洗3次。以PBS缓冲液连续倍比稀释免疫后不同时间点小鼠抗PPP6免疫血清,每孔100 μl,37℃孵育2 h,PBST清洗3次后,加入1∶5 000 倍稀释的HRP标记的羊抗鼠IgG,孵育1 h,PBST清洗后,加入底物邻苯二胺和过氧化氢进行显色,酶标仪检测450 nm处OD值。
1.2.4抗PPP6免疫血清对原虫有性发育阶段抑制效果观察 采用1×107个Pb.ANKA感染BALB/c小鼠,待感染后第3天,感染率达5%时取10 μl小鼠尾血与40 μl动合子培养基(1640培养基+25%胎牛血清)混合,并将抗PPP6免疫血清按1∶5稀释加入动合子培养基中,放置于25℃培养箱中培养15 min 后,取1 μl涂片,并于10 min内计数40个视野,计数配子体出丝的数目。取10 μl血液置于90 μl 动合子培养液中,加稀释的重组蛋白/对照免疫的小鼠血清(1∶5)。疟原虫在19℃培养24 h。用抗Pbs21抗体固定和标记培养物,在荧光显微镜下计数动合子数目并计算动合子形成率。采用1×107个Pb.ANKA感染BALB/c小鼠,待感染后第3天,感染率达到3%,放置于饥饿12 h的雌性按蚊蚊笼中吸食血液30 min,去除未吸血的按蚊,吸血后的按蚊于10 d后解剖计数蚊胃壁的卵囊数及蚊感染率。
1.3统计学方法 应用GraphPad Prism 6.0统计软件对实验数据进行统计分析,原虫血症的组间比较采用Student′st检验,配子体出丝和动合子转化率实验组间比较采用Mann-Whitney U检验,P<0.05表示差异具有统计学意义。
2 结果
2.1pET32a (+)-PPP6载体构建及其表达和纯化 本研究中成功构建了pET32a (+)-PPP6原核表达载体,并转至大肠杆菌Rosetta(DE)Competent Cell表达系统,加入1 mmol/L IPTG,经16℃诱导20 h 后,SDS-PAGE电泳分析可见大量可溶性PPP6重组蛋白(约38 kD)的表达。使用HisPurTMNi-NTA Magnetic Beads柱纯化重组蛋白,并对洗脱及透析后的样品进行Western blot检测,可清晰看到目标蛋白条带约38 kD,大小符合目的蛋白分子量。其蛋白纯度>85%,浓度可达到1 mg/ml,见图1A、B。ELISA结果显示,抗PPP6免疫血清抗体滴度为1∶3 200,见图1C。
2.2抗PPP6免疫血清对雄配子体出丝的影响 为观察抗PPP6免疫血清传播阻断效果,本研究首先通过体外实验观察抗PPP6免疫血清对雄配子体出丝的抑制作用。与PBS免疫血清处理的对照组相比,1∶5倍稀释的抗PPP6免疫血清可使配子体出丝数目减少62.5%(P<0.000 1),提示抗PPP6免疫血清可影响雄配子出丝功能,见图2。
2.3抗PPP6免疫血清对体外动合子期原虫发育的影响 如图3A所示,1∶5倍稀释的抗PPP6免疫血清与原虫进行体外动合子培养24 h后可使动合子数目显著下降65.3% (P<0.000 1)。动合子转化率观察显示,1∶5倍稀释的抗PPP6免疫血清可显著抑制动合子转化率,使动合子转化率下降42.07%(P<0.000 1,图3B)。上述结果提示抗PPP6免疫血清可体外抑制动合子的形成和分化。
2.4抗PPP6免疫血清对囊合子形成数量的影响 采用100 μl抗PPP6免疫血清尾静脉输入Pb.ANKA原虫感染3 d的BALB/c小鼠体内,1 h后对感染小鼠进行蚊饲1 h,10 d后计数蚊胃内囊合子数量。本研究发现,吸食抗PPP6免疫血清过继转移组小鼠血液的按蚊胃内囊合子形成显著减少(P<0.000 1,图4)。与对照组相比,蚊感染率下降8.39%,而蚊胃内囊合子密度减少68.91%,见表1。上述结果提示抗PPP6免疫血清可抑制蚊体内囊合子形成。

图1 PPP6重组蛋白表达检测Fig.1 Expression of recombinant PPP6 proteinNote: A.The coomassie brilliant blue staining result of recombinant PPP6 protein.B.Western Blot detection of recombinant PPP6 protein by using 6×His Tag Monoclonal Antibody (1∶2 000 dilutions).Arrows indicate recombinant PPP6 proteins.C.ELISA assay for antibody titer detection of anti-PPP6 serum.*.P<0.05;**.P<0.01;***.P<0.001.

图2 抗PPP6免疫血清对雄配子体出丝的影响Fig.2 Effect of anti-PPP6 serum on male gametocyte exflagellationNote: PBS.PBS immunized group;PPP6.Recombinant Plasmodium berghei PPP6 protein immunized group.****.P<0.000 1.tubⅡ.anti-tubulin Ⅱ antibody.Arrows indicate microgamete exflagellation.

图3 抗PPP6血清对动合子数目和形成率的影响Fig.3 Effect of anti-PPP6 serum on ookinete number and ookinete conversion rateNote: A.The effect of anti-PPP6 serum on ookinete number.B.The effect of anti-PbPPP6 serum on ookinete conversion rate.PBS.PBS immunized group;PPP6.Recombinant Plasmodium berghei PPP6 protein immunized group.****.P<0.000 1.P21.Anti-Pbs21 mAb.
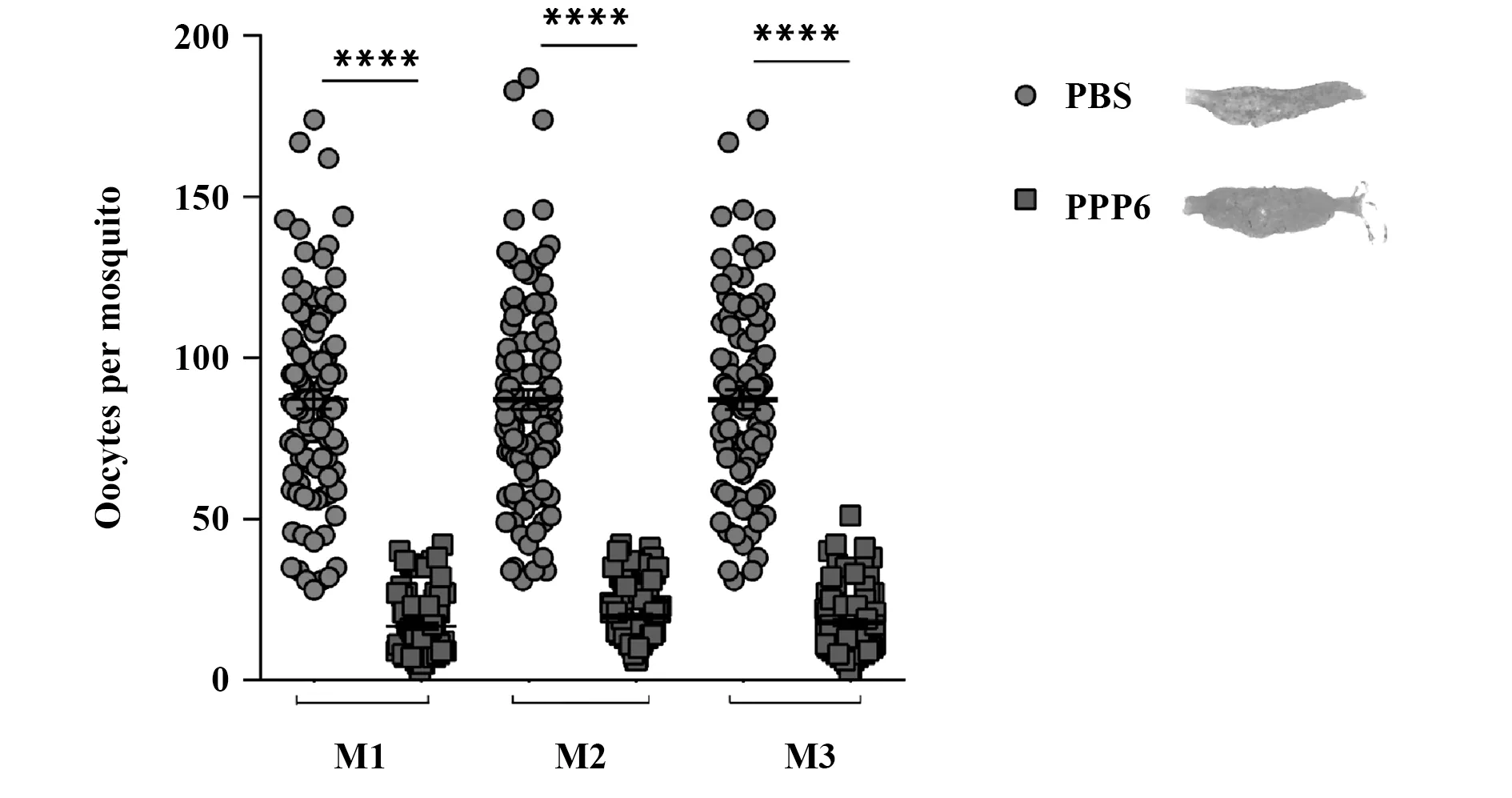
图4 抗PPP6血清对囊合子形成的抑制作用Fig.4 Inhibitory effect of anti-PPP6 serum on oocysts formationNote: PBS.PBS immunized group;PPP6.Recombinant Plasmodium berghei PPP6 protein immunized group.****.P<0.000 1.M1,M2 and M3 represents three times biological replicates.Right panels are representative oocysts′ figures from mosquito midgut of PBS and PPP6 group,respectively.
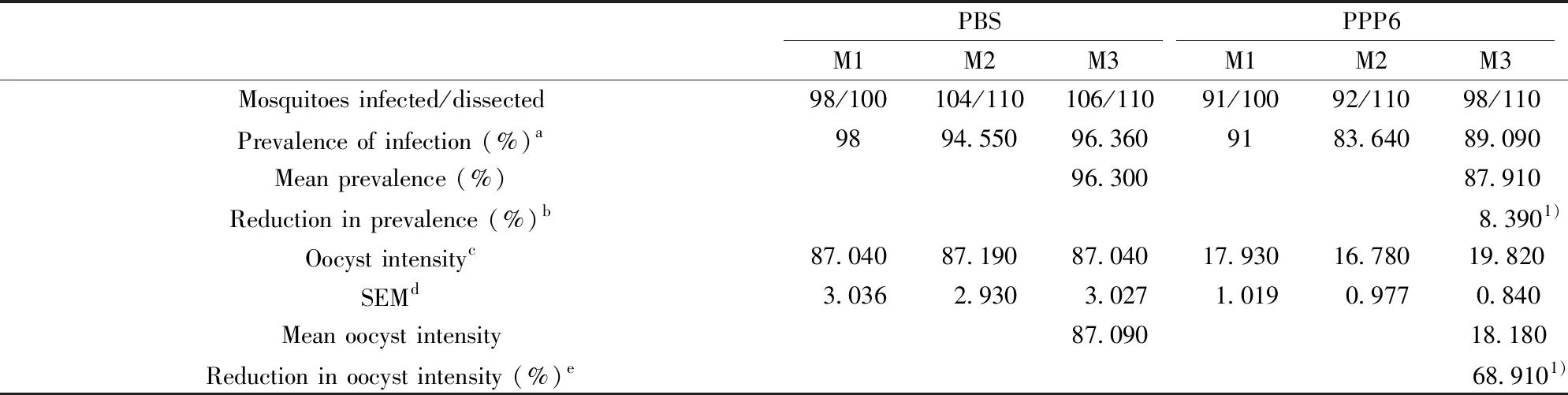
表1 抗PPP6免疫血清传播阻断效果Tab.1 Transmission blocking effect of anti-PPP6 serum
Note:1)P<0.05 for comparisons between the experimental group and the control group.a.The prevalence of infection was calculated by the number of mosquitoes with oocysts/total mosquitoes dissected in each group×100%;b.The percent reduction of prevalence was calculated as % mean prevalencecontrol-% mean prevalencerPb51;c.Mean number of oocysts per mosquito midgut;d Standard error of the mean;e.The percent reduction in oocyst intensity was calculated as (mean oocyst intensityPBS-mean oocyst intensityPPP6)/mean oocyst intensityPBS×100%.
3 讨论
蛋白磷酸化与去磷酸化是真核细胞信号转导的共同通路,其动态变化几乎涉及从胚胎发育到个体成熟的所有过程,包括细胞的癌变和凋亡[15]。磷酸化与去磷酸化的平衡主要由PKs和PPPs调控。其中PKs的研究目前已经取得一定成果,并被普遍认为是抗疟重要靶位,关于疟原虫PPPs的研究近几年也已成为热点。根据氨基酸序列的同源性、结构特征和催化机制的不同,PPP分为三个家族:PPPs、磷酸化酪氨酸蛋白磷酸酶(Phosphotyrosine residues phosphatases,PTPs)和 Mg2+依赖的磷酸化丝/苏氨酸蛋白磷酸酶(Mg2+-dependent phosphoserine and phosphothreonine residues phosphatases,PPMs)。PPPs由PP1、PP2A、PP2B、PP5和PP7 等亚家族组成[16]。PPP6属于PP2A家族,其研究尚处于起步阶段。本研究中,我们选取伯氏疟原虫丝/苏氨酸磷酸酶PPP6蛋白,探讨其免疫血清对疟原虫有性阶段生长发育的影响[12]。
经典的TBVs候选抗原,如:配子受精前期靶抗原P45/48、P230,受精后期靶抗原P25、P28和 蚊 虫 中 肠 靶 抗 原HAP2均为原虫有性阶段表面蛋白。P25和P28为动合子表面蛋白,介导动合子侵入胃壁上皮细胞[17-19]。Pvs25已经进入了Ⅰ期临床试验,Pvs25疫苗可减少80%的卵囊形成,并降低20%~30% 的按蚊感染率,但其传播阻断效果未达到100%[20]。本课题组前期研究发现,PPP6蛋白主要表达在原虫有性发育阶段(结果未显示)。本研究中,采用PPP6重组蛋白免疫后,ELISA实验检测发现小鼠血清中抗PPP6特异性抗体水平显著升高。同时,Western blot结果显示抗PPP6免疫血清可以特异性结合内源性PPP6蛋白。上述实验结果提示伯氏疟原虫PPP6重组蛋白免疫后的抗血清具有良好的免疫原性和抗原性,为其作为TBVs候选抗原提供了理论基础。抗PPP6免疫血清在体外可显著抑制配子体出丝,与对照组相比,出丝数量减少62.5%,提示其可抑制雄配子体发育,并影响后续发育阶段中的雄/雌配子体受精过程。前期研究中发现,PPP6蛋白在有性发育阶段高表达,并定位于配子体和动合子期原虫胞浆膜内侧。由于有性阶段原虫胞膜的高通透性可使免疫血清中特异性抗体进入细胞内部,进而与特异性抗原结合。为明确抗PPP6免疫血清的传播阻断效果,我们分别进行体外动合子培养和蚊体内卵囊形成实验。与预期研究结果一致,当在动合子培养基中加入1∶5的抗PPP6免疫血清时,其对动合子形成的抑制效果明显,大于40%的原虫停滞在未成熟动合子阶段。同时,蚊体内卵囊形成实验显示,抗PPP6血清可显著抑制蚊胃内卵囊形成,证实抗PPP6免疫血清的良好传播阻断效果。由于PPP6蛋白在伯氏疟原虫中的多个发育阶段均有表达,因此抗PPP6的免疫血清可能对伯氏疟原虫的其他发育阶段也存在影响,如子孢子的形成及其感染能力等。此假设尚需后续实验进行验证。同时,抗PPP6免疫血清对红内期原虫生长发育的作用尚需深入研究。
综上所述,本研究对伯氏疟原虫PPP6蛋白免疫小鼠后的免疫原性和免疫反应性及抗PPP6免疫血清的传播阻断效应进行了研究。实验结果证实PPP6具有良好的免疫原性和免疫反应性。通过使用鼠疟模型确定了伯氏疟原虫PPP6蛋白作为新型TBVs候选抗原的传播阻断能力,并为恶性疟原虫和间日疟原虫PPP6蛋白作为疟疾TBVs候选抗原的可行性提供了必要的理论依据。

